
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2017年11月20日
過剰発現した野生型SOD1はiPS細胞由来脊髄運動神経細胞においてALS関連ミスフォールド構造を呈する
ポイント
- 変異型のSOD1遺伝子注1が過剰に発現している筋萎縮性側索硬化症(ALS)注2モデルマウスからiPS細胞を樹立し、脊髄運動神経細胞注3へ分化誘導したところ、毒性をもつ、病的構造変化を起こしたSOD1タンパク質が蓄積していることがわかりました。このタンパク質は、ALS患者さんの細胞にも存在することが知られています。
- 遺伝子変異のない野生型注4のSOD1遺伝子が過剰に発現しているマウスからiPS細胞を樹立し、脊髄運動神経へ分化誘導したところ、この脊髄運動神経細胞でも、病的構造変化を起こしたSOD1タンパク質が蓄積していることがわかりました。
- 以上から、変異のないSOD1タンパク質であっても、その量が増加すると、毒性を有するSOD1タンパク質へと構造変化することが明らかになりました。
小松研一医師(当時京都大学大学院医学研究科臨床神経学、現・北野病院)、高橋良輔教授(京都大学大学院医学研究科臨床神経学)、今村恵子助教および井上治久教授(京都大学CiRA増殖分化機構研究部門幹細胞医学分野)らの研究グループは、変異型SOD1遺伝子を過剰に発現した筋萎縮性側索硬化症(ALS)モデルマウス及び野生型SOD1遺伝子を過剰に発現したマウスから樹立したiPS細胞を用いて脊髄運動神経細胞を作製し、ALSに関連する病気のしくみの一端を明らかにすることに成功しました。
ALSは、全身の筋力低下と呼吸不全をきたす難治性の病気です。ALSには家族性のものとそうでない孤発性のものがありますが、家族性ALSにおいて、日本でもっとも多い原因はSOD1遺伝子の変異です。変異型SOD1遺伝子の情報をもとに作られるSOD1タンパク質は、タンパク質の構造が通常と異なる形に変化(ミスフォールド注5)することで神経細胞への毒性を呈すると考えられています。ところが、SOD1遺伝子の変異をもつALS患者さんだけでなく、SOD1遺伝子に変異のないALS患者さんの細胞内でも、何らかの条件下でSOD1タンパク質が構造変化を起こして、病気の発症に関与している可能性が考えられてきました。
本研究では、ALS患者さんで見出された変異型SOD1遺伝子を過剰に発現するマウスと、変異のない野生型SOD1遺伝子を過剰に発現するマウスからiPS細胞を作製し、正常な細胞と比較することでALSの病態解析を行いました。樹立したiPS細胞を運動神経細胞へ分化させ、構造変化を起こしたSOD1タンパク質に反応する2種類の抗体注6を用いて解析を行いました。その結果、変異型SOD1遺伝子を過剰に発現するマウスに由来する運動神経細胞だけでなく、野生型SOD1遺伝子を過剰に発現する運動神経細胞にも、構造変化を起こしたSOD1タンパク質が蓄積していることがわかりました。これにより、変異のないSOD1タンパク質であっても、その量が過剰に増加する条件下では、毒性を有するSOD1タンパク質に構造変化することが明らかになりました。今後、ALSに関与する重要な分子変化の一端を再現するこの細胞モデルを用いた研究を進めることで、病気のしくみのさらなる解明と治療法の開発につながることが期待されます。この研究成果は2017年11月に国際科学誌「NeuroReport」でオンライン公開されました。
ALSは中高年で発症する病気で、運動神経細胞が機能を失ったり消失したりするために、手足の筋力低下とともに呼吸不全が進行し死に至るきわめて難治性の病気です。本邦には約9,000人の患者さんがいると考えられています。これまで多くの研究がなされていますが、その発症のメカニズムはまだ十分には解明されておりません。
ALSには家族性のものとそうでない孤発性のものがありますが、家族性ALSにおいて、日本でもっとも多い原因はSOD1遺伝子の変異です。変異のあるSOD1タンパク質は、タンパク質の構造が変化(ミスフォールド)していることで神経細胞への毒性を生じていると考えられています。ところが、SOD1に変異のない孤発性ALSでもSOD1タンパク質が構造変化を起こしていて、病気の発症に関与していることがわかってきています。正常なSOD1タンパク質がどのようにして構造変化を起こし、病気に影響しているのかは、ヒトの運動神経細胞が入手困難ということもあり、詳細はよくわかっていません。そこで本研究グループは、ALSモデルマウスである変異型SOD1遺伝子を過剰に発現するマウスと、野生型のSOD1遺伝子を過剰に発現するマウスからiPS細胞を樹立し、脊髄運動神経細胞へと分化誘導することで解析を行いました。
1) SOD1遺伝子過剰発現マウス由来iPS細胞からの脊髄運動神経細胞の作製
まず、研究グループはSOD1遺伝子過剰発現マウス2種類(変異型SOD1遺伝子過剰発現マウスと野生型SOD1遺伝子過剰発現マウス)と、正常マウスからiPS細胞を樹立しました。これらを脊髄運動神経細胞へ分化させると、脊髄運動神経細胞として特徴的なタンパク質をもっていることが確認されました(図1)。
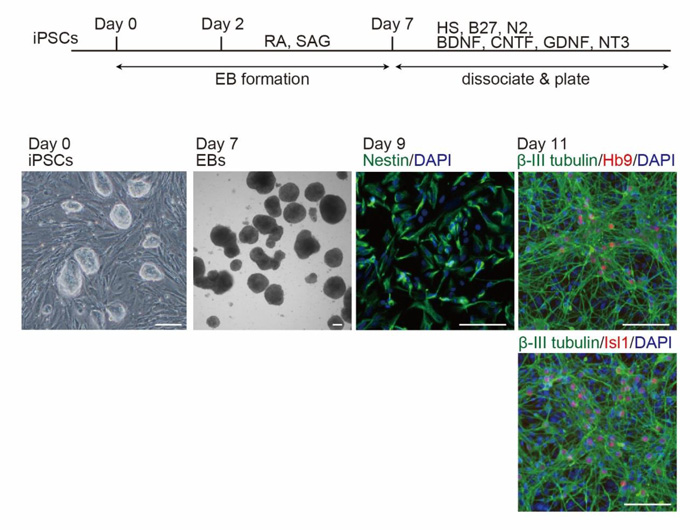
図1. iPS細胞から脊髄運動神経細胞への分化
分化第9日目には神経幹細胞に特徴的なタンパク質であるNestinを発現し、第11日目には脊髄運動神経細胞に特徴的なタンパク質であるHb9やIsl1を発現している。iPSCs;iPS細胞、EBs;胚様体、DAPI;核。Scale bar; 100μm.
2) SOD1遺伝子過剰発現マウス由来iPS細胞から作製した脊髄運動神経細胞では、構造変化を起こしたSOD1タンパク質を認める
構造変化(ミスフォールド)を起こしたSOD1タンパク質に主に反応する抗体を2種類用いて、iPS細胞由来脊髄運動神経細胞を解析しました。一方の抗体では、変異型SOD1遺伝子を過剰発現している運動神経細胞だけで構造変化を起こしたSOD1タンパク質が検出されました。それに対して、もう一方の抗体では、野生型SOD1遺伝子を過剰発現している運動神経細胞においても構造変化を起こしたSOD1タンパク質が検出されました(図2)。以上から、2種類の抗体の間でミスフォールド構造の検出感度に違いがあることもわかりました。
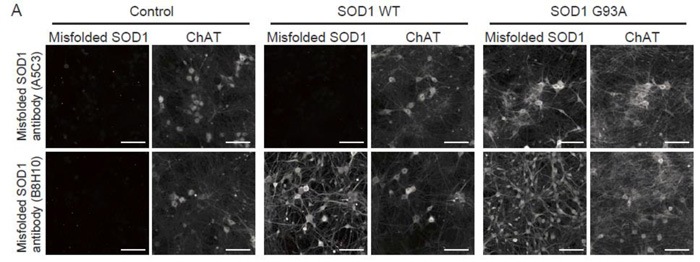
図2. iPS細胞由来脊髄運動神経細胞におけるミスフォールドSOD1タンパク質の検出
ミスフォールドSOD1タンパク質を検出する2種類の抗体のうち、A5C3では、変異型SOD1遺伝子が過剰発現している運動神経細胞のみでSOD1タンパク質の構造変化が検出された。B8H10では、野生型SOD1遺伝子が過剰に発現している運動神経細胞でもSOD1タンパク質の構造変化が検出された。
Control;正常なマウスのiPS細胞に由来する脊髄運動神経細胞、SOD1 WT;野生型SOD1遺伝子が過剰発現している脊髄運動神経細胞、SOD1 G93A;変異型SOD1遺伝子が過剰発現している脊髄運動神経細胞、ChAT;コリンアセチルトランスフェラーゼ(運動神経細胞を示す指標)。
本研究では、変異型SOD1遺伝子過剰発現マウス由来iPS細胞および野生型SOD1遺伝子過剰発現マウス由来iPS細胞を用いて脊髄運動神経細胞を作製し、変異型SOD1遺伝子過剰発現運動神経細胞だけでなく、野生型SOD1遺伝子過剰発現運動神経細胞においてもSOD1タンパク質の構造変化が生じていることを明らかにしました。家族性ALSだけでなく孤発性ALSにおいても病気の発症プロセスに関与すると考えられているSOD1タンパク質の構造変化が、SOD1タンパク質の量の変化により生じ得ることを見出し、脊髄運動神経細胞で再現したことは、今後のALSの病気のメカニズムのさらなる研究や治療法の探索に貢献するものと期待されます。
- 論文名
"Overexpressed wild-type superoxide dismutase 1 exhibits amyotrophic lateral sclerosis-related misfolded conformation in induced pluripotent stem cell-derived spinal motor neurons" - ジャーナル名
NeuroReport - 著者
Kenichi Komatsu1,2*, Keiko Imamura3*, Hirofumi Yamashita1, Jean-Pierre Julien4, Ryosuke Takahashi1, Haruhisa Inoue3#
* 筆頭著者
# 責任著者 - 著者の所属機関
- 京都大学大学院医学研究科 臨床神経学
- 公益財団法人田附興風会医学研究所北野病院 神経内科
- 京都大学iPS細胞研究所(CiRA)
- Department of Psychiatry and Neurosciences, Research Centre of Mental Health Institute of Quebec (IUSMQ), Laval University, Québec, Canada
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再⽣医療実現拠点ネットワークプログラム(疾患特異的iPS細胞を活⽤した難病研究)
- 公益財団法人 持田記念医学薬学振興財団
- 公益財団法⼈ 第⼀三共生命科学研究振興財団
注1) SOD1遺伝子
家族性ALSの原因遺伝子の1つ。ALS(筋萎縮性側索硬化症、注2参照)は、およそ90%が家族歴のない孤発性で、残りの10%が家族性である。家族性ALSは遺伝子に変異があることによって病気を発症し、およそ20%がSOD1遺伝子の変異によって生じる。SOD1遺伝子の情報をもとにSOD1タンパク質が作られるが、SOD1遺伝子に変異があるとSOD1タンパク質が構造変化を起こし、神経細胞に対する毒性をもつようになる。
注2) 筋萎縮性側索硬化症(Amyotrophic lateral sclerosis: ALS)
運動神経細胞に異常が生じることで、全身の筋肉が徐々に動かなくなる病気。これまでに根治的な治療法は確立されておらず、日本では特定疾患に認定されている。
注3) 脊髄運動神経細胞
運動神経細胞は脳から筋肉へ動きの指令を伝える神経細胞であり、脳と脊髄に存在するが、そのうち脊髄に存在するものを脊髄運動神経細胞と呼ぶ。
注4) 野生型
同じ種の生物の中で、最も基本的と考えられる特徴を備えた個体や遺伝子のこと。
注5) ミスフォールド
タンパク質は、細胞内で遺伝子(DNA)がRNAを経て鎖状のアミノ酸へと翻訳され、アミノ酸がその配列に応じて固有の立体構造に折りたたまれて(フォールド)作られ、タンパク質本来の働きを持つようになる。しかし、何らかの理由で本来の立体構造とは異なる構造へ折りたたまれたり、立体構造が変化したりすることがあり、これをミスフォールドと呼ぶ。
注6) 抗体
ある物質に特異的に結合し、その物質を壊すもの。生体においては、体に入ってきた異物(抗原)を除去するはたらきをもつ。ここでは、特定の物質だけに特異的に結合するという特徴を生かして、特定のタンパク質を検出するために用いられている。






















