
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2018年11月20日
人工RNA論理回路で細胞の運命を制御する
ポイント
- 安全性の高いRNAを用いて、細胞内の複数のマイクロRNA(miRNA)注1を目印に細胞の状態を検知して細胞の機能を制御できる、特異性の高いRNA論理回路注2を構築した。
- 細胞内の2種類のmiRNAを検知するAND回路により、両miRNAの存在下でのみ細胞死を引き起こせることを確認した。
松浦理史大学院生(京都大学CiRA未来生命科学開拓部門)、齊藤博英教授(京都大学CiRA同部門)らの研究グループは、合成RNAを細胞に導入することで細胞の運命を精密に制御できる人工論理回路を開発しました。今回開発した人工論理回路では、細胞内の複数種のmiRNAを検知して入力信号とし、それぞれの論理回路(AND、OR、NAND、NOR、XOR回路)に応じ、出力として任意のタンパク質の発現を制御することに成功しました。これにより、特異的に狙った細胞の機能を精密に制御することが可能となり、将来的には標的細胞の純化に用いるなど、医療応用に貢献できると期待されます。
この研究成果は2018年11月19日に英国科学誌「Nature Communications」でオンライン公開されました。
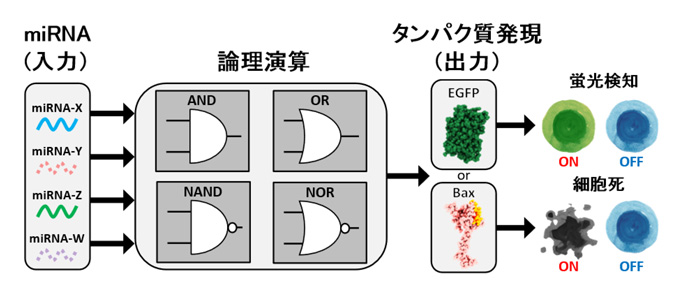
図1.本研究で開発した人工論理回路の概略
細胞内の複数のmiRNAを検知し、それを入力信号とした論理演算の結果が
タンパク質の発現の有無として出力する。
(EGFPは緑色蛍光タンパク質、Baxは細胞死を促進するタンパク質)
合成生物学分野は、創薬やワクチン開発、細胞移植などといった医療への応用が期待され、急速に研究が進んでいます。なかでも、細胞内の遺伝子発現を制御する人工回路は、細胞の運命をコントロールできる技術として開発が進められています。これまで、このような人工回路はDNAを合成して作製されていましたが、細胞内に導入すると、ランダムに細胞内のゲノムDNAを傷つけてしまうリスクがあり、医療応用が難しいという課題がありました。そのため、研究グループは、安全性の高い人工RNAを利用した人工回路の作製に取り組んできました。同グループは標的となる細胞の状態を、細胞内の特異的な1種類のマイクロRNA(miRNA)により識別し、その状態に応じて細胞運命を制御できる回路を構築し、2015年に発表しました(参考:CiRA HP 研究成果 2015年8月4日「細胞の機能を精密に制御する人工回路をRNAで構築: ヒトの細胞で成功」)。しかしながら、この人工回路ではmiRNA存在下と非存在下において出力として得られるタンパク質の発現量の差に課題がありました。そこで、本研究ではより顕著な出力差が得られるよう人工回路を改良し、それを組み合わせることで複数のmiRNAを検知し、より特異的かつ精密に細胞の運命を制御できる人工論理回路の構築を試みました。
1) miRNAを検知してタンパク質を作り出す人工回路を改良した
研究グループは先行研究において、細胞内の1種類のmiRNAの活性を感知し、それに応じて1種類のタンパク質の発現を制御する人工回路を開発していました。この人工回路では、目印となるmiRNAが存在しない場合は、L7Ae注3タンパクが発現することで、出力のタンパク質の発現が抑制されます(スイッチオフ)。一方、目印のmiRNAが存在する場合はL7Aeタンパクが発現しないため、それにより出力のタンパク質の発現が抑制されません(スイッチオン)。ただ、この回路ではオフとオンの間で、出力として観察できるタンパク質量の差が顕著ではありませんでした。
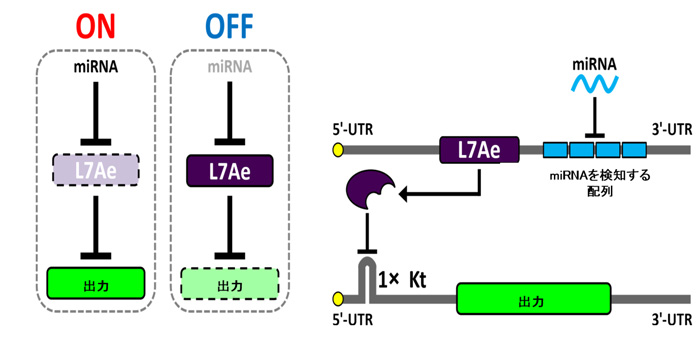
図2.研究グループが先行研究で開発した人工回路
2種類の人工mRNA注4を利用する。1種類の人工mRNAには、miRNAを検知する配列とL7Aeタンパクをコードする配列が、もう1種類のmRNAにはL7Aeタンパクが結合するKt(キンクターン注5)と呼ばれる配列と出力したいタンパク質をコードする遺伝子の配列を設けている。miRNAが存在する(オン)と、それによりL7Aeタンパクの発現が抑制され、出力タンパク質が発現する。miRNAが存在しない場合(オフ)はL7Aeタンパクが発現し、それがKtに結合することで、出力タンパク質の発現が抑制される。(5'UTR、3'UTRはそれぞれ遺伝子の上流、下流を示す。)
出力差を顕著に観察できるようにするために、従来の人工回路に改良を加えました。具体的には、従来はL7Aeタンパクをコードする配列の下流に、miRNAを検知する配列を設けていましたが、それに加えてL7Aeコード配列の上流にも配置しました。改良した人工回路の機能を調べるため、一例としてmiR-21を感知する人工回路を、293FT細胞注6に導入しました。なお、293FT細胞内には本来miR-21が存在しないため、合成miR-21を同時に導入し、EGFP(緑色蛍光タンパク質)を出力として人工回路の機能を検証しました。
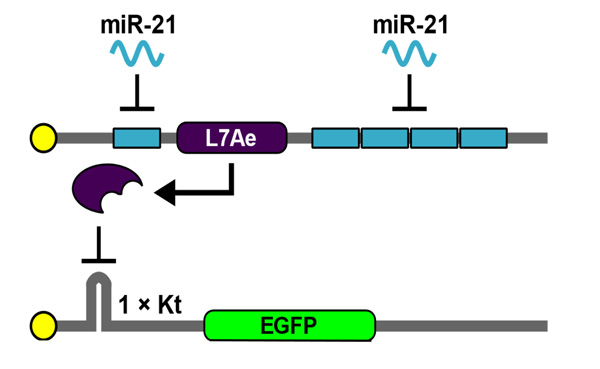
図3.今回改良した人工回路
miRNAを検知する配列をL7Aeコード配列の上流にも設けた。
人工回路を細胞に導入して24時間後にフローサイトメトリー解析注7にて、EGFPの発現量を示す蛍光強度を観察したところ、スイッチオンつまりmiR-21が存在するときは、スイッチオフつまりmiR-21が存在しないときの最大9.2倍もの蛍光強度比が確認され、顕著な人工回路の出力差を得ることができました。
また、改良した人工回路が、細胞内にもともとあるmiRNAに対しても応答し、遺伝子発現を制御できるかを調べるため、人工回路を、miR-21が発現しているHeLa細胞注8に導入しました。なお、対照実験のために、miR-21を阻害したHeLa細胞にもこの回路を導入しました。すると、miR-21存在下(オン)ではEGFP発現量が増大し、miR-21有無により細胞を選別することができました。
これらの結果より、改良した人工回路では、高い精度で出力タンパク質の発現を制御できるようになったことが確認できました。
2) 人工RNA論理回路を構築した
次にグループは、上述の改良した人工回路を組み合わせることで、複数のmiRNAの活性を検知して、出力タンパク質の発現を制御できる様々な論理回路を構築することにしました。
まず、miR-21とmiR-302aの2種類のmiRNAの双方があるときにのみ、出力としてEGFPが発現する論理回路(AND回路)を構築しました。この回路を、293FT細胞に合成miR-206とmiR-302aの双方あるいは片方とともに導入したところ、miR-206とmiR-302a存在下でのみEGFPが発現しました。同様に、miR-21あるいはmiR-302aのいずれか、もしくはその双方の存在を検知するOR回路の構築にも成功しました。
また、より複雑な論理回路を構築するため、L7Aeのように他のタンパク質の発現を抑制するMS2CPタンパクを作るmRNAを合成し、双方の作用を利用した、NAND、NOR、XOR回路を開発することにも成功しました。NAND回路はAND回路と反対の出力、NOR回路はOR回路と反対の出力、そしてXOR回路はmiR-21とmiR-302aのいずれか一方のみが存在する場合に出力し、細胞が光る様子が観察されました。
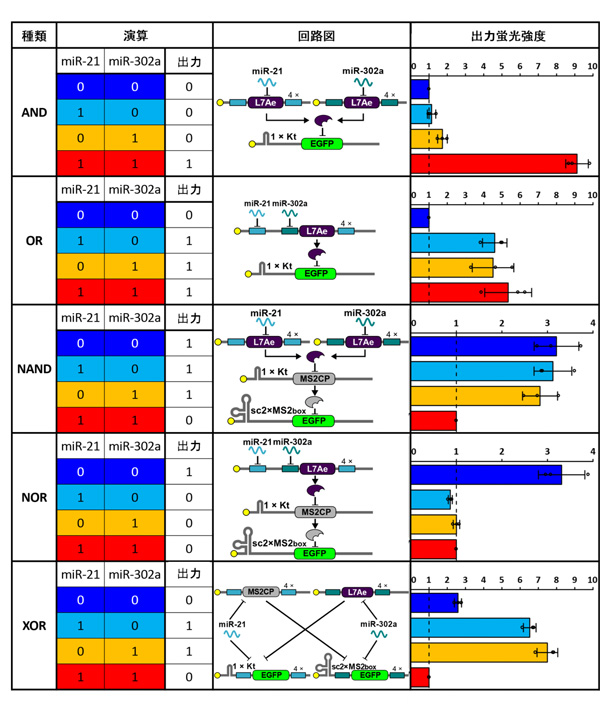
図4.今回開発した人工RNA論理回路
研究グループはさらに、miR-21、miR-302a、miR-206の3種類のmiRNAに応答する3入力AND回路の構築にも成功しました。
3) 2入力AND回路で細胞死を制御できた
最後にグループは、本研究で構築した人工論理回路により、標的の細胞に細胞死を起こすことができるかを検討しました。2種類のmiRNA(miR-206とmiR-302a)の入力によるAND回路を構築し、細胞死促進タンパクの発現を出力としました。293FT細胞に合成miR-206とmiR-302aの双方あるいは片方と、AND回路を導入し、24時間後に観察しました。すると、miR-206とmiR-302a双方を導入した細胞においてのみ、細胞死が起きていました。この結果より、本AND回路がmiRNAの有無に応じて選択的に細胞死を制御できることが分かりました。
本研究では、細胞の状態を感知し、それに応じて細胞の運命を制御する論理回路を、RNAのみを用いて開発することに成功しました。細胞内でのさまざまなmiRNAの活性の違いに着目し、複数のmiRNAを入力情報とし、コンピュータの論理演算のようなシステムを構築したことで、標的とする細胞の運命をより特異的に制御することができました。この技術は目的の細胞の純化など様々に活用することができ、今後、再生医療や創薬といった医療応用に大きく貢献できると期待されます。
- 論文名
"Synthetic RNA-based logic computation in mammalian cells" - ジャーナル名
Nature Communications - 著者
Satoshi Matsuura1,2, Hiroki Ono1,2, Shunsuke Kawasaki1, Yi Kuang1,+, Yoshihiko Fujita1,
Hirohide Saito1,*
* 責任著者 - 著者の所属機関
1. 京都大学iPS細胞研究所
2. 京都大学 大学院医学研究科
+ 現所属:香港科技大学
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会(科研費)
注1) マイクロRNA(miRNA)
20〜30塩基程度の長さの短いノンコーディング(タンパク質をコードしていない)RNA。相補的な配列を持つmRNA(メッセンジャーRNA)と結合して翻訳を抑制したり、mRNAを分解したりすることで、そのmRNAからのタンパク質の合成を抑制する働きをもつと考えられている。
注2)論理回路
論理演算を行う回路。入力信号ならびに出力信号を0(無)と1(有)で表したとき、例としてAND回路では全入力信号が1のときに出力信号が1となる。一方、OR回路では一つでも入力信号が1であれば、出力信号は1となる。NAND回路ではAND回路の出力と正反対の、NOR回路ではOR回路の出力と正反対の出力となる。
注3) L7Ae
古細菌リボソーム大サブユニットに存在するタンパク質の一つであり、リボソーム構築に必須の因子であるとともに、RNA塩基の修飾や、mRNAへの結合など、複数の機能を担う。
注4) mRNA
メッセンジャー(伝令)RNAのこと。DNA上の遺伝子情報はmRNAに転写された後、mRNAからタンパク質となり(翻訳され)、細胞内で機能する。
注5) キンクターン
RNA-タンパク質の相互作用に重要な役割を果たすRNA配列の1つ。L7Ae注3と強固に結合することができる。
注6)293FT細胞
ヒト胎児の腎由来の細胞株の一種。細胞実験にてよく用いられる。
注7) フローサイトメトリー解析
流動細胞計測法。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を解析することができる。
注8) HeLa(ヒーラ)細胞
ヒト由来の最初の細胞株。ヒト子宮頸がんから分離され株化された細胞で、世界中で広く利用されている細胞の1つ。






















