京都大学再生医科学研究所の実験 室で、山中伸弥教授(現iPS細胞研究 所長)の研究グループがマウスiPS細胞 の作製に成功し、論文発表したのは 2006年8月のことです。以来、世界中の 多くの科学者がこの新しい多能性幹細 胞の研究に取り組み始め、様々な体の 細胞を使って様々な方法によるiPS細胞 の作製成功が報告されています。臨床 応用に最も適した作製方法を見出すこ とが、標準化に向けた第一歩です。
「研究者が一様に目指しているのは、 誰もが再現可能な方法で安全なiPS細 胞を効率的に作製する方法の確立で す。」と、沖田圭介講師は言います。
iPS細胞は4つの因子(Oct3/4, Sox2, Klf4, c-Myc)を皮膚などの体細胞 に導入することによって得られる人工の 多能性幹細胞で、様々な細胞に分化す る多能性と、ほぼ無限に増え続ける増殖 性を併せ持つ細胞です。iPS細胞を、病 気の原因解明、薬の効果や副作用、毒 性の検査、薬剤探索、そして将来的には、 細胞移植を用いた再生医療に利用する ことが期待されています。
しかし、これらの可能性の実現までには、 越えなければならないハードルがいくつも あります。iPS細胞技術の標準化はその 一つです。世界中どこでも、同質のiPS細 胞を使って研究や臨床応用が行われる ようにするためには標準的なiPS細胞の 基準を決める必要があります。そこに至る 前段階として、沖田講師は最適なiPS細 胞の作製方法を研究しています。
内閣府が世界のトップを目指した先端的研究を推進するために、平成21年度に創設したプログラムで、30件の研究課 題が採択されました。山中伸弥教授を中心研究者とする「iPS細胞再生医療応用プロジェクト」もその一つで、5年間で 50億円が配分されます。このプロジェクトの達成目標は、iPS細胞に立脚した再生医療を実現するために、「iPS細胞技 術の標準化」を行うことです。多種多様な作製方法によるヒトiPS細胞を評価し、世界標準となるiPS細胞技術の確立を 目指しています。CiRAの研究者たちが研究を推進し、臨床応用水準の細胞制御技術を確立することが期待されています。
| 内閣府サイト | http://www8.cao.go.jp/cstp/ sentan/index.html |
| 日本学術振興会サイト | http://www.jsps.go.jp/j-first/index.html |
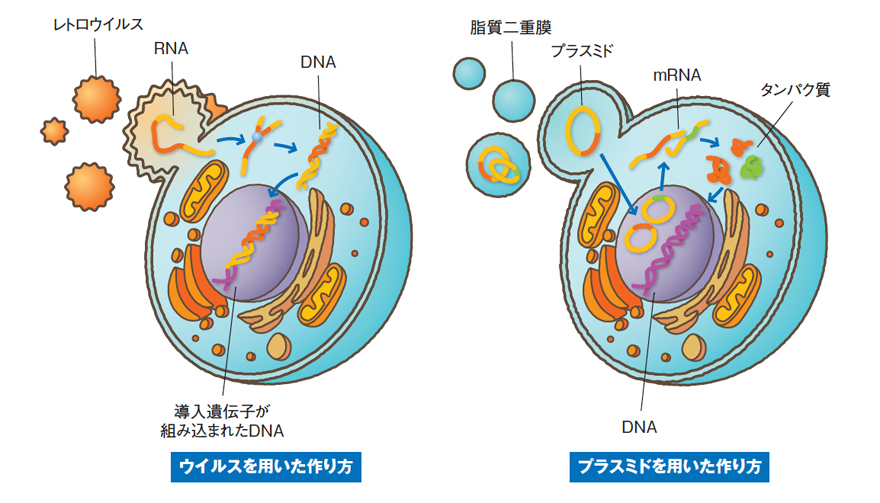
「iPS細胞の作製方法は、初期化を 誘導する因子を体細胞に導入する際 に用いる、ベクター(運び屋)の種類や 導入する物質によって分類できます。 最初にiPS細胞を樹立した際には、レ トロウイルスを使いましたが、今では他 のウイルスやプラスミドを用いる方法 や、タンパク質や化合物を用いる例が 報告されています。」と沖田講師は説 明します。
レトロウイルスをベクターに利用した 場合には、導入した遺伝子が体細胞 の染色体に入り込むことがわかってい ます。染色体上には、人の体の設計 図となる遺伝子が含まれていますが、 ウイルスが運んできた遺伝子の入り込 み方によって、働かなければいけない 遺伝子が機能を失ったり、機能しては いけない遺伝子が働き始めることがお こります。そのような遺伝子の異常が 細胞のがん化の原因になると考えら れるため、そういったことが起こりにくい 因子の導入方法の開発が進んでいま す。沖田講師も2008年にプラスミドと 呼ばれる環状DNAを用いてマウス iPS細胞の作製に成功したことを報 告しました。
「レトロウイルスを用いない方法は、 がん化の危険性は下がりますが、同時 に樹立効率が下がるのも課題だ」と 沖田講師は指摘します。
iPS細胞を薬剤探索や毒性試験な どに使う場合には、安全性は大きな問 題ではありませんが、細胞移植を伴う 臨床応用の際には、細胞のがん化の 原因を取り除くことは重要です。適切 なベクターの選択の他にも、がん遺伝 子として知られるc-Mycを使わない方 法の確立、細胞培養に用いる培養液 の安全性の確保など、安全なiPS細 胞の作製方法の確立には、まだまだ 解決すべき問題があるのです。
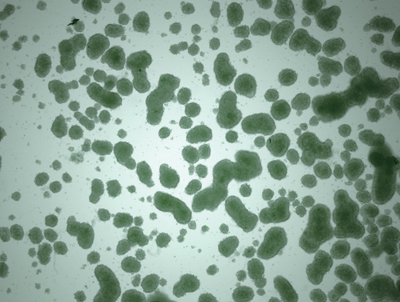
良いマウスiPS細胞
(緑色に光る未分化な細胞が残っていない)
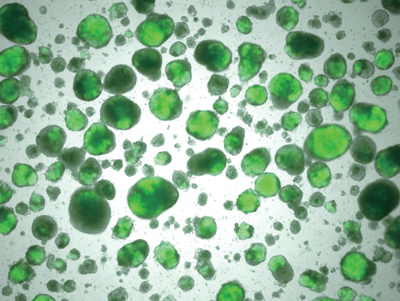
悪いマウスiPS細胞
(緑色に光る部分が未分化な細胞)
理想的なiPS細胞作製方法が確 立されたとしても、できたiPS細胞の均 一性や安全性を確認するためには細 胞の評価技術も必要です。
「同じ両親から生まれた兄弟でも、 外見や性格に違いが見られるように、 同じ体細胞から同じ方法で作製し、同 じ条件で培養しても、個々のiPS細胞 には個人差があります。」と高橋和利 講師は説明します。
例えば、Aさんから提供してもらった 皮膚細胞からiPS細胞を作ると、いく つかのiPS細胞の株(細胞の集合体) ができます。このiPS細胞の元となっ た皮膚細胞はAさんから提供されたも のなので、細胞の遺伝的な性質は同 じです。ところが、これらのiPS細胞の 株ごとの性質を比べてみると、分化し にくかったり、特定の細胞に分化しや すいというような株間に性質の違いが 見られることが分かってきています。
「均一なiPS細胞ができるような培 養条件を世界中の多くの研究者が模 索しています。」と高橋講師は言いま す。「患者さんから作られたiPS細胞と 健常者のiPS細胞を比較した場合、そ の違いは病気のせいか、それともその 人の個性なのかを区別する必要があ るのですが、均一化できる培養条件が あれば、病気以外に起因する個性は 排除できるかもしれないのです。」
均一なiPS細胞ができれば、研究 ツールとして非常に有効なものになる ことが期待できます。
さらに、iPS細胞の安全性評価の 第一歩として、「iPS細胞から体細胞 に分化させたときに、未分化な細胞が 残っていないかを確認する方法の確 立に取り組んでいる。」と高橋講師は 言います。完全に分化しきれていない 細胞を体内に移植すると、その残った 未分化な細胞が腫瘍を作る原因にな ります。「いまは培養室で簡単に安全 性が評価できる方法を開発しようとし ていますが、これだけでは不十分で、 サルなどを用いた動物試験も必要で す。安全性の確認には、いくつものス テップを踏む必要があります。これらの 実験は、臨床応用を目指すには不可 欠な研究です。地味な研究ですが、自 分がやらなければと思って取り組んで います。」

培養室で 細胞を観察する 中川講師
「iPS細胞の標準化」とは何を意味 するのでしょうか?標準化を定義するこ とは容易ではありませんが、簡単に言う と、一定基準を満たす性質を有した均 一なiPS細胞を作るための条件と考え られます。この標準化のためには、前述 の「様々な作製方法」と「均一性と安全 性」という課題が深くかかわってきます。
標準化の条件は基礎研究や臨床 研究といった用途によっても変わり、 その確立が重要と中川誠人講師は 説明します。「iPS細胞(技術)が標準 化されることにより、世界中の研究者 によって行われている研究結果に統 一性が出てくることになります。また、 結果的に研究スピードが上がることに なるでしょう。」
現在、日本では標準化に向けて、文 部科学省、厚生労働省、経済産業省 のiPS細胞研究プロジェクトを担当す る代表的研究者が連携してiPS細胞 作製技術の比較評価に取り組み始 めています。いずれは標準化について 国際的な場で議論されるでしょうが、 当面は、研究者が独自にこの技術を 進展させていくことになると中川講師 は言います。「CiRAがこういうiPS細 胞を使うと良いとか、これが標準になる のではないか、と率先して発信していく ことが重要だと思います。」

私たちのグループは、疾患特異的iPS細胞(患者さんから 採取した細胞からiPS細胞)を樹立しています。それらをさら に患部の細胞に分化させ、疾患モデル(病気の状態を再現 した細胞)を作ることが、一番大きな使命です。そして、これを 用いて病気の原因を明らかにしたり、薬の開発に利用する ことを目標にしています。いかにiPS細胞を使って病気の状 態を再現するか、今は、その辺に苦慮しながら進めています。
最初に着手したのは、デュシェン ヌ型筋ジストロフィーです。骨格筋 が壊れてしまうことが原因として知ら れる筋ジストロフィーのなかでも一番 多いタイプで、10歳くらいから歩け なくなり、20歳くらいになると呼吸器 をつけて生活することになるという 病気です。この病気を何とかしたい と思い、2年前に、この病気の患者 さんからiPS細胞を作りました。今は、そのiPS細胞を骨格筋 に分化させて、この骨格筋が壊れるのを防ぐ新しい薬を見つ けようと研究を進めています。
2番目は、CINCA症候群(慢性乳児神経皮膚関節炎 症候群)の患者さんからiPS細胞を作りました。この疾患は 稀な自己炎症性疾患で、CIAS1という遺伝子異常でおこ る病気です。患者さんの正常な線維芽細胞と異常な線維 芽細胞からiPS細胞を作りました(注1)。このiPS細胞を白血 球の一種であるマクロファージに分化させて、病気が再現 できるか研究しています。
3番目はコストマン症候群(重症先天性好中球減少症)で、 好中球が生まれつきほとんどないという病気です。好中球が 作られる経路の途中で細胞の分化が止まってしまいます。 HAX1という遺伝子異常が原因ということが分かってきてい ますが、この遺伝子の異常がどのように病気を引き起こすの かはわかっていないので、今回作られたiPS細胞から好中球 を作り、どこで障害が起こるか詳しく調べたいと思っています。
その他にも疾患特異的iPS細胞を用いた研究の計画が あります。十数種類の疾患の患者さんから、線維芽細胞を いただく予定で、今年度は、いろいろな種類のiPS細胞が 樹立できると思います。
まだ遠い将来ですが、iPS細胞を細胞移植に応用するこ とを考えています。デュシェンヌ型筋ジストロフィーは、ジスト ロフィンというたんぱく質が作れないので、筋肉が作りにくく なっています。MDXマウス(注2)にiPS細胞から分化させた骨 格筋細胞を移植すると、ジストロフィンが作られて、筋肉が 作られます。再生の道筋は分かっているのですが、正常の ヒトiPS細胞を(マウスに)移植しても、種が違うので拒絶さ れてしまいます。そこで、NOGマウス(注3)というヒトの細胞を 受け入れやすいマウスを使って、正 常なヒトiPS細胞由来の骨格筋を NOGマウスに移植する実験も(京 大医学部附属病院の)小児科と一 緒に行っています。
また、ファンコニ貧血の患者さん からもiPS細胞を作る予定です。 ファンコニ貧血は、血液をうまく作れ ない病気です。患者さんの細胞から iPS細胞を作り、遺伝子変異を修復 した後、血液細胞を作り移植するこ とを将来の展望として考えています。
CiRAでは、京都リサーチパークのラボで、創薬スクリー ニングシステムを構築していて、スクリーニング用のロボット があります。CINCA症候群の正常細胞由来iPS細胞、異 常細胞由来iPS細胞から分化したマクロファージに化合物 を作用させて、異常細胞由来のマクロファージを抑える薬を 探すという研究が間もなく始まります。着々と疾患特異的 iPS細胞を用いて、再生医療や、病態再現モデル、新しい 薬の探索、治療法の開発などに向かって進んでいます。
研究者はオリジナルな仕事をすることが大事です。世界 をリードするような研究を進めてもらわないといけません。 CiRAの主任研究者は若い人が多いので、彼らをこれから 育てるのが大事で、若い人が活躍できる場を作り出したい と思っています。
| 注1: | CINCA症候群の患者さんには、正常遺伝子をもつ細胞と異常遺伝 子をもつ細胞がモザイクに見られるケースがあります。 |
| 注2: | MDXマウスとは、デュシェンヌ型筋ジストロフィーの病態モデルマウス で、ジストロフィンというたんぱく質の遺伝子が欠損している。 |
| 注3: | NOGマウスとは、重度複合免疫不全マウスの1系統で、マウス体内 で多様なヒト細胞が分化・増殖できる。 |

CiRAのゴールの一つはiPS細胞を用いた再生医療ですが、 そのための道筋をつけることが私の役割だと思っています。私 自身が現在行っている細胞を用いた再生医療の研究は、す でに臨床応用研究の段階に進んでいますが(注1)、これは、体 性幹細胞を用いて行っているもので、iPS細胞を用いたもので はありません。しかし、今取り組んでいる臨床研究で蓄積され たノウハウを生かして、iPS細胞から分化細胞ができたときに、すぐに臨床研究に進めるように基盤を形成するのが、副所長 としての役割だと考えています。
iPS細胞をヒトに応用するた めには、前臨床試験として動物 を用いた実験を行うことが必要 であり、多くはマウスが使用され ています。しかし、マウスの実験 から得られたデータのみでは、ヒ トへの応用の安全性などを確認 することは難しいですし、だからと 言って全ての実験でサルを使う わけにはいきません。そこで中型の動物であるイヌやウサギ のiPS細胞を樹立して、CiRA内外の研究者に配布して、 前臨床試験に使えるようにすることが、現在取り組んでい るプロジェクトの一つです。iPS細胞を移植してがんができ ないかどうかを確認するには、2年間の寿命しかないマウス で行うには限界があるので、安全性の検証という点からもこ れらの動物を用いて実験をすることは意味があると思いま す。また、イヌにも筋ジストロフィーや血友病がありますので、 そのような病気への治療法の開発という意味もあります。
もう一つのプロジェクトは、病気の原因を解明し、薬の開 発に繋げることです。疾患特異的iPS細胞を樹立する研究 は、中畑先生の臨床応用研究部門が中心になって進めて いますが、骨や軟骨の病気で、難治性の病気の薬を開発 するためにiPS細胞を用いて行いたいと思います。骨の病 気だとFOP(進行性骨化性線維異形成症)という、刺激を 与えられると筋肉が骨に変化する病気があります。骨がで きないようにする薬を探すプロジェクトを計画しています。
また、中畑先生のグループと共同でCINCA症候群の研 究も進めています。この病気は、骨端線と呼ばれる部位の 軟骨細胞が増えすぎて骨が肥大化するものです。病気の 原因である分子はわかっているのですが、なぜ軟骨細胞が 増えるのかはまだわかっておらず、軟骨細胞の増加を抑制する薬を探すことを計画しています。
3つ目のプロジェクトとして、iPS細胞を用いてがんの研 究を行いたいと思います。がんと言っても、肉腫という骨や 筋肉にできるがんを研究しています。非常にまれな病気で、子供に発症することが多いです。そういう骨や筋肉にどの ようにがんができるか、どういう治療をすればいいのか、iPS 細胞を使った研究で、がん幹細胞(注2)と接点になるような 何か糸口が発見できないかと思っています。
再生研は、発生などの基礎医学に おいて優れた研究が行われており、 iPS細胞から特定の細胞を誘導する 技術を開発する基盤となる研究を 行っている専門家がいます。また細 胞を使って病気を治すには、細胞を 移植した後で、うまく組織をつくること が必要ですが、そのために細胞が生 きやすい環境を作る人工材料などを 一緒に混合して移植したりする医工 学という領域の研究が行われていま す。移植された細胞がうまく機能するには生体の組織システム とのやりとりが重要であり、特に他人からの細胞移植が将来 的には考えられますが、そのためには免疫反応とか、細胞移植 を受ける身体の反応も大事で、そういうことを研究している人も います。このような意味で、iPS細胞研究を基礎から応用まで サポートできる体制が再生研にはあると思います。有機的に連 携することで、再生医療の応用は間違いなく加速できると思う ので、連携のプラットフォームを作っていくべきだと考えています。
個人的な意見として、将来、iPS細胞の研究は大きな一 つの学問として、広く展開する可能性があると思います。現 在はiPS細胞に特化した研究を展開するのが使命ですが、 将来的には、幅広い研究領域を含んだ研究が展開できる 研究所になればいいと思っています。
| 注1: | 戸口田教授の研究グループは、2007年に厚生労働省の承認を得 て、骨や軟骨などに分化できる間葉系幹細胞を患者さん自身から採 取し、増殖させ、人工骨と一緒に、壊死した骨に移植する臨床研究を 行っています。このような細胞を用いた再生医療により、新たな骨が 再生され、病気を治すことが期待されています。 |
| 注2: | がん幹細胞とは幹細胞の性質をもったがん細胞のことです。近年、ごく 少数のがん幹細胞が、がんの発生・進行に重要な役割を果たしてい るという仮説が提唱されています。 |

第一号の 特許証
山中伸弥京都大学教授が2007 年にヒトiPS細胞を樹立して以来、 iPS細胞技術に関する様々な特許 が世界各国の研究機関や企業から 出されており、その数はどんどん増え 続けています。CiRAで生み出された 様々な発明についても特許出願を 行い、世界各国の特許庁において 審査を受けている状況です。
iPS細胞技術に関連する特許 の第一号は、4つの因子(Oct3/4, Klf4, Sox2, c-Myc)によるiPS細 胞作製法に関する京大(山中教 授)の日本特許で、2008年9月に 認められました。また、2009年11 月にはc-Mycを除く3つの因子によ るiPS細胞作製法および分化誘 導法についての京大の2件の特 許が、それぞれ日本で認められてい ます。海外では、iPierianという米 国企業による特許が、2010年2月 に英国で認められています。
特許を取得した人(特許権者) は、自分の采配で、その特許を誰 に、どのように使わせるかを決める ことができます。例えば①自分だけ が独占して使い誰にも使わせな い、②特定の人や企業にのみ独占 的に使ってもらう、あるいは③不特 定の人や企業に非独占で広く使っ てもらうなど、特許権者の意志で自 由に選択することができます。
京都大学ではiPS細胞関連特 許を研究機関や企業が広く使え るように③を方針としています。京 大が特許を取得することで、国内 外の営利団体による独占を防ぎ、 iPS細胞技術の研究開発を安心 して行い、これにより研究開発が 加速され、この技術を一日でも早く 医療に役立てることができるもの と期待しています。

北岡志保さん
北岡さんの一日は長い。平日は 早朝から夜遅くまで、仮説を証明 するための実験プランを組み、そ の実験を行い、データを解析し、 井上准教授や仲間とディスカッ ションを交わしています。週末に も、細胞の世話に余念がありませ ん。北岡さんのような研究員( 注1) は、このような忙しい日々を送り、研 究結果を論文にまとめて発表する のが仕事です。
『不思議だな、何故こうなるのだ ろう?』と思うことを追求するのが 好きで研究者の道を選んだと北 岡さんは言います。現在の彼女の 研究テーマは、所属する井上グ ループのテーマでもある筋萎縮性 側索硬化症(ALS)の発症メカニ ズムの解明や治療薬の開発をす ることです。「研究はトライ&エラー の繰り返しで、うまく行くケースは 1%程度。思うように実験が進まず フラストレーションを抱えることもあ ります。特に、iPS細胞を使った神 経変性疾患の分野は競争が激し く、別のグループから論文が先に 出るのではないかと不安になると きもあります。」
それでも、知的好奇心を満足さ せることを仕事にしていることに対 し、恵まれているとも感じていて、そ れゆえに社会貢献につながるよう な研究をする必要があると思って いると北岡さんは話します。「失敗 の回数が多いほど、うまく行った時 の喜びもひとしお。」成功した瞬間 の喜びがハードな研究の仕事を続 ける原動力になっているようです。
| 注1: | 研究員とは、一般的に博士号取得 後、研究職についている人です。 |

CiRA研究棟のオープンラボで実験する研究スタッフ
iPS細胞の医療への応用は大きく分けて2つ考えられます。1つは創薬で、2つめは再生医療です。 創薬への利用では、iPS細胞を用いて病気がおこる仕組みを調べ、その病気を防ぐような新しい薬の成分を探したり、新 しく開発された薬の毒性試験に利用されることが考えられています。
細胞移植治療による再生医療の実現までには、安全なiPS細胞の樹立方法や、作製されたiPS細胞株の評価や選抜、そして目的の細胞に確実に分化させる方法など、様々な段階での研究が必要です。このような再生医療には多くの期待が寄せられていますが、安全に実施できるまでには、まだまだ多くのハードルを越えることが必要です。
CiRAでは、iPS細胞を用いた研究の成果が一日も早く病気の治療に結びつくように、研究者やスタッフが努力していま す。しかしながら、まだいつ頃までに医療応用が実現するかという質問 にお答えするのは困難な状況です。
現在までに、iPS細胞を利用した人間の病気やケガの治療は、 世界中で一例も実施されていません。これまで、基礎研究の一環と して、疾病を再現したモデル動物を用いた治療実験などで効果が 示された例がありますが、ここから人間の治療に結びつけるには、 上記の回答で示した通り、様々な段階の研究が必要です。また、ご く少数の人々を対象とした臨床研究が可能になるためには、日本で は治療法の安全性の確認・審査基準となる臨床研究指針を国が 策定する必要がありますが、現在、厚生労働省の審議会で議論さ れている最中です。人間を対象とした治療に結びつくにはまだまだ 時間が必要と言えます。
マウスなどを用いた動物実験では、ES(胚性幹)細胞やiPS細胞が生殖細胞にも分化し、ES細胞やiPS細胞に由来す る子孫を残すことができることが示されています。そのようなことから、ヒトES細胞やヒトiPS細胞からも理論上では生殖細胞 が作製できると考えられます。日本では、倫理的な観点から、生殖細胞の作製に繋がる研究については、2001年に策定さ れた文部科学省の研究指針において禁止されていました。
しかしながら、実験動物を用いた基礎研究の進展状況や生殖細胞の分化過程の研究の進展による不妊症研究等への 有用性などが検討された結果、従来の指針の改正(注1)や新たな指針策定(注2)が行われ、2010年5月に施行されました。こ れにより、ヒトES細胞、ヒトiPS細胞、ヒト組織幹細胞(体性幹細胞)から生殖細胞を作製する研究が一定の要件下で認めら れることになりました。具体的な実施要件としては、研究に用いる細胞の提供者が生殖細胞研究への利用を認めていること や、作製された生殖細胞から受精卵を作らないことなどが求められており、一定のルール下で実施することになっています。
| 注1: | 文部科学省「ヒトES細胞の使用に関する指針」(全部改正)、「ヒトES細胞の樹立及び分配に関する指針」(一部改正) |
| 注2: | 文部科学省「ヒトiPS細胞又はヒト組織幹細胞からの生殖細胞の作成を行う研究に関する指針」(新たに策定) |