FOCUSiPS細胞技術と免疫治療を融合した「がん免疫再生療法」とは
特集がんの標準治療となる
免疫再生療法をつくる

CiRAが目指すのは、iPS細胞が通常医療の選択肢となる未来。そこで今回は、iPS細胞から作製した免疫細胞を用いてがん免疫再生療法研究を行っているCiRAの金子新教授(増殖分化機構研究部門)を特集。
iPS細胞を使った免疫再生療法ががん治療の選択肢になる日にもっとも近い研究者のひとりである金子教授に、研究内容を詳しく聞きました。

金子先生の研究内容を教えてください。
私たちの研究室では、主にiPS細胞から、免疫細胞の一種である「T細胞」を作製して、がんの治療法の研究を行っています。T細胞は自分の細胞と自分以外の異物を見分けるレセプター(受容体)を持っています。その能力によって、細菌やウイルスなどの病原体を攻撃して排除することができます。また、病原体だけでなく、体内で発生するがん細胞も攻撃します。このようなT細胞やそのほかの免疫細胞の働きを利用して、がんを治療する方法が「免疫療法」です。
現在、体内の免疫細胞を活性化するがん治療法や、免疫細胞を体の外に取り出してがん細胞と戦えるように遺伝子改変して体内に戻す治療法が盛んに研究されています。
がん免疫療法は、副作用が少ない治療法であることも大きな特徴です。抗がん剤や放射線による治療は正常な細胞も傷つけてしまいますが、T細胞を使ったがん免疫療法ではがん細胞だけを攻撃できるため、副作用が少ないと考えられます。さらに、これまでの治療法では効果がなかったがんも治療できることが臨床試験で示されています。
私たちはこの免疫療法とiPS細胞を組み合わせた方法で、がんを治療しようと考えています。
iPS細胞と免疫療法が、どのように組み合わされるのでしょうか?
免疫療法にはさまざまな種類がありますが、私たちが研究しているのは、iPS細胞から、T細胞やNK細胞と呼ばれる異物を認識して攻撃する免疫細胞を作製し、それらにがん細胞を感知するレセプターをつけ、増やしてから体の中に戻す方法です。増やしてから戻すのは、がん細胞と効果的に戦うために、ある程度の量が必要だからです。
通常、T細胞やNK細胞自体を、体の外で増やすと弱ってしまうことがあります。また増える量にも限界があります。
弱った細胞を体に戻しても、がん細胞と戦う力は残っていないかもしれません。そこで、iPS細胞が役に立ちます。ほぼ無限に増やせる能力と細胞を若返らせる能力をもつiPS細胞を利用することで、大量のT細胞やNK細胞を体外で作製し、がん細胞と戦う攻撃部隊として体内に戻す。それが私たちの目指す「がん免疫再生治療」です。
具体的には、どのようにiPS細胞の性質を利用するのでしょうか?
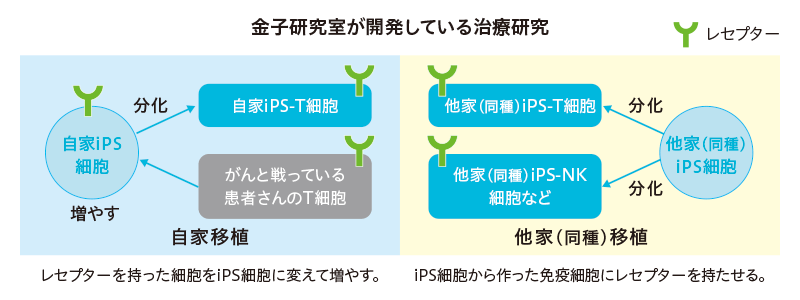
2つの方法があります。1つ目は患者さんの体の中でがんと戦っているT細胞を体の外に取り出して、iPS細胞にしてから増やし、再びT細胞に分化させて体内に戻す「自家移植」による方法です。2つ目は、拒絶反応をおこしにくい他人の細胞からiPS細胞を分化させて、がんを感知するレセプターを持ったT細胞を作り、患者さんに投与する「他家(同種)移植)」による方法です(下図)。
自家移植の場合、投与後の拒絶反応がないのが長所です。
しかし患者さんごとにオーダーメードとなるため、コストも時間もかかるという短所があります。
一方、他家(同種)移植は、拒絶反応をおこしにくい細胞を用いても、患者さん自身の細胞ではないため、一部の人には免疫拒絶反応が出る可能性があります。ただ、多くの人に共通する免疫タイプのiPS細胞を使うことで、型が合えば問題なく使用できます。大量生産も可能で、コストや品質やスピードの面で大きなメリットが期待できます。
私たちはこれら両方の研究を進めながら、安全な治療法として確立できた方法から、臨床試験へ進めています。
2021年に始まった卵巣がん治療に関する臨床試験はどのような治療法なのでしょうか?
他家(同種)移植の方法による治療法です。公益財団法人京都大学iPS細胞研究財団(以下「iPS財団」)で製造したiPS細胞からNK細胞を作り、患者さんに投与します。この治療法では、ある種のがん細胞だけが持つ「GPC3」というタンパク質を目印に攻撃するレセプターを搭載したNK細胞を作ります。正常な細胞はGPC3を持っていません。そのため、GPC3を目印に攻撃するNK細胞は、正常な細胞を攻撃しません。2021年4月から国立がん研究センター東病院と協力をして臨床試験を開始し、9月に最初の細胞移植を実施しました。対象となった症状は、がん細胞がお腹の中に散らばって手術ができず、抗がん剤治療などの標準治療では効果がなかった卵巣がんです。
基礎研究から臨床試験に至るまでにはどんなプロセスがあったのでしょうか?
基礎研究で理論が確立しても、患者さんに投与するまでに、10年ほどかかっています。最初の2年間は、基礎研究を進め、細胞や動物を用いて試行錯誤しました。次の3年間は、人に投与するために、より安全な材料や製法などに置き換えていきました。しかし、置き換えてしまうと結果が変わってしまうこともありました。
方法論が固まったら、今度は安全性の試験を行います。本番と同じ製法と規格で作った細胞を使い、動物で試験を行います。観察期間を設け、本当に安全かどうかを見極めます。加えて、がんのモデルマウスに作った細胞を投与して、治療効果も確かめました。これらのプロセスにも3年を費やしました。
人に安全に投与できる方法を確立したら、次は大量に細胞製造できるように製法を工夫していきます。幸い、CiRAの施設内にはiPS財団が運営する臨床用細胞調製施設「FiT」(※)がありますから、FiTの方々と協力して製造法を開発しました。何回か練習で細胞製造を行って、できあがったものが一定の品質かどうかを確認します。その過程にも1、2年かかりましたね。
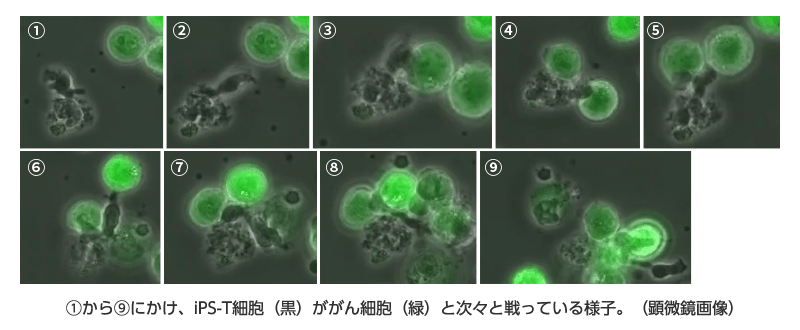
このがん免疫再生療法は、副作用はあるのでしょうか?
もし製造したNK細胞やT細胞が、たまたま正常な細胞を攻撃するレセプターも持ってしまったら、副作用が起きてしまいます。また、未分化なiPS細胞が製剤の中に混じってしまうと、iPS細胞が体の中で増殖してがん化するリスクが生じます。安全ながん免疫再生療法を確立するために重要なことは、これらのリスクを想定下に置き、慎重な試験体制を敷いて評価をすることだと考え、実行しています。
現在は、さらにどのようなことを目指しているのでしょうか?
T細胞やNK細胞のレセプター部分を工夫すれば、さまざまなタイプのがんや、免疫疾患などがん以外の病気の治療に応用できます。さらに、T細胞やNK細胞の攻撃力を高めたり、がん細胞の塊の中に入り込める性質を持たせるなど、現在の技術にもまだまだ工夫の余地があります。
最後に、金子教授が立ち上げた京都大学発の再生医療スタートアップ企業のサイアス株式会社が21.3億円を調達し米国へ進出するという記事を読みました。これからの目標を教えてください。
サイアスは私たちの発明したがん免疫再生療法技術を導入して2015年に設立したベンチャー企業です。サイアスのミッションは、iPS細胞から再生したT細胞で、がんや感染症に対する治療法を提供することですが、もっとも力を入れているのは、患者さん固有のがんが持つ抗原をねらうレセプターを持ったiPS-T細胞による個別化医療を確立することです。
患者さん自身のT細胞を使った免疫療法は、事前に大量生産をすることができず、コストもかかるため、現状では企業が本格的に参入することが難しい分野です。けれども、将来的に技術が向上してコストの低減や安全性が確保できたときに、個別化された医療が必要になってきます。今、研究開発の歩みを止めるわけにはいきません。
現在は、アメリカでの展開を準備しています。アメリカは、免疫再生療法の開発が急速に活発化しています。そこで私たちの技術をさらに発展させ、スピード感を持って多くの患者さんに届けられる治療法を開発したいのです。
開発が少しでも早まれば、それだけ助かる人が増えるため、スピードは重要です。安全性や効果を確実に確かめながら、人材や資金面で開発を加速していく。近い将来、世界で免疫再生療法ががんの標準治療となっていくといいなと考えています。
※ FiT(Facility for iPS Cell Therapy):再生医療用のiPS細胞を含む、さまざまな細胞の製造を安全かつ安定的に行うための細胞調製施設。2020年度からはCiRAから公益財団法人京都大学iPS細胞研究財団へ運営が引き継がれた。
金子 新 かねこ しん
1995年に筑波大学医学群を卒業し、1998年同大学大学院医学研究科博士課程入学、2002年博士号取得(医学)。同大学大学院血液病態制御医学(血液内科)講師、サンラファエレ科学研究所(ミラノ)研究員、東京大学医科学研究所幹細胞治療分野助教を経て、2012年より京都大学iPS細胞研究所准教授、2020年より同研究所教授、筑波大学医学群がん免疫研究分野教授を兼任。2022年より同研究所副所長。