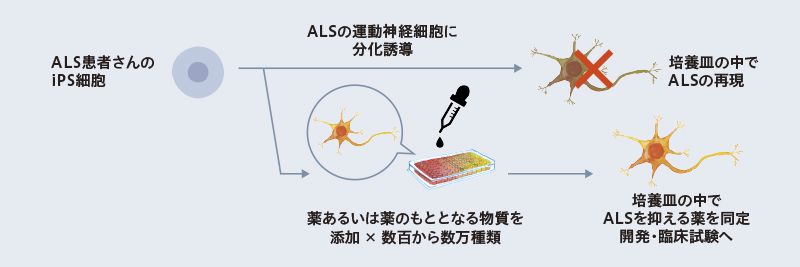
「iPS創薬」とは一体どのように行われるのでしょうか?
患者さんの体細胞からiPS細胞を作り、そのiPS細胞から病気の標的細胞を作ります。その細胞を「疾患モデル細胞」と呼び、健常な方の細胞と比べることで、どのような違いがあるかを解析します。そして、疾患モデル細胞に対し、健常な方の細胞との違いをなくす薬のもととなる物質、すなわち、治療薬候補を探します。さらにそこから臨床試験へと進みます。この過程がiPS創薬と呼ばれています。
現在、ALS(筋萎縮性側索硬化症)(※)の患者さんを対象としたiPS創薬に取り組んでおられます。その内容について詳しく教えてください。
現在、ALSの根本的治療薬はまだありません。私たちはiPS創薬の手法を用いて、ALSの治療薬の研究に取り組んでいます。2007年に誕生したヒトのiPS細胞を作製する技術を用いて、2008年に初めて、遺伝性のALS患者さんの細胞からiPS細胞を作製しました。そのiPS細胞から、ALS患者さんの変性した運動神経細胞を作製しました。さらに大量の均一な運動神経細胞を作る新たな技術開発を行いました。
ALS患者さんの運動神経細胞は、健常な方の運動神経細胞と比較すると、培養皿の中で早く死にやすいということがわかりました。私たちはこれを疾患モデル細胞として使い、すでに他の病気で使われている薬や開発中の薬、約1,400個の化合物の効果を一つずつ調べていきました。結果として、27個の薬が運動神経細胞死を強く抑えました。その半数が、Src / c-Ablというタンパク質の働きを抑制する化合物でした。こうして創薬のターゲットとなる標的タンパク質とその候補薬を見出しました。2012年、2017年の論文発表を経て治験の準備を進め、2019年から「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1相試験」を実施しました。
現在、ALS患者さんを対象とした治験が進められています。どのような結果が得られているのでしょうか?
今回の治験でALS患者さんにおける効果を調べている薬剤であるボスチニブは慢性骨髄性白血病の治療に使われているものです。治験全体を通じての有害事象としては、下痢、肝機能障害などが見られましたがALS患者さん特有のものではありませんでした。治験薬投与期間において、一部の患者さんでALSの進行の停止が示唆されました。次の段階の治験では対象者の方を増やし、引き続き安全性と有効性を調べていきます。
現在、創薬に有効な化合物を探索するためのAIを開発されています。これはどのような試みなのでしょうか?
化合物スクリーニング(多くの治療薬候補化合物の中から有効な化合物を選び出す作業)では、できるだけ多くの化合物の中から薬の種となる化合物を見出すことで、より良いものを選ぶことが可能になり創薬の成功確率を高めることができます。C i RAと共同研究プログラムT-CiRAを進めている武田薬品工業株式会社(以下「武田薬品」)は世界でも最大規模の化合物ライブラリの一つを保有されており、その中の約160万個の化合物からALSの治療薬候補となりうる化合物を探索しました。ただ、数百万個を超える化合物の評価を実施するには多くの時間と費用がかかりますので、熱拡散方程式モデルというAIの力を借りて、5,600個まで絞り込み、最終的に新しいALS治療薬候補の種となる可能性がある化合物を5種類見出しました。現在では、武田薬品でその化合物の研究が続けられています。
井上先生がiPS創薬に関わることになったきっかけを教えてください。
もともと脳神経内科の臨床医で、多くのALS患者さんを担当させていただきました。1990年代、ちょうど一部のALSの原因遺伝子がわかり、ALSのモデルマウスが出てきた頃でした。そこから治療法を探る研究にも取り組みましたが、動物からヒトに応用にするには膨大な時間がかかってしまいます。ALS患者さんから直接、情報を見出すことができればと考え、ALS患者さんの皮膚の幹細胞を作り、そこから創薬をできればと研究していましたがうまく進みませんでした。その頃、山中先生がiPS細胞の作製に成功されました。私は、ALS患者さんの皮膚からiPS細胞を作製し、そこから疾患モデル細胞を作れば、今でいうiPS創薬から有効な治療薬を同定できるのではと考え、CiRAで研究することを志望させていただきました。
iPS細胞を用いた創薬開発の可能性をどのように考えていますか?
患者さんの病態により近い形で薬の作用を試せることです。低分子化合物や核酸医薬、抗体医薬など幅広い種類の治療薬候補の検証に用いることができます。将来、一人ひとりのiPS細胞を作ることが簡単にできるようになれば、個々の方の疾患モデル細胞を調べて、究極の未来医療を実現できる可能性を秘めていると思います。
井上 治久 いのうえ はるひさ
京都府出身。1992年京都大学医学部卒業。住友病院神経内科などで勤務後、米国ハーバード大学医学部博士研究員などを経て、2005年京都大学大学院医学研究科助手。2009年同大学物質-細胞統合システム拠点特定拠点准教授、2010年CiRA准教授、2014年より現職。2017年より理化学研究所BRCチームリーダー・AIP客員主管研究員を併任。趣味は畑と土作り。
長船 健二 おさふね けんじ
兵庫県出身。1996年京都大学医学部卒業。市立舞鶴市民病院などで一般内科医として勤務後、2000年東京大学大学院理学研究科、2003年同修了(理学博士)。2005年米国ハーバード大学幹細胞研究所客員研究員を経て、2008年京都大学物質-細胞統合システム拠点講師。2010年CiRA准教授、2014年より現職。趣味はグルメと旅行。
高山 和雄 たかやま かずお
徳島県出身。2010年大阪大学薬学部卒業。2015年同大学大学院薬学研究科修了(薬科学博士)。2015年同大学大学院薬学研究科附属創薬センター特任助教、2018年同大学大学院薬学研究科分子生物学分野助教などを経て、2020年より現職。趣味は財テク。
※ ALS(筋萎縮性側索硬化症):運動ニューロンが選択的に変性・消失していく原因不明の疾患。筋萎縮と筋力低下が主な症状で、進行すると上肢の機能障害、歩行障害、嚥下障害、呼吸障害などを生じる。病気を起こすメカニズムは十分には明らかになっておらず、まだ根本的な治療法がない。