研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2015年8月20日
iPS細胞によりデュシェンヌ型筋ジストロフィーの初期病態を再現
庄子栄美特定研究員(京都大学CiRA、元京都大学再生医科学研究所大学院生)、櫻井英俊講師(京都大学CiRA)らの研究グループは、デュシェンヌ型筋ジストロフィー(DMD)患者さんから作製したiPS細胞を筋肉の細胞へと分化させることにより、細胞レベルで病気の初期病態を再現することに成功しました。
この研究成果は2015年8月20日(英国時間)に英科学誌「Scientific Reports」で公開されました。
ポイント
1. 要旨
DMDは、筋肉細胞中のジストロフィンタンパク質の欠損により筋細胞が変性して、筋肉が衰弱する病気です。現状の治療法では進行を止めることができず、病気の初期病態を把握して筋細胞の変性を食い止めることが治療法開発の上でも鍵となっています。
本研究では、iPS細胞からまず筋管細胞注2)に分化させました。すると、形態学的にも生理学的にも、健康な方の筋管細胞との違いはみられませんでした。ところが、電気刺激を与えたところ、DMD患者さんの筋管細胞ではカルシウムイオンの過剰な細胞内への流入がみられました。薬剤により、欠損していたジストロフィンタンパク質の発現を回復したところ、カルシウムイオンの流入は抑えられ、筋細胞破壊の指標となるクレアチンキナーゼの漏出量も減りました。今後、DMD治療法開発に向けた創薬のための評価系として利用が期待されています。
2. 研究の背景
DMDは幼少の頃から発症し、筋肉が萎縮することにより歩行や呼吸などが困難になる進行性の病気で、男性3500人に1人と高い頻度で発症すると言われています。原因としては、細胞骨格の一部を構成するタンパク質の中でも最も大きいジストロフィンタンパク質の欠損により発症します。ジストロフィン遺伝子は、79個のエクソン(タンパク質をコードする配列)を含んでおり、DMD患者さんでは様々な場所に突然変異が入ることで、完全長のジストロフィンタンパク質が合成されません。
筋肉生検を行うことで、DMD患者さんの筋肉細胞を得る事は可能ですが、患者さんの遺伝的な背景や年齢、病歴などが異なるため、均一な細胞を研究に必要な量を得ることは難しいといえます。また、DMD患者さんから得られた筋芽細胞は、既に体の中で炎症を起こした状態にさらされているために、分化や増殖のスピードが遅くなるという現象が報告されていますが、発症の最も初期にどのような変化が起きるのかを解析することには適していません。
そこで、本研究では、DMD患者さんの皮膚細胞からiPS細胞を作製することで、一度生体内で受けた炎症性の刺激による影響を排し、そのiPS細胞から筋管細胞を分化させることで初期病態に迫ることを目指しました。さらにエクソンスキッピング注3)技術を利用して、同一株でDMD初期の病態を精密に比較できるような系を構築することを目指しました。
3. 研究成果
1) DMD患者さんのiPS細胞の作製と筋管細胞への分化
まず、3歳と8歳のDMD患者さんと、3歳の患者さんの父親の皮膚からiPS細胞を作製しました。それらのiPS細胞に、筋肉細胞への分化を促すことが知られているMyoD遺伝子を導入した細胞株を樹立しました。これらの細胞株を1日培養した時点で、薬剤によりMyoD遺伝子を過剰に発現させることで、分化段階、成熟段階を経て9日後には筋管細胞を得ることができました。培養開始9日後の細胞の形態や発現する遺伝子に大きな差はみられませんでしたが、DMD患者さんではジストロフィン遺伝子の発現が見られるのに対し、ジストロフィンタンパク質が合成されていないことが確かめられました。また、電気刺激を加えて、細胞の収縮を観察したところ、DMD患者さんの細胞も収縮し、3歳の患者さんの父親の細胞同様に、細胞核が複数ある筋管細胞へと分化していることが確かめられました。
2) ジストロフィンタンパク質発現の回復により、カルシウムイオンの流入が減少
ジストロフィンタンパク質欠損による影響を調べるため、私達はDMD患者さんの筋芽細胞にエクソンスキッピングを起こす薬剤(アンチセンスオリゴヌクレオチド注4))を導入し、ジストロフィンタンパク質の発現を回復させました。筋管細胞に電気刺激を与えて、カルシウムイオンの流入量を比較したところ、薬剤を加えてジストロフィンタンパク質を回復させた場合のほうが、加えていない時よりも、カルシウムイオンの流入量が抑えられました。
さらに、カルシウムイオンの過度な流入が患者さんの筋芽細胞に与える影響を調べるため、カルシウムイオンが過度に流入するような試薬(イオノフォア)を加えてから、細胞外に放出されたクレアチンキナーゼ活性を測定しました。クレアチンキナーゼは、細胞が傷つくと、細胞外に漏れ出る酵素です。その結果、コントロール細胞に比べてDMD患者さんではクレアチンキナーゼ活性が高まる傾向が認められました。また、アンチセンスオリゴヌクレオチドを加えた場合、クレアチンキナーゼ活性が低下し、ジストロフィンタンパク質の発現を回復させることで、細胞が傷つきにくくなる傾向にあることが確かめられました。
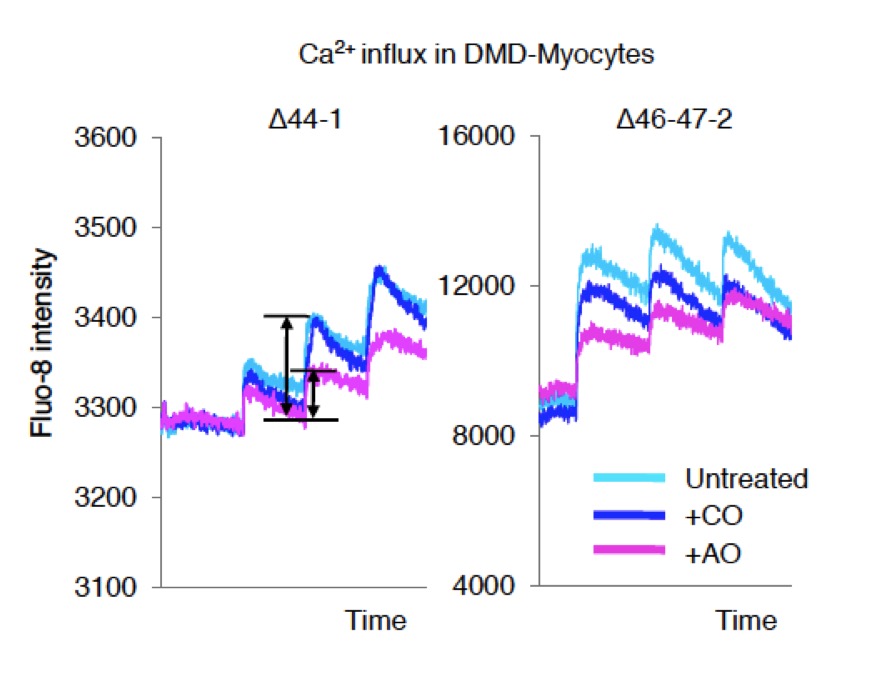
Fig. 1 ジストロフィンタンパク質の発現回復により、DMD患者さんの細胞のカルシウムイオン過剰流入は抑えられる筋芽細胞細胞にアンチセンスオリゴを加えることで、ジストロフィン蛋白の発現を回復させると、カルシウムイオンの流入を意味するFluo-8強度変化の差が小さくなった。
Untreated: 未処理、CO:コントロールオリゴヌクレオチド、AO: アンチセンスオリゴヌクレオチド
4. まとめ
進行性の疾患の病態解明や治療法開発には、生体外で病態モデルを再現することが有効です。本研究では、DMD患者さんからiPS細胞を作製し、筋管細胞へと分化させることで、生体外のDMDモデルを構築し、初期症状を細胞レベルで再現することに成功しました。今回の手法では、アンチセンスオリゴヌクレオチドを利用することで、同一細胞株において病態の改善を確認することができました。96穴の細胞培養皿で検出可能な評価系を確立できたことで、今後、創薬研究に活かされることが期待されます。
5. 論文名、著者およびその所属
"Early pathogenesis of Duchenne muscular dystrophy modelled in patient-derived human induced pluripotent stem cells"
Scientific Reports
Emi Shoji1,2, Hidetoshi Sakurai1*, Tokiko Nishino1, Tatsutoshi Nakahata1, Toshio Heike3, Tomonari Awaya3, Nobuharu Fujii5, Yasuko Manabe5, Masafumi Matsuo4, Atsuko Sehara-Fujisawa2
*) 責任著者
1 京都大学 iPS細胞研究所(CiRA)
2 京都大学 再生医科学研究所
3 京都大学大学院 医学研究科
4 神戸学院大学 総合リハビリテーション学研究科
5 首都大学東京 人間健康科学研究科
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
・国立精神・神経医療研究センター精神・神経疾患研究開発費(25-5)
・文部科学省「科学研究費補助金 若手研究B」
・文部科学省「博士課程教育リーディングプログラム」
7. 用語説明
注1) クレアチンキナーゼ
筋肉など、短時間に大量にエネルギーを消費する組織に多く含まれる酵素の一種。筋肉細胞などが傷ついた際に、クレアチンキナーゼが血中に放出されるため、筋肉の損傷を検出するために用いられる。
注2) 筋管細胞
筋肉の分化過程で生じる多核の細胞のこと。増殖を繰り返した筋芽細胞が融合して筋管細胞となり、さらに成熟して筋繊維が生じる。
注3) エクソンスキッピング
DMDでは、ジストロフィン遺伝子の読み枠がずれるような突然変異が生じることで、ジストロフィンタンパク質の合成が途中で止まり、ジストロフィンタンパク質の欠損が生じる。ジストロフィンタンパク質には、79個のエクソン(タンパク質をコードする配列)があり、このうち問題のあるエクソンを読み飛ばすことで、少し短縮されたジストロフィンタンパク質を得ることができる。このようにエクソンを読み飛ばすことをエクソンスキッピングという。
注4) アンチセンスオリゴヌクレオチド
特定の遺伝子発現を抑えるDNAもしくはRNAのこと。(DNA2本鎖のうち、遺伝子配列がのっている方をセンス鎖、もう一本の相補鎖のことをアンチセンス鎖と呼ぶ)標的の遺伝子配列に相補的であることから、名付けられた。