
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2018年4月26日
ヒトiPS細胞から分化誘導した腎前駆細胞を効率よく単離する方法を開発
ポイント
- 表面抗原マーカー注1)を用いてヒトiPS細胞(人工多能性幹細胞)注2)から分化誘導した腎前駆細胞注3)のみを効率よく単離する方法を開発した。
- 表面抗原マーカーを用いて単離した腎前駆細胞を急性腎傷害モデルマウス注4)に移植すると、腎機能悪化の防止および腎線維化の抑制効果が得られた。
- 本研究で開発したヒトiPS細胞から分化誘導した腎前駆細胞を単離する方法は、将来腎疾患に対する細胞療法や疾患モデル注5)の作製に寄与することが期待される。
ヒトiPS細胞から分化誘導した腎前駆細胞を使った細胞療法は、増え続ける腎疾患患者さんの数を減らすことが期待されています。
保科 あずさ 大学院生(京都大学CiRA増殖分化機構研究部門)、長船 健二 教授(CiRA同部門)らの研究グループは、ヒトiPS細胞から誘導した腎前駆細胞を効率よく単離できる表面抗原マーカーの組み合わせを見出しました。その表面抗原マーカーを用いて単離した腎前駆細胞を急性腎傷害モデルマウスに移植し、腎機能悪化および線維化注6)を抑制する治療効果を確認しました。
ヒトiPS細胞から誘導した腎前駆細胞を効率よく単離することで、将来的に腎疾患に対する細胞療法や疾患モデルの開発に寄与すると考えられます。
この研究成果は、2018年4月23日(英国時間)に英国科学誌「Scientific Reports」で公開されました。
慢性腎臓病(CKD)から腎不全に至り透析療法が必要となる患者さんは世界的に年々増加しています。そこで、ヒトiPS細胞を用いて誘導した腎前駆細胞を使った細胞療法が腎疾患に対する新たな治療法として期待されています。長船教授らの研究グループは、ヒトiPS細胞から誘導したOSR1(+)注7)SIX2(+)注8)の腎前駆細胞を急性腎傷害モデルマウスに移植し、治療効果を得たことを以前に報告しました(Toyohara et al., Stem Cells Translational Medicine. 2015 Sep;4(9):980-92)。しかし、現在の誘導法では未分化な細胞や腎臓系譜ではない細胞が混入し、それらは移植した際の腫瘍化や予期せぬ副作用の原因となる可能性があります。それらを防止するためにこれまでは遺伝子を一部改変したレポーターiPS細胞株を用いて腎前駆細胞のみを取り出していましたが、遺伝子を操作した細胞を実際の移植治療に使うことはできません。 同研究グループは、ヒトiPS細胞から誘導した腎前駆細胞を用いて、表面抗原マーカーのスクリーニングを行い、腎前駆細胞のみを効率よく単離できる表面抗原マーカーの組み合わせを見出しました。その表面抗原マーカーを用いて単離した腎前駆細胞を急性腎傷害モデルマウスに移植し、治療効果を確認しました。
1) ヒトiPS細胞由来の腎前駆細胞を効率よく単離できる表面抗原マーカーを同定した
研究グループはまず、ヒトiPS細胞から誘導した腎前駆細胞を用いて242種類の表面抗原マーカーのスクリーニングを行いました。その結果、ある表面抗原マーカーの組み合わせ(CD9(-)CD140a(+)CD140b(+)CD271(+))が、治療効果を持つOSR1(+)SIX2(+)の腎前駆細胞と一致率が高いことを見出しました。
2) 表面抗原マーカーを用いて単離した腎前駆細胞の機能を評価した
表面抗原マーカーを用いた単離により、腎前駆細胞マーカーであるOSR1、SIX2、HOXD11を発現する細胞を濃縮できることが免疫染色で確認できました(図1)。また、CITED1、CDH11(Cadherin 11)、ITGA8(Integrin alpha 8)、HOXA11などの他の腎前駆細胞マーカーの発現上昇もq-PCR注9)で確認できました。さらに、単離分取した細胞を細胞塊にして誘導すると尿細管様の構造が形成されました。
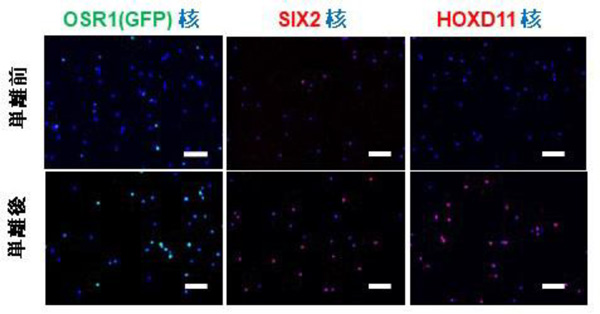
図1 表面抗原マーカーで単離した細胞の免疫染色像
単離前より単離後で各腎前駆細胞マーカーを発現する細胞が濃縮されている
左.緑:OSR1 青:核
中央.赤:SIX2 青:核
右.赤:HOXD11 青:核
スケールバー:100 µm
3) 急性腎傷害モデルマウスにおいて細胞療法の治療効果を確認した
表面抗原マーカーにより単離した腎前駆細胞を急性腎傷害モデルマウスに移植すると、移植群において有意に腎機能の悪化を抑制しました(図2)。また、移植後12日目の組織評価では、移植群において有意にホスト腎臓の線維化を抑制していることを示しました(図3)。
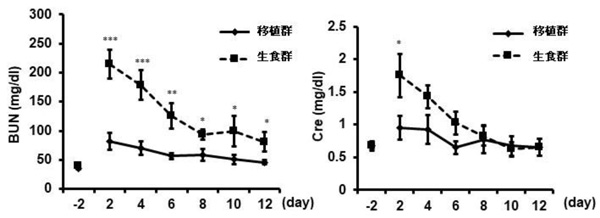
図2 急性腎傷害モデルマウスへの移植
生理食塩水治療群(生食群)に比べ、細胞移植群で有意にBUN(血中尿素窒素:左グラフ)、Cre(血清クレアチニン:右グラフ)の上昇が抑制された。
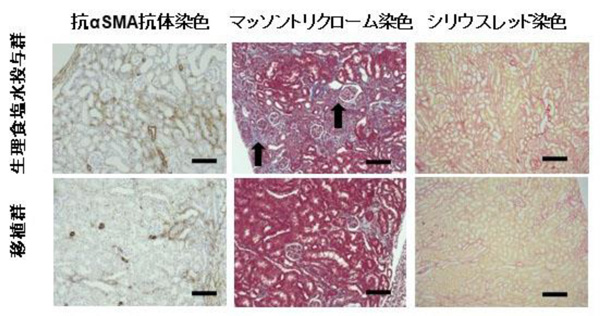
図3 急性腎傷害後の腎線維化抑制効果
生理食塩水投与群に比べ細胞移植群において抗αSMA(alpha smooth muscle actin)抗体染色注10)(茶:線維化部位)、マッソントリクローム染色注11)(青:線維化部位)、シリウスレッド染色注12)(赤:線維化部位)ともに腎線維化が軽微な傾向が認められた。スケールバー:100 µm
本研究では、ヒトiPS細胞由来の腎前駆細胞を効率よく単離できる細胞表面抗原マーカーを同定し、それにより単離した細胞の急性腎傷害への治療効果を確認しました。今回の結果は、ヒトiPS細胞由来の腎前駆細胞を用いた細胞療法の臨床応用や、腎疾患モデル作製への貢献が期待されます。
- 論文名
"Development of new method to enrich human iPSC-derived renal progenitors using cell surface markers" - ジャーナル名
Scientific Reports - 著者
Azusa Hoshina1*, Tatsuya Kawamoto2**, Shin-Ichi Sueta1, Shin-Ichi Mae1, Toshikazu Araoka1, Hiromi Tanaka1, Yasunori Sato3, Yukiko Yamagishi2, Kenji Osafune1**
* 筆頭著者
** 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- アステラス製薬
- 千葉大学
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム「技術開発個別課題」
注1)表面抗原マーカー
細胞は、その表面に糖タンパクなどでできたさまざまな分子(表面抗原)を発現しており、この分子の違いを見分けることで細かい細胞の違いを識別することができる。
注2) iPS細胞(人工多能性幹細胞)
体細胞に特定因子(初期化因子)を導入することにより樹立される、ES細胞に類似した多能性幹細胞。
注3)腎前駆細胞
胎生期の腎臓細胞、将来的に糸球体と尿細管へ分化する細胞。
注4)急性腎傷害モデルマウス
マウスの腎動脈を数十分間遮断した後に解放し、一時的に虚血状態を作製することにより急性腎傷害の状態を作り出したマウス。
注5)腎疾患モデル
腎疾患を持つ患者さんから作製したiPS細胞を腎臓の細胞に分化させることにより、その疾患の病態を再現するモデル。
注6)線維化
線維芽細胞が増殖し、コラーゲンなどを作って障害を受けた部分を補う反応。細胞の機能までは補えないため、線維化した部分が多くなってしまうと、組織として機能しなくなる。
注7)q-PCR
リアルタイムPCR(ポリメラーゼ連鎖反応)または定量PCRと呼ばれ、DNAの増幅と量の計測が同時にできる方法。
注8)OSR1
中間中胚葉から腎前駆細胞までの発生段階で発現している転写因子。
注9)SIX2
将来的に糸球体と尿細管に分化する腎前駆細胞で発現している転写因子。
注10)抗αSMA(alpha smooth muscle actin)抗体染色
線維芽細胞が発現するαSMAに対する抗体で染色し線維化を検出する染色法。
注11)マッソントリクローム染色
膠原線維をアニリン青で染色し線維化を検出する染色法。
注12)シリウスレッド染色
膠原線維を赤で染色し線維化を検出する染色法。






















