
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2017年3月16日
加齢黄斑変性に対する自己iPS細胞由来網膜色素上皮シート移植
-安全性検証のための臨床研究結果を論文発表-
理化学研究所(理研)多細胞システム形成研究センター網膜再生医療研究開発プロジェクトの髙橋政代プロジェクトリーダー(先端医療振興財団先端医療センター病院眼科部長(網膜再生担当)、
神戸市立医療センター中央市民病院医師)、先端医療振興財団先端医療センター病院の栗本康夫眼科統括部長(神戸市立医療センター中央市民病院眼科部長)、
京都大学iPS細胞研究所の山中伸弥所長らの共同研究グループ※は、滲出型加齢黄斑変性[1]の患者を対象として、iPS細胞[2]を用いた細胞治療の安全性を検証することを目的に、
世界初のiPS細胞を用いた臨床研究を2013年より行い、iPS細胞由来網膜色素上皮細胞を用いた細胞治療が安全に施行できることを支持する結果を得ました。
今回の臨床研究のデザインは、既存の治療では十分な効果が得られていない患者の皮膚の細胞よりiPS細胞を誘導し、さらに網膜色素上皮細胞(RPE)を分化してシートを作製し、
新生血管の抜去後にその自己iPS細胞由来網膜色素上皮細胞シート(iPS-RPEシート)を網膜に移植するというものです。対象患者として2名がエントリーされ、iPS-RPEシートを作製し、
規定の品質試験に加えて参考データとして全ゲノムおよび全エクソーム解析[3]を行いました。
2014年9月にそのうちの1人(女性)に移植を実施したところ、1年後の評価において、腫瘍形成、拒絶など認めず、新生血管の再発もみられませんでした。
また、移植手術前の視力を維持しており、安全性試験としての経過は良好でした注1)。さらに、その後1年半経過した現在も、腫瘍形成や拒絶反応はみられていません。
2例目(男性)に関しては、参考データとしてのゲノム解析において検出された遺伝子の変異(X染色体上の遺伝子の欠失)に関して統一した解釈が得られなかったことと、
患者の臨床所見が現行治療で比較的安定していたことから、移植手術は延期されています。また、法改正に伴い本臨床研究は一旦エントリーを終了しています。
実施は1例となりましたが、今回の結果より、iPS細胞由来網膜色素上皮細胞を用いた細胞治療が安全に施行できることが支持されます。
本研究成果は、米国の科学雑誌『The New England Journal of Medicine』(3月15日号)に掲載されました。
本研究は、日本医療研究開発機構(AMED)「再生医療実用化研究事業」の支援を受けて実施しました。
注1) 2015年10月2日トピックス
「滲出型加齢黄斑変性に対する自家iPS細胞由来網膜色素上皮シート移植に関する臨床研究」における第一症例目の移植手術の経過について
加齢黄斑変性は、先進国において高齢者の失明原因の主たる疾患の一つです。
網膜色素上皮細胞(RPE)は網膜の外側に位置するシート状の単層細胞層で、網膜の視細胞を維持するために重要な働きをしています。
加齢黄斑変性には滲出型と萎縮型があります。滲出型加齢黄斑変性では加齢に伴う機能低下により、本来存在する以外の場所で新生血管が網膜色素上皮を貫いて網膜下に生え出すことにより、
網膜下で出血が起こり、進行すると中心部の著しい視力低下をもたらします(図1)。
現在、加齢黄斑変性では新生血管を抑制することを目的とした抗VEGF製剤[4]の眼内注射が広く行われています。
しかし、この治療は効果の持続期間が短くしばしば再発するため、長年にわたり頻繁な治療を必要とする症例が多い状況にあります注2)。
新生血管の手術的な抜去術は一つの根治的な治療法です。しかし、抜去時に網膜色素上皮細胞が一緒に除去されることで滲出型の変化は沈静化できても、
しばしば網膜色素上皮細胞の欠損による網膜の萎縮が起こるため、近年では積極的に行われていませんでした。一方、ヨーロッパでは、
自己の眼内周辺部から網膜色素上皮細胞をシートとして採取し、新生血管の除去後に移植するという治療が行われ一定の成績を収めています。
しかし、患者への負担が大きくなる手技的に侵襲が高い治療で、出血や網膜剥離などの合併症のリスクがあるため、広い普及には至っていません注3)。
共同研究グループは、ES細胞[2]やiPS細胞から網膜色素上皮細胞を分化する技術、および分化した網膜色素上皮細胞からシート状の網膜色素上皮を作製する技術を開発し、
これらの新生血管除去後に移植するというアプローチが可能となりました注4,5)(図1)。
一方で、海外では新生血管を伴わない萎縮型加齢黄斑変性に対してES細胞由来網膜色素上皮細胞を用いた臨床研究が行われ、
安全性が示されましたが、主たる副作用は免疫抑制剤の使用に基づくものであり注6)、自己由来iPS細胞はこの問題も回避できる可能性が期待されました。
今回、共同研究グループは滲出型加齢黄斑変性を対象として、自己iPS細胞由来網膜色素上皮細胞(iPS-RPE)シートを規格に基づいて準備し、
新生血管の抜去後に移植するという臨床研究を実施し、安全性および本研究デザインでの自己iPS細胞を用いた細胞治療実施可能性の検証を試みました。
なお、臨床研究の計画や移植手術等の実施は理研、先端医療センター病院、神戸市立医療センター中央市民病院が行い、
iPS細胞技術の提供及び使用する細胞の評価の一部は京都大学iPS細胞研究所が行いました。
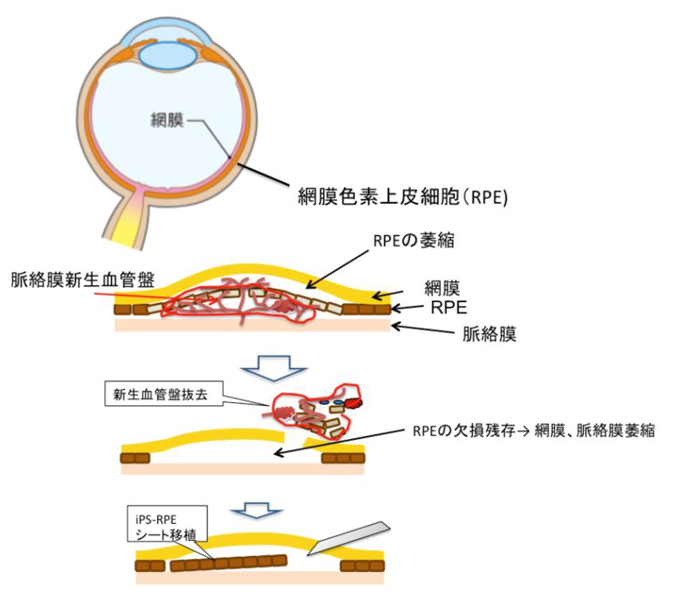
図1 滲出型加齢黄斑変性の病変と新生血管盤去手術、iPS細胞を用いた本研究の治療デザイン
上:網膜色素上皮細胞(RPE)は網膜の外側に一層に広がる細胞層である。
下:加齢に伴いRPEの機能が低下し、脈絡膜からこのRPEの層を越えて血管が生え出したものが「脈絡膜新生血管盤」である。 これを手術で除去すると、RPEも一緒に除去されるため、新生血管による出血などは落ち着くが、その後網膜や脈絡膜血管がしばしば萎縮する。 ここにiPS-RPEシートを移植するのが本研究での治療デザインとなる。
注2)Rofagha S, Bhisitkul RB, Boyer DS, Sadda SR, Zhang K, SEVEN-UP Study Group. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON: a multicenter cohort study (SEVEN-UP). Ophthalmology 2013;120:2292-9.
注3)van Zeeburg EJT, Maaijwee KJM, Missotten TOAR, Heimann H, van Meurs JC. A free retinal pigment epithelium-choroid graft in patients with exudative age-related macular degeneration: results up to 7 years. Am J Ophthalmol 2012;153(1):120-7.e2.
注4)Hirami Y, Osakada F, Takahashi K, et al. Generation of retinal cells from mouse and human induced pluripotent stem cells. Neurosci Lett 2009;458:126-31.
注5)Kamao H, Mandai M, Okamoto S, et al. Characterization of human induced pluripotent stem cell-derived retinal pigment epithelium cell sheets aiming for clinical application. Stem Cell Reports 2014;2:205-18.
注6)Schwartz SD, Regillo CD, Lam BL, et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet 2015;385:509-16.
本臨床研究は、滲出型加齢黄斑変性患者を対象として、自己iPS細胞由来網膜色素上皮細胞(iPS-RPE)シートを用いた移植治療の安全性を検証する目的で、
各症例1年後の状態をもって評価を行うデザインで2013年8月に開始、11月に1例目(女性)の症例のエントリーを行い、その手術を2014年9月に行いました。
引き続き2014年に2例目(男性)のエントリーも行い準備を進めましたが、法改正に伴い新たなエントリーは一旦終了となりました。
エントリーした症例はいずれも滲出型加齢黄斑変性と診断され、1例目は29カ月間に13回の抗VEGF製剤の眼内注射を、2例目は5年間に2回の光線力学療法[5]と16回の抗VEGF製剤の眼内注射を行っていましたが、
再発を繰り返し徐々に視力低下がみられました。iPS細胞は、患者の皮膚から培養した線維芽細胞に京都大学iPS細胞研究所(CiRA)から提供されたエピゾーマルベクター[6]を用いて5因子(GLIS1、L-MYC、SOX2、KLF4、OCT3/4)を導入して作製し、
1例目の患者からは3株、2例目の患者からは1株、本研究プロトコルで定めた規格を満たすiPS細胞株を樹立しました。そして、いずれのiPS細胞からもiPS-RPEを分化誘導することに成功しました。
iPS-RPEシート作製後、品質規格試験 (細胞の形状、RT-PCR[7]、免疫細胞染色[8]による細胞マーカーの確認、生細胞率など)、付加項目(網膜色素上皮としての機能検査)、
および免疫不全動物(NOGマウス)を用いての造腫瘍試験を行い、規格を満たしたiPS-RPEを1症例目で2ライン、2症例目については1ライン得ることができました。
また、今回は世界で初めてのiPS細胞を用いた臨床研究ということから、参考データとして全ゲノムおよびエクソーム解析を行いました。(図2)
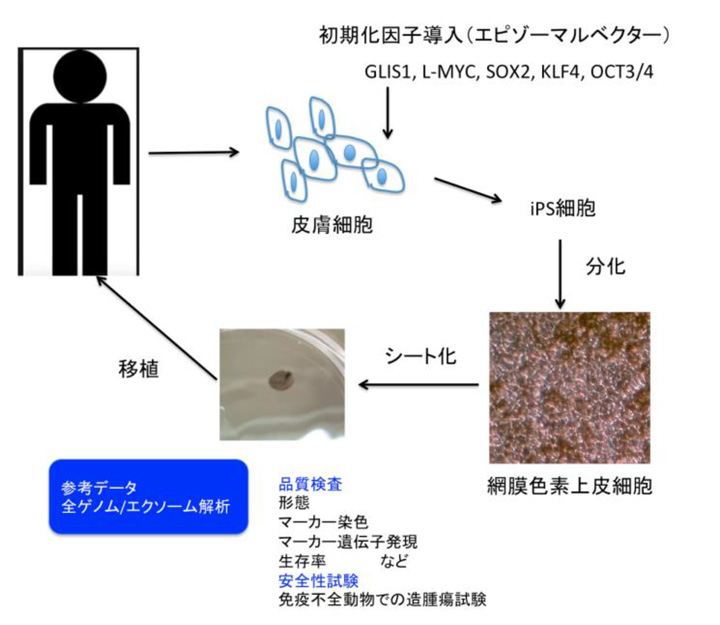
図2 自己iPS細胞由来網膜色素上皮細胞(iPS-RPE)作製と移植治療までの流れ
患者の皮膚から培養した線維芽細胞に、エピゾーマルベクターを用いて5因子(GLIS1、L-MYC、SOX2、KLF4、OCT3/4)を導入してiPS細胞を作製した。 iPS細胞からiPS-RPE細胞を分化誘導し、それをシート化した。シートに関して、品質検査試験(形態、マーカー染色、マーカー遺伝子発現、生存率)と安全性試験(免疫不全動物での造腫瘍試験)を行った。 ここで、参考データとして全ゲノム解析とエクソーム解析を行い、2014年9月にiPS-RPEシート移植手術を行った。
1例目については2014年9月、新生血管抜去とiPS-RPEシート移植を行いましたが、手術手技に伴う有害事象はみられませんでした。
抜去後、滲出型変化は速やかに吸収されました。その後1年間の経過観察において、移植片の異常増殖や拒絶を示す所見は認められませんでした。
移植片の上では網膜の構造も良好に維持されていました。視力は術前抗VEGF治療継続中にも低下傾向がみられましたが、手術後には無治療で同じ視力を維持することができました。
術後一時的な眼圧上昇がみられましたが点眼で落ち着きました。また、術後4週より嚢胞状黄斑浮腫が出現したものの、蛍光造影検査や眼底所見から拒絶や新生血管の再発を示唆する所見はなく、
眼底や移植片の状態も落ち着いていることから、嚢胞状黄斑浮腫は原疾患に起因する慢性炎症によるものと判断されました。
1年後の評価において、1例目についてはiPS-RPEシート移植における安全性を確認しました注1)。
手術より2年以上経過した現在においても腫瘍形成や拒絶は認められず、視力も維持、新生血管の再発もなく、追加の抗VEGF製剤の眼内注射は行っていません。
予定されていた2例目において、iPS-RPEシートは規格を満たし、造腫瘍試験もクリアしましたが、参考データとしてのゲノム解析においてX染色体上の遺伝子の欠失などが認められました。
この欠失の持つ生物学的な意義は不明で統一した解釈が得られませんでしたが、抗VEGF製剤の眼内注射を続けることにより病状が落ち着いていたため、移植手術を延期しました。
注1) 2015年10月2日トピックス
「滲出型加齢黄斑変性に対する自家iPS細胞由来網膜色素上皮シート移植に関する臨床研究」における第一症例目の移植手術の経過について
今回、1例の報告ですが、iPS-RPEシートを用いた治療が安全に実施できることを示しました。 一方で、自己由来iPS細胞を用いた場合の準備期間、コスト、労力などの問題が改めて浮き彫りとなりました。 今後は、免疫型(HLA[9])を考慮した上での他家iPS細胞(他人の細胞から誘導したiPS細胞)のストックを用いての臨床研究へと発展が期待できます。
<タイトル>
Autologous Induced Stem-Cell-Derived Retinal Cells for Macular Degeneration
<著者名>
Michiko Mandai, Akira Watanabe, Yasuo Kurimoto, Yasuhiko Hirami, Chikako Morinaga, Takashi Daimon, Masashi Fujihara, Hiroshi Akimaru, Noriko Sakai, Yumiko Shibata, Motoki Terada, Yui Nomiya, Shigeki Tanishima, Masahiro Nakamura, Hiroyuki Kamao, Sunao Sugita, Akishi Onishi, Tomoko Ito, Kanako Fujita, Shin Kawamata, Masahiro J Go, Chikara Shinohara, Ken-ichiro Hata, Masanori Sawada, Midori Yamamoto, Sachiko Ota, Yashio Ohara, Kenichi Yoshida, Junko Kuwahara, Yuko Kitano, Naoki Amano, Masafumi Umekage, Fumiyo Kitaoka, Azusa Tanaka, Chihiro Okada, Naoko Takasu, Seishi Ogawa, Shinya Yamanaka, Masayo Takahashi
<雑誌>
The New England Journal of Medicine
<DOI>
10.1056/NEJMoa1608368
[1] 滲出型加齢黄斑変性
加齢黄班変性とは加齢により網膜の中心部である黄斑に障害が発生して、見えにくくなる疾患で、滲出型と萎縮型がある。滲出型は、欧米に比べアジアでの発症率が高く、異常な血管(脈絡膜新生血管)が脈絡膜から網膜色素上皮の下あるいは網膜と網膜色素上皮の間に侵入して網膜に障害が起こる病気。異常な血管は、血液の成分を漏出させたり、破れたりする。血液成分が漏出すると網膜が腫れたり(網膜浮腫)、網膜下に液体が溜まったり(網膜下液)して、網膜が正常に働かなくなり視力が低下する。血管が破れると出血し、網膜に障害を引き起こす。
[2] iPS細胞、ES細胞
脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞(人工多能性幹細胞)は、皮膚や血液などから採取した細胞に少数の遺伝子などを導入して作製された多能性幹細胞である。ES細胞(胚性幹細胞)は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。iPSはinduced Pluripotent Stem、ESはEmbryonic Stemの略。
[3] 全エクソーム解析
ゲノムの中のタンパク質に関する情報が書き込まれているエクソン部分(ゲノム全体の約3%)のDNA配列を、次世代シーケンサーを用いて包括的に解析する方法。
[4] 抗VEGF製剤
加齢黄斑変性の原因である脈絡膜の新生血管は、体内の血管内皮増殖因子(VEGF)の働きによって活発に成長する。抗VEGF製剤は、VEGFの作用を中和する抗体を薬剤化したもので、眼内注射することで脈絡膜新生血管の成長を抑えることができる。VEGFはVascular Endothelial Growth Factorの略。
[5] 光線力学療法
光に反応する薬剤であるビスダインを静脈注射した後、網膜中心の病変部に弱いレーザー光を照射する2段階で行なう治療法。ビスダインの成分であるベルテポルフィンは脈絡膜新生血管に集まる性質がある。ベルテポルフィンにレーザー光線を照射することで発生する活性酸素が新生血管に障害を与えて血管を閉じさせる。
[6] エピゾーマルベクター
非ウイルス性のベクターで、導入する遺伝子が導入先の細胞のゲノムに組み込まれない。エピゾーマルベクターは複製するプラスミドのため、細胞分裂に伴って導入遺伝子がある程度は複製される。iPS細胞が分裂し、培養を続ける過程で、最終的にこのプラスミドを持たないiPS細胞が大半を占めるようになる。なお、臨床で使用するiPS細胞ではプラスミドの残存が無いことを確認している。
[7] RT-PCR
逆転写酵素によりRNAを相補的なDNA(cDNA)に変換し、cDNAを用いてPCR(ポリメラーゼ連鎖反応)を行う実験手法で、遺伝子発現の有無やその量を調べることができる。また、実験や遺伝子の同定と単離を行う時にも用いられる。RTはReverse Transcriptase、PCRはPolymerase chain reactionの略。
[8] 免疫細胞染色
細胞などのサンプル中における抗原(タンパク質など)を、抗体を用いて検出する手法。検出したいタンパク質に対する抗体を用いることで、興味のあるタンパク質が存在する場所やその量を測定することができる。
[9] HLA
ヒトの赤血球を除くほぼすべての細胞に発現する組織適合性抗原。自他を認識する免疫機構として働き、移植医療やがんワクチンにはHLAの型が一致していることが重要となる。HLA はヒト白血球型抗原を指すhuman leukocyte antigenの略。
理化学研究所 多細胞システム形成研究センター
網膜再生医療研究開発プロジェクト
プロジェクトリーダー 髙橋 政代 (たかはし まさよ)(先端医療振興財団先端医療センター病院 眼科部長(網膜再生担当)、神戸市立医療センター中央市民病院 医師)
副プロジェクトリーダー 万代 道子 (まんだい みちこ)
プロジェクトマネージャー 森永 千佳子(もりなが ちかこ)
副プロジェクトリーダー 杉田 直 (すぎた すなお)
研究員 大西 暁 (おおにし あきし)
テクニカルスタッフⅡ 坂井 徳子 (さかい のりこ)
テクニカルスタッフⅡ 柴田 由美子(しばた ゆみこ)
テクニカルスタッフⅡ 寺田 基剛 (てらだ もとき)
研究員(研究当時) 秋丸 裕司 (あきまる ひろし)
客員研究員 鎌尾 浩行 (かまお ひろゆき)
先端医療振興財団
先端医療センター病院
眼科統括部長 栗本 康夫 (くりもと やすお)(神戸市立医療センター中央市民病院 眼科部長)
眼科医長 平見 恭彦 (ひらみ やすひこ)
眼科医長(研究当時) 藤原 雅史 (ふじはら まさし)
視能訓練士(研究当時) 山本 翠 (やまもと みどり)
視能訓練士 太田 幸子 (おおた さちこ)
*上記4名は神戸市立医療センター中央市民病院にも所属
細胞療法研究開発センター
センター長 川真田 伸 (かわまた しん)
グループリーダー(研究当時)郷 正博 (ごう まさひろ)
先端医療センター病院 臨床試験支援部
臨床研究コ-ディネ-タ 藤田 佳奈子(ふじた かなこ)
技術員(研究当時) 伊都 知子 (いと ともこ)
京都大学
iPS細胞研究所
所長・教授・主任研究者 山中 伸弥 (やまなか しんや)(グラッドストーン研究所 上席研究員)
主任研究者 渡辺 亮 (わたなべ あきら)(京都大学物質細胞統合システム拠点 特定拠点助教)
教授・主任研究者 高須 直子 (たかす なおこ)
テクニカルスタッフ(研究当時)野宮 唯 (のみや ゆい)
特定研究員 中村 正裕 (なかむら まさひろ)
研究開発補佐員 桑原 順子 (くわはら じゅんこ)
特定研究員 北野 優子 (きたの ゆうこ)
特定研究員 天野 直己 (あまの なおき)
特定研究員 梅景 雅史 (うめかげ まさふみ)
特定研究員 北岡 文美代(きたおか ふみよ)
研究員(研究当時) 田中 梓 (たなか あずさ)
大学院医学研究科 腫瘍生物学
教授 小川 誠司 (おがわ せいし)
助教 吉田 健一 (よしだ けんいち)
兵庫医科大学 医療統計学
教授 大門 貴志 (だいもん たかし)
株式会社ジャパン・ティッシュ・エンジニアリング
取締役 常務執行役員 畠 賢一郎 (はた けんいちろう)
研究開発部長/品質管理部長 篠原 力 (しのはら ちから)
株式会社ヘリオス
専務取締役 澤田 昌典 (さわだ まさのり)
三菱スペース・ソフトウェア株式会社 関西事業部
バイオメディカルインフォマティクス開発室
副室長 谷嶋 成樹 (たにしま しげき)
技術課 専任 岡田 千尋 (おかだ ちひろ)
技術課 担当 小原 康雄 (おはら やすお)






















