
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2017年9月15日
細胞内でタンパク質を検出して運命制御できる「RNA ナノマシン」の構築
ポイント
- タンパク質を検知して作動する、ナノメートルサイズのRNAからなる分子マシン(RNAナノマシン)を構築した。
- RNAナノマシンは、細胞内で特定のタンパク質を精密に検知して、RNA上に集積できた。
- RNAナノマシンを使い、細胞内のタンパク(Lin28注1)を検知に応答して、細胞死のシグナルを精密に操作することができた。
- iPS細胞とヒーラ細胞内の環境を見分け、ヒーラ細胞特異的に細胞死を誘導できた。
柴田知範特任助教(現大阪大学、元京都大学CiRA未来生命科学開拓部門)、齊藤博英教授(CiRA同部門)らの研究グループは、タンパク質と相互作用できるRNAからなる機能性ナノ構造体、「RNAナノマシン」を構築し、 生きた細胞内でRNAナノマシンが機能して細胞の運命決定を操作できることを確認しました。
DNAやRNA を扱った核酸ナノテクノロジー注2はこれからの生命科学や医療において大いに期待される技術ですが、
これまで細胞死などの細胞の運命を操作できるような核酸ナノマシンは開発されていませんでした。
そこで研究グループはまず、RNAとタンパク質の相互作用によって生じるRNAの構造変化やタンパク 質の集積を制御できるRNAナノマシンを構築しました。
次に、構築したRNAナノマシンを用いて細胞内タンパク質を検知、集積して細胞死のシグナルを精密に操作することに成功しました。
この研究から、RNAやRNA-タンパク質複合体を材料とし、細胞内で機能する様々な「分子ロボット」の構築が期待できます。
この研究成果は 2017年 9月 14日午前10時(英国時間:日本時間 9月14日午後6時)に英国科学誌 「Nature Communications」でオンライン公開されました。
DNAやRNAを扱った核酸ナノテクノロジーは細胞の機能を変えうる技術であり、これからの医療において大いに期待される分野です。 これまで、DNAを基本にしたDNAナノマシン注3は開発されており、細胞の 検出や化学反応の制御などに使われています。 RNAナノマシンにおいては、RNAの持つ特徴的な高次構造により、多様なナノ構造体が構築できることが期待され注目を集めています (Ohno H. et al, Nat. Nanotech., 2011, Osada E. et al, ACS Nano, 2014, 標的細胞を認識・制御する機能性RNA-タンパク質ナノ構造体の構築とその一分子観察に成功)。 これまでいくつかの核酸ナノマシンが構築され報告されていますが、哺乳類の細胞内で機能するナノマシンの開発は未知であり、標的タンパク質を検知して、精密に集積させることによって細胞の運命を操作できるRNAナノマシンの開発は達成されていませんでした。
1) 特定のタンパク質を検知して構造と機能を変化できるRNAナノマシンを構築した。
キンクターン(K-turn)という構造を持ったRNAにK-turn結合タンパク質であるL7Ae注4を導入すると、約60°の角度を持った安定した構造のRNAになります(図1)。
この特性を用いRNAの構造変化を際立たせるため、2つのK-turn構造と3つのRNA二重鎖を繋げて、L7Aeの導入でトライアングル状の構造を持つRNAを構築しました(図2)。
これらの結果より、RNA-タンパク質相互作用により、RNA構造がダイナミックに 変化し、RNA上にタンパク質を集積できることが分かりました。
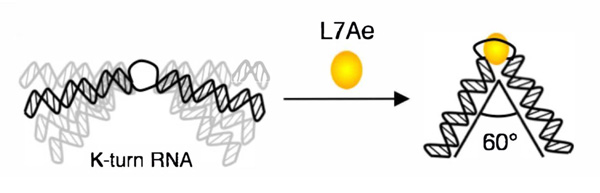
図1 結合タンパク質L7Aeと結合して構造変化するK-turnRNA
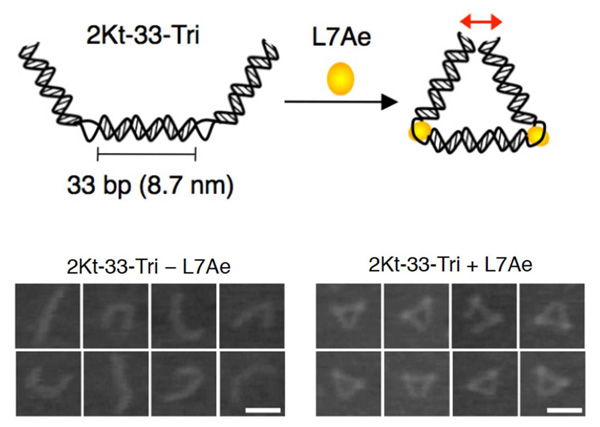
図2 3つに連なるRNA二重鎖がL7Aeの導入でトライアングル状の構造変化になる様子
下図は原子間力顕微鏡(AFM)による観察像(スケールバーは 20nm)
2) 構築したRNAナノマシンを使ってタンパク質を精密に集積し、細胞死を操作する方法を確立した。
集積するとアポトーシス注5を促進するタンパク質であるCasp-8をL7Aeに取り付け(L7Ae-dCasp-8)、 RNAとタンパク質の相互作用でCasp-8の機能を操作できる設計にしました(図3)。
Casp-8が機能するには、多数のタンパク質を集積させる必要があるので、14個のK-turnを導入し、トライアングル状のRNAナノ構造が連なるようにしたRNA(14Kt-33-Tri)を設計しました。
原子間力顕微鏡でタンパク質を集積するRNAナノマシンが構築されたことを確認し(図4a)、そのRNAナノマシンとL7Ae-dCasp-8を産生するmRNAをヒーラ細胞注6に導入して、
24時間後の細胞の変化を位相差顕微鏡とフローサイトメトリー注7で解析しました。すると、ヒーラ細胞内でRNAナノマシンが機能し、明らかに細胞死を促進していることが分かりました(図4b)。
比較のため、L7Aeと相互作用しない変異体RNA(rcKt)を用いた場合の同実験では、細胞死は促進されることなく、細胞が生き残っていることが確認できました(図4c)。
これらの結果より、構築したRNAナノマシンが細胞内でタンパク質との相互作用によって細胞死を操作できる機能を持つことが分かりました。
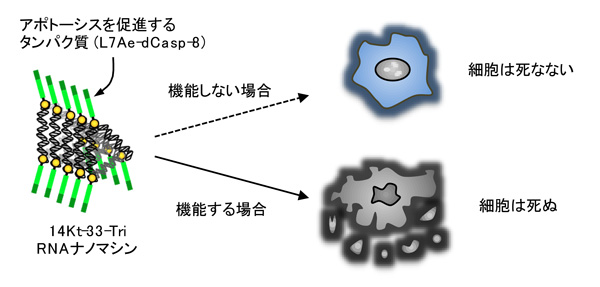
図3 RNAナノマシンによって細胞死を操作する方法
目的のタンパク質と相互作用し、トライアングル状のRNA構造体が構築されてCasp-8が機能する場合は細胞は死に、目的のタンパク質との相互作用がなくRNA構造体が構築されない場合はCasp-8が機能しないので細胞は死なない。

図4 RNAナノマシンによって細胞死を操作している様子
a. L7Aeによって構築されたトライアングル状のRNA構造体を示す原子間力顕微鏡による観察像
(スケールバーは 10nm)
b. RNAナノマシンによって細胞死が促された様子を示す顕微鏡画像(スケールバーは 500μm)
c. L7Aeに反応せずRNAナノマシンを構築しない場合の細胞死が促されていない顕微鏡画像
(スケールバーは 500μm)
3) RNA ナノマシンを使い、細胞内のタンパク質(Lin28A)を検知して細胞死のシグナルを精密に操作できた。
Lin28 タンパク質は、様々ながん細胞や幹細胞で働くことが知られており、その検出技術の開発が注目されています。
Lin28Aと相互作用するよう、RNAナノマシン(9Kt-33-Tri)の一部(K-turn RNA)をpre-let-7d(let-7d マイクロRNA前駆体注8から由来するRNA)で置き換え、新たなRNAナノマシン(9pre-let7d-33)を構築しました。また細胞死のシグナルを制御するためにLin28AにCasp-8を繋げることによりCasp-8が機能するように設計しました。このRNAナノマシンは細胞に内在するLin28Aと結合すると、Lin28A-dCasp-8が結合できなくなるため、
細胞死のシグナルが抑制されて細胞死を招きません。RNAナノマシン(9pre-let7d-33)がLin28Aが存在しないときに細胞死を促進していることをヒーラ細胞で確認した後(図5a)、
Lin28Aを導入した場合のヒーラ細胞ではRNAナノマシン(9pre-let7d-33)が細胞死を抑制していることを確認しました。さらに、元々Lin28Aが含まれるヒトのiPS細胞で同様の実験をし、
細胞死が抑制される同様の結果を得ました(図5 b)。この実験結果によって、L7Aeだけでなく、Lin28Aとの相互作用によって細胞死を操作することが可能なRNAナノマシンが構築できました。
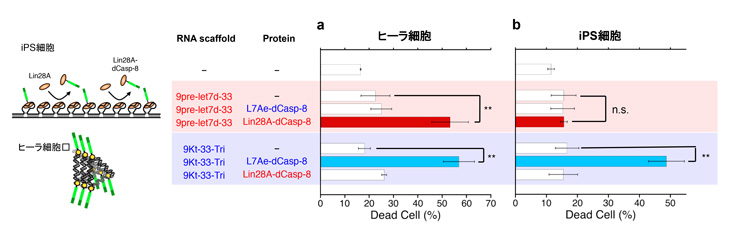
図5 二つのRNAナノマシン(9pre-let7d-33と9Kt-33-Tri)が細胞死を抑制/促進している実験結果
a. ヒーラ細胞に両RNAナノマシンを入れた結果。Lin28A-dCasp-8と9pre-let7d-33及びL7Ae-dCasp-8と9Kt-33-Triの組み合わせで細胞死を促進している。
b. 元々Lin28Aが細胞内に含まれるヒトのiPS細胞に両RNAナノマシンを入れた結果。Lin28A-dCasp-8と9pre-let7d-33では細胞死が抑制されている。
本研究グループは、RNAとタンパク質の相互作用によって生じるRNAの構造変化やタンパク質の集積を利用してRNAナノマシンを構築し、
哺乳類の細胞内において、RNAナノマシンを使って特定のタンパク質を検知し、ナノメートルサイズの距離に集積させ、細胞死を精密に操作することに成功しました。
特定のタンパク質と結合し、機能するRNAナノマシンは、ナノメートルスケールで構造を制御し、細胞死のシグナルを制御できるため、目的の細胞を精密に選別し、
死滅させることができる画期的な手法です。 さらに、合成RNAの導入のみで、標的細胞内においてRNAナノマシンが構築できるので、遺伝子を傷つけるリスクが低く、
安全性と有効性に優れています。このような合成RNAナノマシンの技術は、遺伝子の発現シグナルやタンパク質を検知したり、RNAの構造や機能の変化を誘導したり、
細胞の運命を操作したりする「RNA分子ロボット」として今後発展することが期待できます。
- 論文名
Protein-driven RNA nanostructured devices that function in vitro and control mammalian cell fate - ジャーナル名
Nature Communications - 著者
Tomonori Shibata1, Yoshihiko Fujita1, Hirohisa Ohno1, Yuki Suzuki2,+, Karin Hayashi1, Kaoru R. Komatsu Komatsu1, Shunsuke Kawasaki1, Kumi Hidaka2, Shin Yonehara3, Hiroshi Sugiyama2,4, Masayuki Endo4, and Hirohide Saito1,* - 著者の所属機関
- 京都大学iPS細胞研究所 未来生命科学開拓部門
- 京都大学大学院理学研究科 化学専攻
- 京都大学大学院生命科学研究科
- 京都大学高等研究院物質--細胞統合システム拠点
+ 現所属:東北大学 学際科学フロンティア研究所
*責任者
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会 科学研究費補助金 「若手研究(B)」
- 文部科学省 新学術領域研究「分子ロボティクス」
- 日本学術振興会 科学研究費補助金 「基盤研究(S)」
- 公益財団法人 内藤記念科学振興財団
- キヤノン財団
- 公益財団法人 中谷医工計測技術振興財団
注1) LIN28A
特定の種類の細胞内に存在するタンパク質であり、細胞の初期化や幹細胞の維持に関わる。ヒトiPS細胞は、Lin28Aを高発現している。初期化遺伝子の一つであるLin28によって符号化される。
注2) 核酸ナノテクノロジー
核酸(DNAやRNA)を用いて、物質をナノメートル(nm, 1nm=10-9m)の領域すなわち原子や分子のスケールにおいて操作する技術のこと。
注3) DNA ナノマシン
DNA同士の相互作用などを使ってDNAの塩基配列を調整し、特定の機能を操作できるようにしたナノサイズの装置。例えば、がん細胞を検知して抗体を放出するDNAナノロボットなどが開発された。
注4) L7Ae
古細菌リボソーム大サブユニットに存在するたんぱく質の一つであり、リボソーム構築に必須の因子である とともに、RNA塩基の修飾や、mRNAへの結合など、複数の機能を担う。
注5) アポトーシス
細胞死の1つで、細胞内の何らかの異常に反応して起こるプログラムされた細胞死。発生の過程で不要となった細胞の除去などにも利用されている。
注6) ヒーラ(HeLa)細胞
ヒト由来の最初の細胞株。ヒト子宮頸がんから分離され株化された細胞で、世界中で広く利用されている細 胞の1つ。
注7) フローサイトメトリー解析
流動細胞計測法。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の 大きさ、DNA 量など、細胞の生物学的特徴を解析することができる。
注8) let-7dマイクロRNA前駆体
遺伝子let-7dを持つマイクロRNA前駆体(マイクロRNAになる前のRNA分子)。Lin28は、let-7 miRNA前駆体に結合し、ウリジン付加という作用をすることが分かっている。






















