
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2018年3月28日
ヒトAK2は細胞内エネルギー分子の分配を介して血液前駆細胞の分化運命を制御する
ポイント
- 細網異形成症の患者さん由来iPS細胞を用いて、免疫細胞の分化異常を示すモデルを構築した。
- 患者さん由来iPS細胞から作成したCD34, KDR注1)陽性の血液血管共通前駆細胞注2)は血液細胞への分化能が低下していた。
- この血液血管共通前駆細胞では細胞内ATP濃度がミトコンドリアで高く、核では低い分布を示し、この分化段階において多くの血液分化に関連する遺伝子の発現プロファイルに変動がみられた。
- iPS細胞モデルと前駆細胞における定量的解析によって、これまで解析が不可能であった希少疾患の原因究明、エネルギー分子ネットワークと分化運命制御機構の解明を可能にすることが期待される。
大嶋宏一元研究員(現米国 コロンビア大学メディカルセンター Institute for Cancer Genetics研究員)、佐伯憲和大学院生(京都大学CiRA臨床応用研究部門、大学院医学研究科)、齋藤潤准教授(京都大学CiRA同部門)らの研究グループは、希少疾患である細網異形成症患者さん由来のiPS細胞を用いてこの疾患の病態メカニズムの一端を明らかにすることに成功しました。
細網異形成症は、免疫担当細胞である顆粒球、リンパ球の分化・成熟障害を生じる希少難病の一つで、AK2注3) というミトコンドリア膜間隙に存在し、エネルギー分子であるアデノシン三リン酸(ATP)の細胞内輸送に関わる遺伝子に異常があることが分かっています。しかしながら、AK2の異常が引き起こす細胞内のエネルギー分子の分配異常が、幅広い免疫細胞の分化異常にどのように関係しているかは不明です。研究グループは、細網異形成症の患者さんからiPS細胞を作製し、解析を行なった結果、本疾患における多系統での分化異常は極めて初期の血液前駆細胞の分化機能異常により引き起こされ、AK2によるミトコンドリア-核間でのエネルギー分子の分布調節が分化運命決定に重要な役割を担うことを明らかにしました(図1)。本研究成果は原因未知の病態の解明につながる他、エネルギー分子の分配機構が細胞分化に果たす役割の解明といった細胞生物学的に重要な知見につながることが期待されます。
この研究成果は、2018年3月4日に米国科学誌「Biochemical and Biophysical Research Communications」に掲載されました。
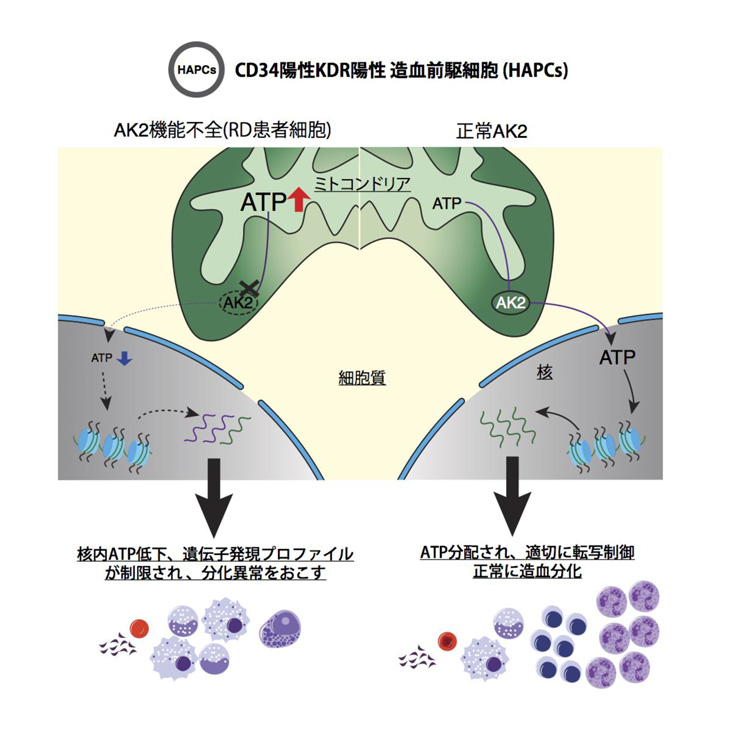
図1: 細網異形成症患者さん由来iPS細胞を用いた本研究の成果概略図
ATPは多くの生化学現象および細胞の機能に必要なエネルギー分子で、常に細胞内で輸送され、消費されるいわば細胞社会の"通貨"です。このATPの産出場所は細胞質やミトコンドリアが知られていますが、細胞の分化段階によって多く産生される場所は異なることがわかっています。細胞内ではアデニル酸キナーゼ(通称AK)によって産出されたATPを各細胞内小器官に輸送し、消費されるATP通貨の流通ネットワークが形成されていますが、細胞内のATP産出拠点の移行が細胞分化に重要な役割を果たすことがわかっている一方で、ATPのやりとりが細胞分化に与える影響に関しては全くわかっていませんでした。
細網異形成症(Reticular dysgenesis 通称RD)は好中球系顆粒球およびT、B、NKリンパ球を欠如する重症型免疫不全症の一つで、本邦では4例、その他諸外国にても約60例程度の報告と非常に希少な疾患の一つです。本疾患はAK2というミトコンドリア膜間隙に存在し、エネルギー分子であるATPの細胞内輸送に関わる遺伝子に異常があることが分かっていますが、AK2の異常が引き起こす細胞内のエネルギー分子の分配異常が、幅広い免疫細胞の分化異常にどのように関係しているかは不明です。そこで本研究グループは2名のRD患者さんからiPS細胞を作製し、血液細胞および血液前駆細胞を分化誘導し、解析を行いました。
1)RD患者さん由来iPS細胞の分化表現系評価
作製したRD患者さん由来iPS細胞から好中球、Tリンパ球などの血液細胞へ分化誘導を行いました。
得られた血液細胞像は、好中球に特徴的な分葉核を持たない未熟なもので(図2A)、T細胞の細胞表面マーカーの発現をフローサイトメトリー注4)を用いて解析したところ、その発現はほとんど見られませんでした(図2B)。一方で患者さん由来iPS細胞に対してレンチウィルスベクター注5)を用いて正常AK2遺伝子を導入したiPS細胞を血液分化誘導すると、これらの分化異常は正常レベルまで改善されました。以上の結果から作製したRD患者さん由来iPS細胞は病態を再現するモデルとして有効であることが示されました。
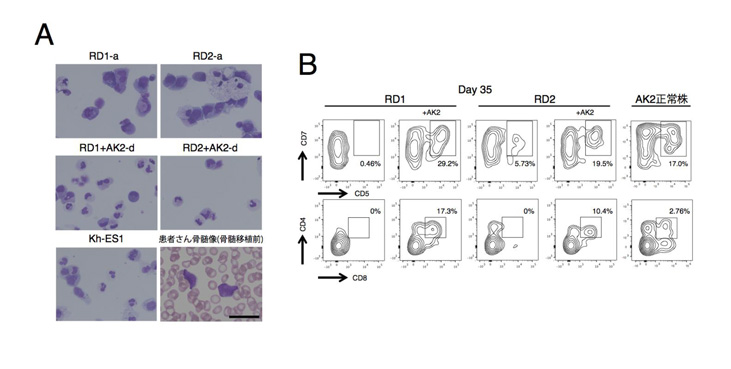
図2: 細網異形成症患者さん由来iPS細胞から分化誘導した好中球、Tリンパ球の分化成熟評価
A:メイ-ギムザ染色像による好中球の成熟評価。好中球は成熟に伴い、細胞核が歪み、最終的には形が複数に分かれた分葉核となる。上段:患者さん由来株 中段:正常AK2導入株(+AK2) 下段左:Kh-ES1(健常者コントロール) 下段右:患者さん骨髄像 スケールバーは50 μm
B:分化35日目におけるTリンパ球系細胞表面マーカーの解析。患者さん由来株ではどのマーカーにおいても発現した細胞がほとんどみられないが、AK2導入株(+AK2)では正常コントロールと同等の割合まで増加している。
2)RDでは初期の造血前駆細胞の段階で分化運命決定に異常がみられる
RDでは他系統の血液細胞に分化異常がみられるため、分化途中段階の前駆細胞に疾患の原因があることが予想されました。そこで、分化の途中段階ごとに細胞表面マーカーの解析を行ったところ、CD43注6)陽性の前駆細胞の割合が患者さん由来AK2欠失株において減少していることがわかりました(図3A)。次にさらに初期の分化段階であるCD34, KDRに関して解析したところ、CD34, KDR陽性血液血管共通前駆細胞(Hemoangiogenic progenitor cells; HAPCs)の割合は逆に増加していることがわかりました(図3B)。この増加したHAPCsの血液分化能力を評価するため、メチルセルロースを用いた造血コロニー形成細胞アッセイ注7)を実施したところ、著しく分化能が低下していることがわかりました(図3C,D)。この結果からRDでは極めて初期の造血前駆細胞において分化障害がおこっていることが示唆されました。
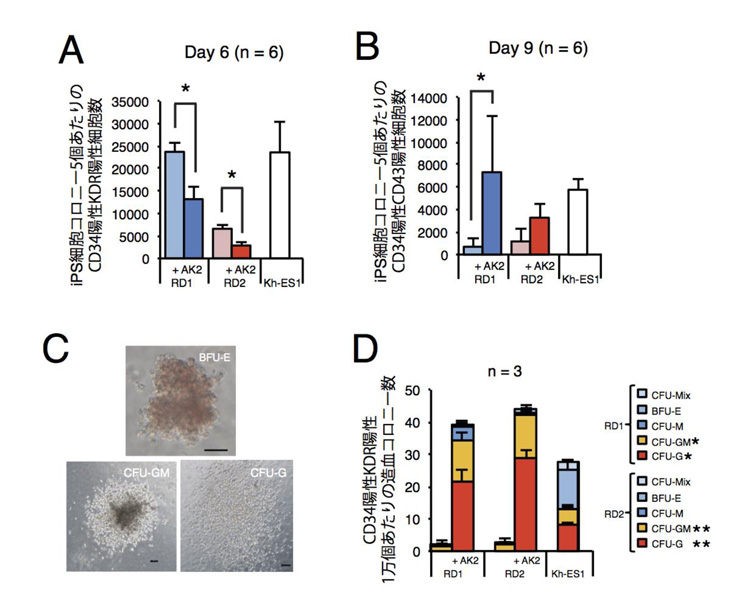
図3: 血液前駆細胞の表面マーカーの解析および分化能の評価
A:分化6日目におけるCD34, KDR陽性細胞数。
B:分化9日目におけるCD34, CD43陽性細胞数。
C:メチルセルロース中に形成された造血細胞コロニー。
D:CD34, KDR陽性細胞を用いた造血コロニー形成アッセイ結果。
3)HAPCsにおけるATPの細胞内分配エラーが細胞内遺伝子プロファイル異常を介して分化障害を引き起こす
AK2の機能であるATP輸送の異常が、どのように細胞内ATP分布に影響を与えているか明らかにするためにATPを可視化する蛍光タンパク質AteamをiPS細胞に導入し、分化障害の原因細胞と考えられるHAPCsへ分化誘導を行い、高感度共焦点レーザー走査型顕微鏡注8)によって生きた細胞の細胞小器官(細胞質、ミトコンドリア、核)におけるATP濃度を定量しました(図4A)。その結果、患者さん由来AK2欠失株においてミトコンドリアでは高く、核では低い濃度であることがわかりました。また、この現象はiPS細胞の段階ではみられず、HAPCs分化段階に特異的であることが示されました(図4B)。このことから、HAPCsではAK2の異常によりミトコンドリアからATPを汲み出せず、その結果、核ATP量が低下することが示唆されました。核内のATPは遺伝子の発現や制御に重要な転写機構に関わることが知られています。そこで、マイクロアレイ解析注9)によって分化ステージごとに遺伝子発現プロファイルを網羅的に解析し、核内ATP量の低下による遺伝子発現への影響を調べました。その結果、患者さん由来AK2欠失株では特にHAPCsの段階で多くの遺伝子発現量に変動がみられ(図4C)、その遺伝子群を遺伝子オントロジー解析注10)によって機能を調べると、血液細胞の分化に関係する遺伝子が多く含まれていることがわかりました(図4D)。
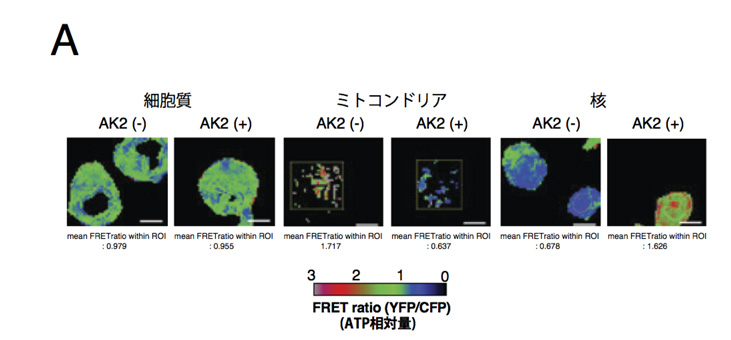
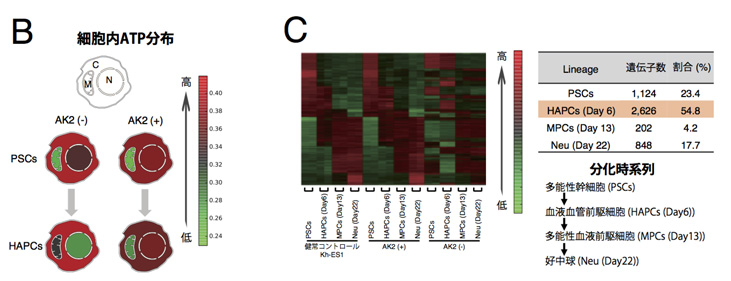
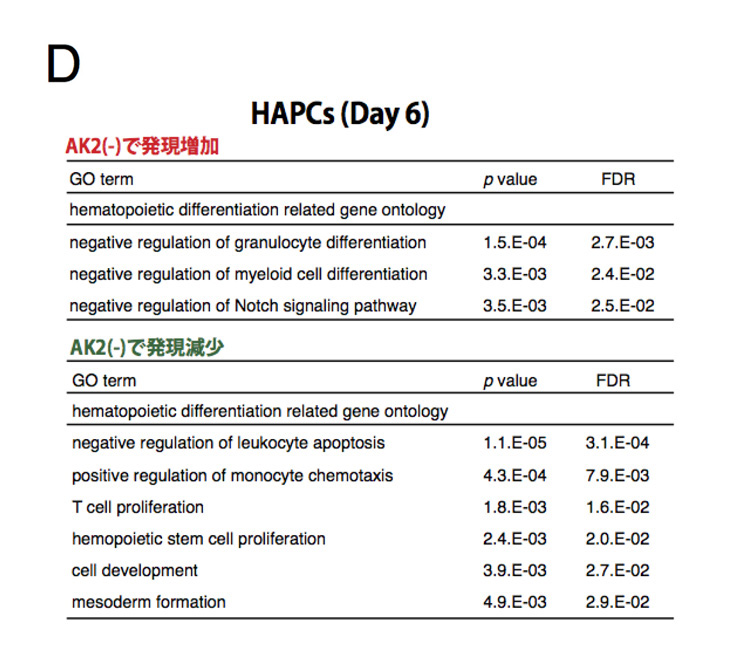
図4: 血液前駆細胞における細胞内ATP分布の定量解析と遺伝子発現解析
A:1細胞中の各細胞小器官におけるATP濃度定量画像。赤色に近づくほど高いATP濃度であることを示す。
B:細胞内ATP分布図概略。N: 核、M: ミトコンドリア、C: 細胞質。多能性幹細胞の段階では差がみられないが、HAPCsにおいては患者さん由来AK2欠失株においてミトコンドリアでは高く、核では低い値を示している。
C:各分化ステージにおける遺伝子発現プロファイル。患者さん由来AK2欠失株では発現パターンが異なっており(左)、特にHAPCsにおいて多くの遺伝子に変動がみられる(右)。
D:HAPCsにおいて発現変動がみられた遺伝子群に多く該当する血液細胞の分化に関係する機能一覧。
以上の結果からAK2は血液前駆細胞において、ミトコンドリアで産生されたATPを汲み出し、核のATP量を調節することで、細胞内の遺伝子発現を介して分化運命を制御することが示唆されました。細胞種および分化ステージ特異的なエネルギー通貨流通ネットワークの調節機構が果たす細胞分化における役割に対して言及されており、今後のより深い細胞分化、発生の理解に貢献することが期待されます。また、AK2に機能欠損を有するRD患者さん由来iPS細胞を用いた解析によって、CD34陽性KDR陽性の極めて初期の分化ステージの細胞内でのATP分布の異常が多系統の免疫細胞の分化異常に結びつくことが明らかになりました。これまで病態メカニズムが全く未知であった本疾患に対して、さらなる研究や治療法の探索に貢献するものと期待されます。
- 論文名
"Human AK2 links intracellular bioenergetic redistribution to the fate of hematopoietic progenitors" - ジャーナル名
Biochemical and Biophysical Research Communications - 著者
Koichi Oshima1*, Norikazu Saiki1*, Michihiro Tanaka1, Hiromi Imamura2, Akira Niwa1, Ayako Tanimura4, Ayako Nagahashi1, Akiyoshi Hirayama3, Keisuke Okita1, Akitsu Hotta1, Shuichi Kitayama1, Mitsujiro Osawa1, Shin Kaneko1, Akira Watanabe1, Isao Asaka1, Wataru Fujibuchi1, Kohsuke Imai5, Hiromasa Yabe6, Yoshiro Kamachi7, Junichi Hara8, Seiji Kojima7, Masaru Tomita3, Tomoyoshi Soga3, Takafumi Noma4, Shigeaki Nonoyama9, Tatsutoshi Nakahata1, Megumu K. Saito1**
* 筆頭著者
** 責任著者 - 著者の所属機関
- 京都大学 iPS細胞研究所
- 京都大学白眉センター
- 慶應義塾大学先端生命科学研究所
- 徳島大学大学院 医歯薬学研究部 分子医化学分野
- 東京医科歯科大学 大学院医歯学総合研究科 茨城県小児・周産期地域医療学講座
- 東海大学 医学部 小児科
- 名古屋大学 大学院医学系研究科 小児科
- 大阪市立総合医療センター 小児血液腫瘍科
- 防衛医科大学校 小児科
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞を活用した難病研究」
- AMED 難治性疾患実用化研究事業
- AMED 再生医療実用化研究事業
- 日本学術振興会・文部科学省 科学研究費補助金
注1) CD34, KDR
造血幹細胞や血管内皮幹細胞に発現している細胞表面マーカー。CD34は糖鎖修飾された膜貫通型タンパク質で、未分化状態の前駆細胞維持に関係し、KDRは血管内皮細胞増殖因子(VEGF)の受容体で、前駆細胞の増殖と分化に関係することが知られている。
注2) 血液血管共通前駆細胞
Hemoangiogenic progenitor cells (HAPCs)とよばれる発生初期の前駆細胞で、CD34を細胞表面に発現し、血液細胞と血管内皮細胞の双方に分化する能力を有する。
注3) AK2
アデニル酸キナーゼの一つで、ミトコンドリアの外膜と内膜にある膜間隙空間に存在する。ATP+AMP⇄2ADPの反応を触媒し、連鎖反応により、ミトコンドリア内のATPをミトコンドリア外へと汲み出す機能を有する。
注4) フローサイトメトリー
流動細胞計測法。レーザー光によって散乱光や蛍光を測定し、流路を通過する単一細胞の生物学特徴を解析することができ、測定された値を基準に細胞を分取することも可能なセルソーター機能を有するものもある。
注5) レンチウイルスベクター
HIV-1 (Human immunodeficiency virus 1)を基に開発された非分裂細胞に対しても効率的に遺伝子を導入することが可能な媒介
注6) CD43
膜糖タンパクの一つで、全ての白血球に発現がみられる細胞表面マーカー。血液分化においては多分化能を持つ前駆細胞から血液系細胞への分化の指標として用いられる。
注7) 造血コロニー形成細胞アッセイ
各種の分化因子を含むメチルセルロースなどの半固形培地で培養することで、一つの血液幹細胞から細胞集団を形成し、形成された集団を観察することで、造血細胞の増殖・分化能を評価する手法。
注8) 高感度共焦点レーザー走査型顕微鏡
標本に焦点位置を絞ったレーザー光によって励起された蛍光のみを取得することで、より強いコントラストを得ることができる顕微鏡装置。蛍光の検出器にはGaAsP(ガリウム砒素リン)型を用いることで、より微弱な蛍光の取得が可能で、レーザー強度を抑えたより細胞毒性の少ない生細胞イメージングが可能となっている。
注9) マイクロアレイ解析
多数のDNA断片を基板上に配置しておき、検体と反応させることで数万の遺伝子発現を一度に調べる解析手法。
注10) 遺伝子オントロジー解析
データベース化されている遺伝子関連情報をもとに、得られた網羅的遺伝子発現データを生物学的プロセス、細胞の構成要素、分子機能の3つのカテゴリーに分け、遺伝子群ごとに解析する手法。






















