
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2023年2月28日
自由診療で行われる再生医療の審査に関する課題を調査 今後の制度改正に期待

ポイント
- 再生医療を実施する際に、審査を行う特定認定再生医療等委員会の課題を調査し、関連法規等と比較しながら包括的に分析・検証を行いました。
- その結果、複数の課題が具体的かつ定量的に明らかになりました。
- 本論文が報告した内容を受けて、現在進められている再生医療法の改正の議論に社会的な関心が向けられ、再生医療法の改正や現行制度の運用の見直しがより適切なものになること、また、患者さんの再生医療に対する理解や治療選択の参考になることを願います。
- 研究チームは、今後、再生医療以外にもがん治療や難治性疾患の分野等で行われる「科学的エビデンスの不明な医療」に関する調査・研究を進めてまいります。
国立がん研究センター生命倫理部 部長 一家綱邦と京都大学 iPS細胞研究所上廣倫理研究部門 特定教授/高等研究院 ヒト生物学高等研究拠点 主任研究者 藤田みさおを中心とする、静岡社会健康医学大学院大学、東京学芸大学等との研究チームは、再生医療を実施する際に遵守する「再生医療等の安全性の確保等に関する法律(以下、再生医療法)」に基づき、当該再生医療等提供計画の審査を行う特定認定再生医療等委員会(以下、委員会)の設置・運用方法等の課題を調査し、関連法規等と比較しながら包括的に分析・検証を行いました。
その結果、独立・公正な審査を期待できない委員会が存在すること、また当該委員会による審査に基づき承認された治療計画の中に安全性の科学的根拠や医師の専門性に疑義が認められるものが一定数あること、さらに誇大広告等不適切な広告によって患者さんの理解や治療選択が誤導される恐れがあることが、具体的かつ定量的に明らかになりました。
本研究は、厚生労働省の委託事業「認定再生医療等委員会の審査の質向上事業」(令和元(2019)年度~令和2(2020)年度)における制度検証班の班員らにより行われ、同事業で制度検証班が報告した調査結果(邦文報告書は第66回厚生科学審議会再生医療等評価部会の資料として公開)について、学術誌「Stem Cell Reports」に2023年2月23日付(日本時間2月24日午前1時)で掲載されました。
再生医療法は、わが国の再生医療を国民が迅速かつ安全に受けられるようにするために、2013年に制定されました。再生医療法に基づき、再生医療を「治療(現状の圧倒的多数は自由診療)」または「臨床研究」として実施する場合には、医療機関は厚生労働大臣の認定を受けた委員会に再生医療の提供計画を提出して審査を受けます。委員会は、再生医療等技術や法律の専門家等の有識者からなる合議性の委員会で、現在(2022年12月31日時点)、162の委員会が認定されています。また、審査を受けて現在実施できる状況にある再生医療の提供計画は、治療(自由診療)が5013件、臨床研究が104件です。
このような国が治療の実施計画に対して法規制(第三者審査の制度)を設ける仕組みは、他の医療分野には殆ど前例がなく、必要性のみならず実効性に懸念が持たれてきました。また、再生医療法の施行後は、法制度の要である委員会の審査の質が、厚生科学審議会再生医療等評価部会において問題視され、その課題や問題点に対応するため、厚生労働省は委託事業「認定再生医療等委員会の審査の質向上事業」を令和元(2019)年度から始めました。
同事業の制度検証班は、改善すべき課題の抽出と改善策の提言をミッションとし、令和元(2019)年度と令和2(2020)年度に報告書を作成しました。報告書は、制度改正を要する実態があるのかを明らかにする「立法事実に関する調査」と、その結果を受けての「調査結果についての考察と法令改正等の提案」から成り、第66回厚生科学審議会再生医療等評価部会(2021年9月29日)で報告されました。今回発表した論文は「立法事実に関する調査」として行われた5つの調査結果の概要を整理したものです。
本論文が示す5つの調査結果の概要は以下の通りです。
まず、委員会の「審査の質」を「審査を受けて、実施が可能となった計画の内容」で測ることにしました。具体的には、第二種再生医療等の治療計画を対象に「安全性の科学的根拠の有無」と「医師の専門性」の2点に着目して調査・分析をしました。
1. 治療計画の安全性の科学的根拠の有無を調査
第二種再生医療等の治療計画351件と添付された文献2495件を対象に、当該治療計画が治療としての安全な実施を裏付けるだけの科学的根拠に基づいているかを調査しました。主な調査結果として、①添付文献が確認できなかった計画:20件(5.7%)、②添付文献の内容が判別不能だった計画:15件(4.3%)、③Predatory Journal (いわゆるハゲタカ・ジャーナル)掲載論文を引用した計画:8件(2.3%)、④安全性を確認できる臨床研究論文の引用なし(細胞と対象疾患についての不一致、結論が安全性証明せず等)の計画:45件(12.8%)があることを確認しました。すなわち、合計88件(25.1%)の計画に安全性の科学的根拠に疑義が生じる結果となりました。
2. 治療計画に関与する医師の専門性を調査
第二種再生医療等の治療計画391件を対象に、当該計画が治療対象とする疾患等とその治療を実施する医師の専門性とが適合するかを調査しました。主な調査結果として、両者の間にミスマッチがあることが「強く推定される計画55件(14.1%)」、「推定される計画62件(15.9%)」があることを確認しました。すなわち、合計117計画(30.0%)に対象疾患等と医師の専門性にミスマッチがあることを確認しました。
つまり、2つの観点から一定数の第二種再生医療等の治療計画の適切性に疑義が生じました。そこで、委員会の審査を受けて、このような治療計画が社会に出てくることの背景を検討する調査を続けました。
3. 公開されている説明文書を調査
第二種再生医療等の治療計画371件を対象に、計画名と説明文書の内容を調査しました。その結果、①371件の治療計画のうち241件(65.0%)は、他に全く同一の名称の計画があること、②同一名称の治療計画の間では、説明文書の内容も同一であると判断できること、③いくつかの計画の説明文書については、ファイル作成者名が同一であることが明らかになりました。このことから国内の多くの再生医療等提供機関の間で、説明文書ひいては治療計画の複製利用が行われていることが推測されました。さらに、④複製利用される治療計画は、特定少数の委員会で審査を受けていること、つまり、審査を受ける委員会の選択をめぐって偏りが生じていることが明らかになりました。
4. 独立・公正な審査を期待できない三者関係を調査
委員会審査の不自然な偏りについて、その理由・背景には、審査を受ける再生医療等提供機関と審査をする認定再生医療等委員会を結びつける企業(X)があることを、インターネット上の情報に基づいて4つのケースで確認しました。すなわち、(4つのケースで異なる)企業Xは、一方で再生医療等提供機関に対して再生医療等提供計画の作成・実施を支援し、他方では認定再生医療等委員会の運営に関与し、その委員会で自らが支援する再生医療等提供機関の治療計画を審査させていることが推測されました(図1)。この三者関係下では、再生医療法施行規則が求める独立・公正な審査を期待できない恐れがあります。
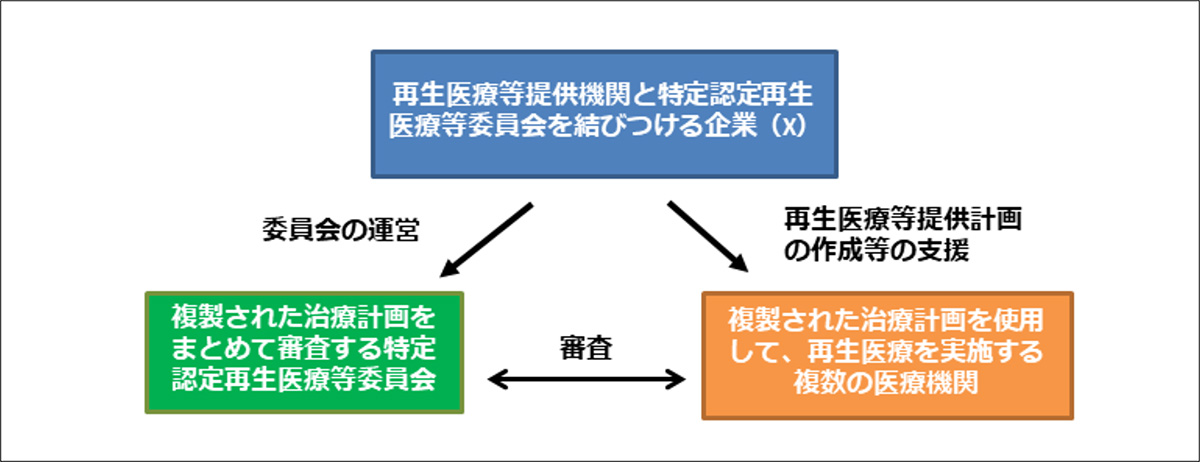
図1. 委員会による独立・公正な審査を期待できない三者関係
以上の調査結果から、独立・公正な審査を期待できない関係下での委員会審査が行われ、安全性の科学的根拠や医師の専門性に疑義がある治療計画が実施されていることが確認されました。そうした結果を受けて、そのような再生医療に対する宣伝広告の内容を、最後に調査しました。
5. 再生医療等提供機関のウェブサイトを調査
第二種再生医療等の治療計画を実施する医療機関のウェブサイト254件を対象に、医療法が規制する誇大(虚偽)広告に該当する恐れがある文言があるかを調査しました。その結果、132件(51.9%)の医療機関のウェブサイトにおいて、「再生医療法の手続に従って行う」「厚生労働省の承認を得ている」「国が認定した委員会の厳しい審査をクリアして行う」等の文言を確認しました。
本論文が報告した内容を受けて、現在進められている再生医療法の改正の議論に社会的な関心が向けられ、結果的に再生医療法の改正や現行制度の運用の見直しがより適切なものになること、また、患者さんの再生医療に対する理解や治療選択の参考になることを願います。
なお、本論文の著者の一部は、日本学術振興会科学研究費助成事業・基盤研究B「科学的エビデンスの不明な医療への社会的対応についての学際的研究班」のメンバーでもあります。再生医療以外にも、がん治療や難治性疾患等の分野で行われる「科学的エビデンスの不明な医療」に関する調査・研究を進めてまいります。
- 論文名
Difficulties in ensuring review quality performed by committees under the Act on the Safety of Regenerative Medicine in Japan - ジャーナル名
Stem Cell Reports - 著者
Tsunakuni Ikka*1,2, Misao Fujita*3,4, Taichi Hatta5, Tetsu Isobe6, Kenji Konomi7, Tatsuo Onishi8, Shoji Sanada9, Yuichiro Sato10, Shimon Tashiro11, Morikuni Tobita12
*: Corresponding Author - 著者の所属機関
- 国立がん研究センター がん対策研究所/生命倫理・医事法研究部
- 国立がん研究センター 研究支援センター生命倫理部
- 京都大学iPS細胞研究所 上廣倫理研究部門
- 京都大学高等研究院 ヒト生物学高等研究拠点
- 静岡社会健康医学大学院大学 静岡社会健康医学研究科
- 慶應義塾大学大学院法学研究科
- 慶應義塾大学病院臨床研究推進センター
- MLIP経営法律事務所
- 神戸大学医学部附属病院臨床研究推進センター
- 東京学芸大学教育学部
- 東北大学大学院文学研究科
- 順天堂大学革新的医療技術開発研究センター
- 掲載日
2023年2月23日付(日本時間2月24日午前1時)オンライン・プレ・リリース
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会科学研究費助成事業・基盤研究B
「科学的エビデンスの不明な医療への社会的対応についての学際的研究」 - 日本学術振興会科学研究費助成事業・若手研究B
「医学研究に対する法的・倫理的規制を考える研究」 - 日本学術振興会科学研究費助成事業・基盤研究C
「ヒト細胞を用いた治療及び基礎研究の規制策定議論に資する実態調査」






















