ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2014年6月27日
ヒトiPS細胞由来のグリア系神経前駆細胞移植でALSモデルマウスの生存期間を延長
近藤孝之研究員、井上治久教授(京都大学CiRA増殖分化機構研究部門)らの研究グループは、CiRA山中伸弥教授、京都大学大学院医学研究科高橋良輔教授、慶應義塾大学医学部岡野栄之教授(生理学)・中村雅也准教授(整形外科学)らのグループとともに、ALSのモデルマウスにヒトiPS細胞由来のグリア系神経前駆細胞を移植することで、ALSマウスの生存期間を延長する効果があることを見出しました。
この研究成果は2014年6月26日正午(アメリカ東部時間)に「Stem Cell Reports」のオンライン版で公開されました。
ポイント
・ヒトiPS細胞由来のグリア系神経前駆細胞注1)を筋萎縮性側索硬化症(ALS)注2)のモデルマウスに移植することでマウスの生存期間が延長した
・移植細胞は多くがアストロサイトに分化し、神経栄養因子を増加させ脊髄環境を改善した
・ALSの治療にiPS細胞が細胞源として有用である可能性が示された
1. 要旨
遺伝子(SOD1)の変異によるALSモデルマウスに、マウスおよびヒト胎児由来の神経前駆細胞を移植することで、運動神経細胞の変性や病態の進行が緩和することが知られていました。臨床の現場にこの成果を応用するためには、持続的に供給が可能であるヒトの細胞で研究を行う必要がありました。井上教授らのグループは、ヒトiPS細胞からグリア系神経前駆細胞を誘導し、それをALSマウスモデルの腰髄に移植しました。移植された細胞はアストロサイト注3)へと分化し、移植されたマウスのグループの生存期間は移植されていないマウスと比べて長くなりました。また、移植された細胞は、神経栄養因子が増加し、脊髄環境が改善されることが示唆されました。この結果は、ヒトiPS細胞を使うALSの細胞移植治療の可能性を示しています。
2. 研究の背景
ALSは運動神経細胞が変性してしまうことで、次第に筋肉が動かせなくなる疾患です。ALSのうち9割は孤発性で、残りの1割程度が遺伝性と言われています。遺伝性のうち、20%がSOD1という遺伝子が変異していることが知られています。変異したSOD1遺伝子をもつマウスやラットでは、ヒトのALSと同じような症状が見られ、ALSモデルとして使われてきました。
ALSは運動神経細胞の機能が失われることが原因の病気ですが、ALSモデルマウスや細胞レベルでの研究から、神経細胞以外の、グリア細胞注4)が病気の進行に関わっていることがわかってきました。グリア細胞の中でも特にアストロサイトは、孤発性のALSと遺伝性のALSの両方に関わっているのではないかと考えられています。
これまでに、胎児由来神経幹細胞を始めとしてさまざまな種類の細胞移植研究が試みられてきました。しかし移植用細胞の供給は限られており、倫理的な問題も有ることから、安定した調達は容易ではありませんでした。ヒト多能性幹細胞を用いた細胞移植治療は、患者さんにかける負担が少なくてすみ、必要な数まで増やすことができることから、移植用細胞の供給源として優れています。そこで井上教授らのグループは、ヒトiPS細胞からグリア系神経前駆細胞へと分化させる方法を確立し、ALSの細胞移植治療に使う細胞としての有用性を検証しました。
3. 研究結果
1) iPS細胞由来のグリア系神経前駆細胞移植はALSモデルマウスの生存期間を延長した
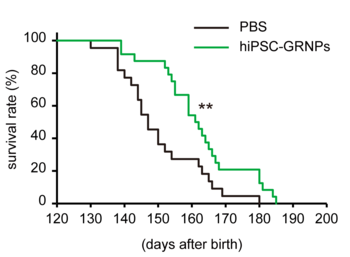
ALSの症状が出始めている生後90日のALSモデルマウスの腰髄部分にiPS細胞から誘導したグリア系神経前駆細胞をマウス1匹あたり8万個移植しました。実験はそれぞれ24匹(雄17匹、雌7匹)で行ない、生後何日まで生き延びるのか、生存期間を比較しました(Fig. 1)。その結果、コントロール群(細胞移植しなかったマウス)では平均生存期間が150.4±12.1日であるのに対して、細胞移植群では162.2±12.8日と7.8 %長くなっていることがわかりました。
図1 ALSモデルマウスの生存期間が延長したPBS: コントロール群hiPSC-GRNPs: グリア系神経前駆細胞を移植した群
2) 移植したグリア系神経前駆細胞はアストロサイトに分化した
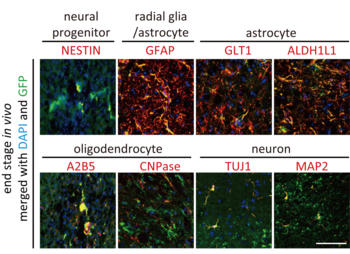
生後140〜170日目(細胞移植後、50〜80日目)のマウスで、移植した細胞がどのような細胞へと分化しているのか調べました。移植したグリア系神経前駆細胞にはGFP(緑色蛍光タンパク質)を組み込んでおき、外から移植した細胞と元々のマウスの細胞とを見分けられるようにしておきました。細胞を移植した部位の組織切片を作成し、神経細胞やアストロサイト、オリゴデンドロサイトのマーカーを指標に免疫染色注5)を行いました(Fig. 2)。移植した細胞(緑色)はアストロサイトのマーカーであるGFAPやGLT1、ALDH1L1(赤色)と重なって黄色に観察される一方で、神経前駆細胞のマーカー(NESTIN)、オリゴデンドロサイトのマーカー(A2B5やCNPase)および神経細胞のマーカー(TUJ1やMAP2)とはほとんど重なっていませんでした。つまり移植したグリア系神経前駆細胞は主にアストロサイトに分化したと考えられます。また、観察した限りでは腫瘍の形成は見られませんでした。
図2 移植した細胞は主にアストロサイトに分化した
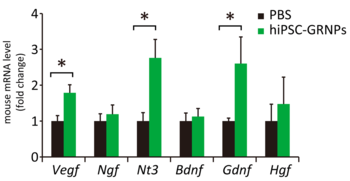
3) 細胞移植により神経栄養因子が増加した
治療効果の機序を検討するために神経栄養因子の発現量を検討すると、生着した移植細胞に加え、ホストであるマウスの細胞の神経栄養因子の発現量も増加していることがわかりました。
図3 細胞移植により神経栄養因子が増加したPBS: コントロール群hiPSC-GRNPs: グリア系神経前駆細胞を移植した群
4. まとめ
ALSは運動神経細胞が正しく機能しなくなり、筋肉が動かせなくなる進行性の病気です。iPS細胞を用いたALS研究には大きく分けて2つの方法があります。一つはALSの病態を再現してその病態を改善する治療薬を見つける研究、もう一つはALSになって上手く働かなくなってしまった運動神経細胞を、細胞移植によって保護したり、新たに再生させる研究です。今回は細胞移植という手法を用いた後者の研究で、グリア系神経前駆細胞(後に多くがアストロサイトに分化していた)を移植することにより、ALSモデルマウスでは治療効果を有することを報告しました。
神経栄養因子はALSの病態に重要であり、治療標的の一つとして世界中で検討されています。今回我々が検討した細胞移植治療においても、神経栄養因子が増加しておりALSモデルマウスの脊髄環境を改善したことが示されました。
グリア系の細胞は神経細胞の周りの環境を整える機能をもっている細胞です。つまり、本来機能させるべき運動神経細胞を花に例えると、その花を咲かせるために必要な栄養分を供給する土の役割をする細胞です。しかし枯れてしまいつつある花を新たに植え直すこと、すなわち失われた運動神経細胞の再生は非常に難しいのが現状です。そこで今回は良い土を補うことを行いましたが、より根本的な治療のためには花の植え直しが有効であると考えられます。将来的には運動神経細胞も移植することで、より大きな機能回復効果があるかもしれませんが、解決すべき課題は多く、実際にヒトで治療効果をみる段階に至るまでには、多くの時間が必要です。
5. 論文名と著者
・論文名
"Focal transplantation of human iPSC-derived glial-rich neural progenitors improves lifespan of ALS mice"
・ジャーナル名
Stem Cell Reports
・著者
Takayuki Kondo1,2,3, Misato Funayama1,3, Kayoko Tsukita1,3, Akitsu Hotta1,3,4,5, Akimasa Yasuda6, Satoshi Nori6, Shinjiro Kaneko6,7, Masaya Nakamura6, Ryosuke Takahashi2, Hideyuki Okano6, Shinya Yamanaka1,8, Haruhisa Inoue1,3*
・著者の所属機関
1. 京都大学CiRA
2. 京都大学大学院医学研究科
3. JST CREST
4. JST さきがけ
5. 京都大学iCeMS
6. 慶應義塾大学医学研究科
7. 村山医療センター
8. グラッドストーン研究所
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
・文部科学省 再生医療の実現化プロジェクト
・内閣府 最先端研究開発支援プログラム(FIRST)
・科学技術振興機構 CREST注6)
・日本学術振興会 新学術領域研究 「シナプス・ニューロサーキットパソロジーの創成」
7. 用語説明
注1) グリア系神経前駆細胞
神経系の幹細胞は、神経細胞(ニューロン)もしくはグリア細胞(アストロサイト、オリゴデンドロサイト)へと分化する能力が有る。培養環境の調整により、グリア細胞への誘導効率を高めた神経前駆細胞を移植に用いた。
注2) ALS (Amyotrophic lateral sclerosis: 筋萎縮性側索硬化症)
筋肉が次第に萎縮し、全身の筋肉が動かなくなる病で、最終的には呼吸筋麻痺で亡くなる方が多い。運動神経細胞に異常が生じることが原因であることがわかっているが、これまでに有効な治療法は確立されておらず、日本では特定疾患に認定されている。およそ90%程度が遺伝性の認められない孤発性であり、残りの10%が遺伝性であり、そのうちの2割程度(患者さん全体の2%程度)がSOD1(スーパーオキシドジスムターゼ1)という遺伝子に変異があることが知られている。
注3) アストロサイト
中枢神経系を構成する3種類のグリア細胞の一つ。多くの染色法で星形に見えることから、星状(アストロ)と名付けられている。極めて多数の突起を密にもち、複雑な構造をしている。神経ネットワークの構造を維持や、周辺の環境を調節する機能を持っている。
注4) グリア細胞
神経細胞の周りの環境を整え、神経細胞の生存や機能をサポートする働きを持つ細胞。アストロサイト、オリゴデンドロサイト、マイクログリアの3種類の細胞がある。ALSにおいては、グリア細胞が作り出す脳神経系の環境が、運動神経細胞死を始めとした病態を修飾することが知られている。
注5) 免疫染色
特定のタンパク質を認識する抗体を用いて、そのタンパク質が存在する場所に色を付ける方法。本研究では分化した細胞(アストロサイト・オリゴデンドロサイト・神経細胞など)に特異的なタンパク質を指標として用いて、どの細胞に分化したのかを判別するために利用した。
注6) JST戦略的創造研究推進事業 チーム型研究(CREST)
研究領域 「人工多能性幹細胞(iPS細胞)作製・制御等の医療基盤技術」
(研究総括:須田 年生 慶應義塾大学 医学部 教授)
研究課題名 「iPS細胞を駆使した神経変性疾患病因機構の解明と個別化予防医療開発」
研究代表者 井上 治久(京都大学iPS細胞研究所 教授)
研究期間 平成21年10月〜27年3月