ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2015年2月27日
ヒトiPS細胞から硝子軟骨の作製〜関節軟骨損傷の再生治療法開発へ向けて〜
山下晃弘研究員、妻木範行教授(京都大学CiRA増殖分化機構研究部門)らの研究グループは、松田秀一教授(京都大学大学院医学研究科)らのグループと共同でヒトiPS細胞から、軟骨細胞を誘導し、さらに硝子軟骨の組織を作製し、マウス、ラット、ミニブタへの移植によりその安全性と品質についての確認を行いました。この研究成果は2015年2月26日正午(米国東部時間)に「Stem Cell Reports」で公開されました。
ポイント
* 軟骨細胞になると蛍光を発するヒトiPS細胞を作製し、軟骨細胞への分化培養方法を検討した。
* ヒトiPS細胞由来軟骨細胞から足場材注1を使わずに軟骨組織注2を作製する培養法を確立した。
* ヒトiPS細胞から作製した軟骨組織を免疫不全マウスやラットに移植したところ、硝子軟骨注3が形成され、腫瘍形成はみられなかった。
* ヒトiPS細胞から作製した軟骨組織を、関節軟骨を損傷させたラットやミニブタの患部に移植したところ、生着して損傷部を支えた。
1.要旨
山下晃弘 研究員、妻木範行 教授(京都大学CiRA増殖分化機構研究部門)らの研究グループは、松田秀一 教授(京都大学大学院医学研究科)らのグループと共同でヒトiPS細胞から、軟骨細胞を誘導し、さらに硝子軟骨の組織を作製し、マウス、ラット、ミニブタへの移植によりその安全性と品質についての確認を行いました。
具体的には、まず、ヒトiPS細胞から軟骨細胞を作製するための培養条件を検討した上で、そこから足場剤を使わずに細胞自身が作るマトリックスからできた硝子軟骨組織を作製することに成功しました。この軟骨組織を免疫不全マウスへ移植して3ヶ月間、腫瘍形成や転移が見られないこと、つまり移植細胞の安全性を確認しました。さらに、免疫不全ラットの関節に移植して安全性に加えて隣接する生体内の軟骨と融合することを検証し、免疫抑制剤を投与したミニブタの関節で1ヶ月にわたり生着し続けることを確認しました。
今回の研究成果は、iPS細胞由来軟骨細胞の関節軟骨損傷患者さんへの移植再生治療に向けた安全性、有効性確認の第一歩となりました。今後は、ヒトへの臨床応用を目指して、有効性や安全性の確認など、さらにデータを積み重ねる予定です。
2.研究の背景
関節軟骨は、骨の端を覆い、腕や膝を曲げた時などにかかる衝撃を吸収する組織です。正常な関節軟骨は硝子軟骨と呼ばれます。私達の日常動作のひとつひとつを、なめらかに行うためにも大切な組織ですが、加齢に伴ってすり減ったり、スポーツや交通事故などの怪我により損傷をうけると、硝子軟骨が線維軟骨注4に変性してしまうことがあります。一度、軟骨が線維化すると、元に戻ることはなく、関節をスムーズに動かすことが難しくなり、痛みや炎症が起こることもあります。治療法のひとつとして、自家軟骨細胞移植術という軟骨細胞を損傷部に移植する方法がとられ良好な成績をおさめていますが、高品質で十分な量の軟骨細胞を用意することが難しいという課題があります。加えて、軟骨細胞を患部に移植するためには、自己の健康な軟骨細胞を生検にて採取する必要があります。移植する前に、生検で得た軟骨細胞を培養シャーレ上で数を増やしますが、軟骨細胞は培養して増やすと線維芽細胞様に変質します。それを移植すると修復組織には線維軟骨が出来てしまい、きれいな硝子軟骨で治りにくいという問題もあります。これらの諸問題を克服し、高品質で十分量の軟骨細胞を確保するため、妻木教授らは、患者さんの細胞からヒトiPS細胞を作製し、これを増やしてから良質な軟骨細胞を作製し、さらに硝子軟骨を作る研究をすすめてきました。
これまでに、ヒトiPS細胞から軟骨細胞を分化誘導する培養方法についてはいくつも報告されていますが、硝子軟骨は作られておらず、移植後の腫瘍形成リスクも調べられていません。そこで、本研究ではヒトiPS細胞から分化誘導した軟骨細胞に(1)生体内で純粋な硝子軟骨を作る能力があること、(2)生体内の軟骨欠損に移植した組織が欠損部を支えること、(3)動物に移植した時に腫瘍を作らないことの確認を目標に研究を進めました。
3.研究結果
1) レポーター(EGFP)遺伝子を利用した硝子軟骨誘導法の検討
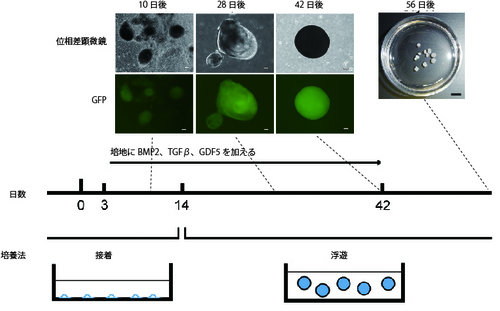
健康な関節軟骨を構成する硝子軟骨は細胞の周辺に、主にII型コラーゲンとXI型コラーゲンを生み出してマトリックスを作る特徴があります。このうち、XI型コラーゲン遺伝子にEGFP遺伝子注5をつなげたものを、ヒトiPS細胞に導入し、軟骨細胞になった時のみ蛍光を発することのできるヒトiPS細胞株を作製しました。この細胞株を利用し、軟骨へ分化させるには培養液に3種のタンパク質(BMP2、TGFβ1、GDF5)を含める必要があることを見つけました。また、分化開始14日後から浮遊培養注6を行うことで細胞自身に細胞外マトリックスを作らせて、足場材を使わずに軟骨組織塊を作り出すことにも成功しました(図1)。この方法では、3.5cmのディッシュ1つあたりに対し、約15個の軟骨組織塊ができ、1個の軟骨組織塊は約7万個の軟骨細胞を含みます。ヒトへの移植を念頭に置くと、1症例当たり30−150個の軟骨組織塊が必要で、これは3.5cmのディッシュ2−10枚分となり、実用的な規模です。
図1 ヒトiPS細胞から硝子軟骨組織を誘導するための培養方法ヒトiPS細胞から軟骨細胞へ向けて分化誘導を始めてから3日後に3種のタンパク質(BMP2、TGFβ、GDF5)を加えた培地で接着培養を行った。14日後からは、浮遊培養を行った。日数が進むにつれ、GFPにより緑色蛍光を発する細胞(軟骨細胞であることを示す)が増えてくる(上部の組み写真:スケールバー50μm)。56日後には1-2 mmの大きさの軟骨組織塊が3.5cmディッシュ内にみられる(右上写真:スケールバー5mm)。
2)マウスへ移植した軟骨組織塊の品質と安全性の確認
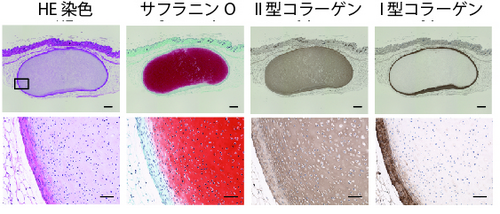
生体内で軟骨を生じる能力を測るため、ヒトiPS細胞から作製した軟骨組織塊を免疫不全マウスの皮下に移植し、良質な硝子軟骨が作り出されるかどうかを確認しました。結果、品質の悪い線維軟骨の主成分であるI型コラーゲンを作り出すことなく、硝子軟骨の主成分であるII型コラーゲンのみを作り出していることを確認できました(図2)。また、少なくとも3ヶ月間は腫瘍や転移がみられませんでした。
図2 マウス皮下に移植した軟骨組織塊の品質確認免疫不全マウスの皮下に42日間培養した軟骨組織塊を移植し、3ヶ月後にその組織切片を顕微鏡で観察した。サフラニンOに強く染まる組織が出来ていた。この組織は、II型コラーゲンを発現するが、I型コラーゲンを発現せず、硝子軟骨に相当すると考えた。上段の四角で囲った部分の拡大を下段に示す。下段では細胞外マトリックスの中に細胞が散在している様子がわかる。HE染色:組織の形態を観察できる。サフラニンO:硝子軟骨が染まる。II型コラーゲン:硝子軟骨に多く含まれる。茶色に染まっている部分。I型コラーゲン:関節軟骨としては質の悪い線維軟骨に多く含まれる。スケールバー:500μm
3)ラットへ移植した軟骨組織塊の生着と生体内軟骨との融合能の確認
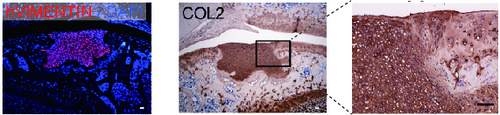
関節軟骨を損傷させた免疫不全ラットの患部に、ヒトiPS細胞から作製した軟骨組織塊を移植したところ、1ヶ月後も移植塊が生着し、隣接する生体内の軟骨と癒合を始めていることが分かりました。また、3ヶ月間は腫瘍や転移がみられませんでした。
図3 ラットの関節移植した軟骨組織塊の品質確認関節を損傷させた免疫不全ラットに培養開始後28日の軟骨組織塊を移植し、4週間後に関節部位の組織切片を顕微鏡にて観察した。左の写真は、移植したヒトiPS細胞由来組織が生着していることを示している。中央、右の写真では、硝子軟骨に多く含まれるII型コラーゲンが茶色に染まっている。
4)ミニブタへ移植した軟骨組織塊の生着と生体内軟骨との融合能の確認
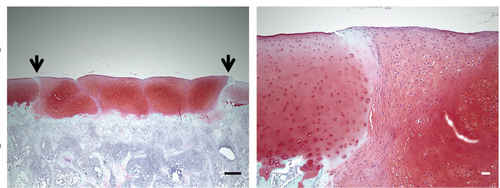
ヒトへの移植治療法開発を念頭においた場合、移植された軟骨の品質を明らかにするには、マウスやラットでは体重が軽すぎるため、より関節に荷重がかかる大型動物で確かめる必要があります。そこで、ヒトiPS細胞から作製した軟骨組織塊を、事前に免疫抑制剤を投与したミニブタ(体重 30kg弱)の関節損傷部位へ移植しました。結果、移植後1ヶ月の時点で、移植した軟骨組織塊が患部に生着して体重を支え、近接する軟骨組織と融合しうる能力があることも確かめることができました。
図4 ミニブタの関節に移植した軟骨組織塊の生着を確認
関節を損傷させたミニブタ(免疫抑制剤を投与)に軟骨組織塊を移植し、1ヶ月後に関節組織を顕微鏡にて観察した。矢印は生体内の軟骨と移植した軟骨組織塊との境界。スケールバー:左500μm、右50μm
4.まとめ
本研究成果は、ヒトiPS細胞から軟骨細胞への新たな分化方法を確立し、その軟骨細胞から純粋な硝子軟骨が生体内で生じることを明らかにしました。また、腫瘍を形成すること無しに、関節軟骨の欠損を補うことに成功しました。iPS細胞を用いた関節軟骨損傷の治療法開発へ向けた研究の重要な一歩ではあります。但しこれは、研究用の試薬を使って研究室で行った結果です。今後、ヒトに使えるグレードの高い安全な試薬を用い、臨床用の細胞調整室で行っても、硝子軟骨を誘導できるように分化方法の微調整を行います。そして、動物実験等を通して、安全性と有効性の確認を十分に行う必要があります。
5.論文名と著者名
○ 論文名
○ ジャーナル名
Stem Cell Reports
○ 著者
Akihiro Yamashita1, Miho Morioka1, Yasuhito Yahara1, Minoru Okada1, Tomohito Kobayashi1,2, Shinichi Kuriyama2, Shuichi Matsuda2 and Noriyuki Tsumaki1,3
○ 著者の所属機関
1. 京都大学iPS細胞研究所(CiRA)
2. 京都大学医学研究科整形外科学
3. JST戦略的創造研究推進事業 CREST
6.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
科学技術振興機構 再生医療実現拠点ネットワークプログラム
文部科学省 科学研究費補助金「研究活動スタート支援」「若手研究(B)」「基盤研究B」
内閣府 最先端研究開発支援プログラム(FIRSTプログラム)
7.用語説明
注1) 足場材
細胞を培養する際に、細胞外マトリックス(細胞と細胞の間を埋めるように存在するタンパク質複合体)を模す目的で使用されるゲルや多孔体などの材料のこと。軟骨細胞の場合、移植後に足場材は吸収されて生体の細胞外マトリックスに置換されることが望ましい。足場材を用いて軟骨組織を培養した場合、残存する足場材が炎症を起こす、正常マトリックスの形成を阻害するなどの課題がある。
注2) 軟骨組織
軟骨細胞と軟骨細胞外マトリックスで構成される組織。軟骨細胞は周囲に細胞外マトリックスを作り、その中に埋もれる。体重を支え、滑らかな関節運動を担うのは、軟骨細胞外マトリックスの機能である。軟骨細胞外マトリックスはコラーゲン細線維とプロテオグリカンで構成される。
注3) 硝子軟骨
正常な関節軟骨は硝子軟骨と呼ばれ、その細胞外マトリックスのコラーゲン細線維はII型コラーゲンとXI型コラーゲンで出来ている。皮膚や瘢痕組織などの線維性組織に含まれるI型コラーゲンは、硝子軟骨には存在しない。硝子軟骨は無血管組織で、治癒能に乏しい。硝子軟骨は一旦損傷を受けると元の硝子軟骨では治らず、線維軟骨に変わってしまうことが多い。
注4) 線維軟骨
正常な硝子軟骨が損傷を受けると、元の硝子軟骨では治らず、損傷部は線維性の組織を含んだ線維軟骨で埋まる。線維軟骨の細胞外マトリックスはI型コラーゲンを含む。線維軟骨は硝子軟骨に比べて機能的に劣り、やがて失われる。自家軟骨細胞移植術で作られる修復組織には線維軟骨が含まれる。
注5) EGFP遺伝子
Enhanced Green Fluorescence Protein(改良緑色蛍光タンパク質)の略。オワンクラゲ由来の緑色蛍光タンパク質(GFP)を強く蛍光を発するように改良したもの。緑色蛍光タンパク質は、生きた細胞内で目的タンパク質の発現を検知するのに使用される。目的のタンパク質が発現すると、共に緑色蛍光タンパク質が生み出されるため、蛍光色で遺伝子の発現を確認できる。
注6)浮遊培養
ディッシュ内で細胞が液体に浮かんだ状態に保つ培養方法。三次元培養の一つである。軟骨細胞を浮遊培養することにより、軟骨細胞が軟骨細胞外マトリックスを産生して軟骨組織を作り上げる。