
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2014年9月18日
スタチンが軟骨無形成症の病態を回復 ~疾患特異的iPS細胞モデルによるドラッグ・リポジショニングの可能性~
山下晃弘 研究員、妻木範行 教授(京都大学CiRA増殖分化機構研究部門)らの研究グループは、澤井英明 准教授 (兵庫医科大学 産科婦人科学)、池川志郎 チームリーダー(理化学研究所 統合生命医科学研究センター 骨関節疾患研究チーム)らのグループとともに、線維芽細胞増殖因子受容体3型(FGFR3)注4遺伝子変異による骨系統疾患注5の疾患特異的iPS細胞モデルおよび疾患マウスモデルにおいて、高コレステロール血症治療薬であるスタチンに骨の成長を回復させる効果があることを見出しました。
この研究成果は2014年9月17日18時(英国時間)に「Nature」のオンライン版で公開されました。
ポイント
・軟骨無形成症注1およびタナトフォリック骨異形成症注2の患者さん由来iPS細胞(疾患特異的iPS細胞)を樹立し、軟骨細胞に分化誘導したところ、細胞増殖が低下し、疾患の特徴を反映した異常な軟骨形成が見られた。
・スタチン注3を投与することで、疾患特異的iPS細胞から分化誘導した軟骨細胞の細胞増殖と軟骨形成が回復した。
・スタチンは軟骨無形成症モデルマウスにおいて骨を伸長させた。
・疾患特異的iPS細胞モデルと疾患マウスモデルの結果を併せて、高コレステロール血症治療薬であるスタチンが本疾患に有効である可能性が示された。
※現在市販されているスタチンを内服することは、病態回復効果が期待できないだけでなく副作用の危険性も高いので絶対にしてはいけない。
1.要旨
骨系統疾患の一つである軟骨無形成症(achondroplasia、ACHと略)とタナトフォリック骨異形成症(thanatophoric dysplasia、TDと略)はFGFR3の遺伝子変異で起こり、成長軟骨の異常により低身長と呼吸障害を示す、現在は有効な治療薬がない疾患です。妻木教授らのグループは、患者さんのiPS細胞から軟骨細胞を分化誘導して軟骨組織を形成し、iPS細胞による骨系統疾患モデルを構築しました。また、この疾患特異的iPS細胞モデルを用いて、スタチンがACHおよびTDの治療に有効である可能性を示しました。ただし、実際の治療へ応用されるまでには、用量や副作用など安全性・有効性について詳細な検討が必要です。
2.研究の背景
骨や軟骨が適正に形成されないために低身長を示す骨系統疾患の一つに、軟骨無形成症(ACH)およびタナトフォリック骨異形成症(TD)があります。TDは骨の変形のパターンによりI型とII型に分類され、生下時に呼吸不全の症状を示します。ACH、TDともにFGFR3遺伝子に変異が生じ、FGFR3シグナルが大量に細胞内に取り込まれます(機能獲得性変異)。その機序として、変異によりFGFR3タンパクが分解抵抗性となり、過剰のFGFR3タンパクが存在することが考えられています。過剰なFGFR3シグナルにより軟骨細胞の増殖および分化が抑制されるため、治療の狙いは過剰なFGFR3シグナルを抑制することです。既にACHならびにTDの遺伝子改変マウスモデルで、C型ナトリウム利尿ペプチド(CNP)を初めとするいくつかの化合物の投与によって、骨の成長が回復することが示されていますが、その先の開発に必要なヒトの適切な細胞モデルはありませんでした。そこで妻木教授らのグループは、患者さん由来の疾患特異的iPS細胞を用いて新たな疾患モデルを作製し、モデルの有用性を検証しました。
3.研究結果
1) タナトフォリック骨異形成症患者さん由来のiPS細胞より分化誘導した軟骨は異常形成を示した
タナトフォリック骨異形成症I型(TD1)の患者さんの皮膚の線維芽細胞からiPS細胞株を樹立し、軟骨細胞に分化誘導させ、健康な方から作製したiPS細胞(正常)株と比較しました。その結果、正常iPS細胞株では軟骨組織の構造体である細胞外マトリックス注6が形成されているのに対し、TD1-iPS細胞株(Fig. 1)からは細胞外マトリックスが作られず、軟骨の形成に異常が見られました。TD1-iPS細胞株における軟骨誘導マーカー(Sox9:軟骨転写因子、COL2A1, ACAN:軟骨細胞外マトリックス成分)の発現については、分化誘導開始後14~21日までは正常株と同程度の発現を示しましたが、28日では低下していました。このことより、初期の段階までは軟骨細胞が正常株と同様に誘導されて、その後抑制されることが分かりました。また、誘導28日後では、増殖細胞数も減少していました(Fig. 2)。
また、TD1-iPS細胞でFGFR3遺伝子をノックダウン注7したところ、FGFR3発現量が減少し、軟骨の誘導が回復することから、今回使用したTD1-iPS細胞が疾患軟骨分化誘導モデルとして有用であることが確認できました。
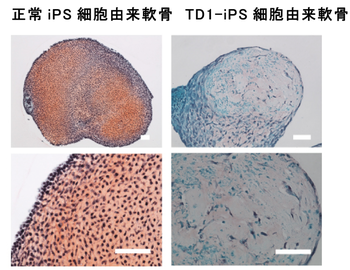
軟骨組織の構造体である細胞外マトリックスは赤色に染色される。
誘導42日後、TD1-iPS細胞株では軟骨の形成に異常が見られた。
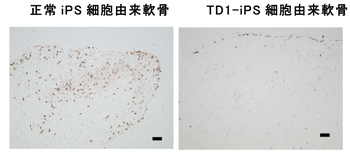
Fig. 2 タナトフォリック骨異形成症(TD1)特異的iPS細胞由来軟骨細胞の増殖性
増殖細胞は褐色に染色される。TD1-iPS細胞株では、正常株と比較し、
増殖細胞数が減少していた。(誘導28日後)
2) スタチンにより軟骨無形成症およびタナトフォリック骨異形成症患者さん由来のiPS細胞は軟骨形成能を回復した
TD1-iPS細胞から軟骨細胞へと誘導する時にスタチンの一種であるロバスタチンを投与すると、異常の見られていた細胞外マトリックスの形成が回復しました(Fig. 3左)。また、誘導後に増殖細胞も増加していることが分かりました。加えて、その他のスタチン類である、メバスタチン、アトルバスタチン、プラバスタチン、ロスバスタチン、フルバスタチンにおいても、TD1-iPS細胞の軟骨形成を回復させる効果があることを確認しました。
また、ACH-iPS細胞においても、ロバスタチンで軟骨形成を回復させる、同様の効果が確認されました(Fig. 3右)。
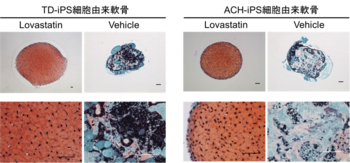
Fig. 3 タナトフォリック骨異形成症(TD1)および軟骨無形成症(ACH)疾患特異的iPS細胞の軟骨誘導に対するスタチンの影響
軟骨組織の構造体である細胞外マトリックスは赤色に染色される。ロバスタチンの投与により、TD1-iPS細胞株ならびにACH-iPS細胞株は軟骨組織を作った。(誘導28日後)
3) スタチンにより軟骨無形成症マウスモデルにおいて骨の伸長が見られた
体長や手足の短縮が見られる軟骨無形成症(ACH)モデルマウスにおいて、生後3日から生後2週間までの間、ロスバスタチンの腹腔内投与を毎日行うことによって、頭蓋骨の前後、前腕部、太ももの部分、すねの部分の骨の長さを測定したところ、正常のマウスと同程度に成長していることがわかりました(Fig. 4)。また、スタチン投与により、体重の増加についても、正常のマウスと同程度の成長が見られました。

| Fig. 4 軟骨無形成症(ACH)モデルマウスにおけるスタチン投与による効果 ロスバスタチンの腹腔内投与により、ACHモデルマウスの骨の長さが伸長した。(生後15日) |
4.まとめ
軟骨無形成症(ACH)およびタナトフォリック骨異形成症(TD1)の患者さん由来iPS細胞を樹立し、軟骨に分化誘導させ、疾患モデルを構築しました。
この疾患特異的iPS細胞モデルで見られた軟骨細胞増殖と軟骨組織形成の異常は、スタチンを投与することで回復しました。また、iPS細胞疾患モデルに加え、ACHモデルマウスにスタチンを投与することにより、軟骨の形成が回復することから、スタチンがFGFR3遺伝子変異で起こるこれら疾患の治療に有効である可能性が示されました。
スタチンは高コレステロール血症治療薬として既に臨床で使用されており、安全性や体内動態が臨床レベルで確認されていることから、通常の医薬品開発と比較すると時間とコストを削減して早く安く安全な薬を提供できる、ドラッグ・リポジショニング注8の可能性があります。ただし、実際の治療への応用までには、成人の心疾患や脳梗塞の治療・予防として使用されているスタチンを作用機序の異なる小児の疾患に使用できるのか、用量や副作用など安全性・有効性について詳細な検討が必要です。
※ACHやTD1の患者さんがスタチンを内服する(口から飲む)と、多くのスタチンが肝臓で分解されて、本来効果を期待している軟骨まで充分な量が届かないことが考えられます。また肝臓に作用して必要以上にコレステロールを下げてしまう危険性もあります。安全な使用法が確立されるまで、絶対に内服しないで下さい。
5.論文名と著者
○論文名
"Statin treatment rescues FGFR3 skeletal dysplasia phenotypes"
○ジャーナル名
Nature
○著者
Akihiro Yamashita1, Miho Morioka1, Hiromi Kishi1, Takeshi Kimura1,2, Yasuhito Yahara1,
Minoru Okada1, Kaori Fujita1, Hideaki Sawai3, Shiro Ikegawa4 and Noriyuki Tsumaki1,5.
○著者の所属機関
1) 京都大学iPS細胞研究所
2) 大阪大学
3) 兵庫医科大学
4) 理化学研究所 統合生命医科学研究センター
5) JST CREST
6.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
・科学技術振興機構 戦略的創造研究推進事業 CREST注9
・科学技術振興機構 再生医療実現拠点ネットワークプログラム 疾患・組織別実用化研究拠点(拠点B)注10
・科学技術振興機構 再生医療実現拠点ネットワークプログラム 疾患特異的iPS細胞を活用した難病研究注11
・文部科学省 科学研究費補助金 「研究活動スタート支援」「若手研究(B)」「基盤研究(B)」
7.用語説明
注1) 軟骨無形成症(achondroplasia)
低身長を示す骨系統疾患の中で最も頻度が多い疾患。FGFR3の活性型変異により、軟骨細胞の増殖・分化が抑制される。
注2) タナトフォリック骨異形成症(thanatophoric dysplasia)
FGFR3の活性型変異による骨系統疾患のうち、肋骨などが正常に形成されず呼吸障害などを示す、重症度の高い疾患。
注3) スタチン
コレステロール生合成を調節する酵素であるヒドロキシメチルグルタリルCo-A(HMG-CoA)還元酵素を阻害し、血液中のコレステロール値を低下させる薬物の総称。1970年代に日本の遠藤章博士らによってメバスタチンが発見されて以来、その同族体として、様々な種類のスタチンが開発された。現在では、世界中で毎日およそ4000万人に服用され、血管の内側に付着した余分なコレステロールにより引き起こされる動脈硬化に起因する心疾患や脳梗塞の治療と予防に役立っている。その一方で、それ以外にもスタチンには種々の細胞や組織に様々な働きをする多面的作用があることが知られている。
注4) FGFR3 (fibroblast growth factor receptor 3)
線維芽細胞増殖因子受容体3型。線維芽細胞増殖因子受容体(FGFR)にはFGFR1~FGFR4の4種類が存在する。FGFR3を介するシグナルは,軟骨細胞の増殖および分化を抑制することが明らかとなっている。
注5) 骨系統疾患
軟骨・骨の発生・成長の異常により全身の骨格の形態や構造に系統的な異常をきたす疾患で、その多くは遺伝子変異によるものとされている。骨系統疾患の中で、線維芽細胞増殖因子受容体3型(FGFR3)の遺伝子変異が原因で起こる疾患群はFGFR3軟骨形成異常症と呼ばれ、軟骨無形成症やタナトフォリック骨異形成症を含む。
注6) 細胞外マトリックス
細胞間の隙間を埋める生体高分子(コラーゲンやプロテオグリカンなど)の集合体。骨・軟骨、歯、皮膚などに多く含まれ、組織を支えてメカニカル(クッション・伸び縮みなど)な機能を果たしている。
注7) ノックダウン
人為的に標的遺伝子の発現レベルを抑制すること。この論文ではFGFR3のshRNA (short hairpin RNA:短鎖のヘアピン型RNA)を導入することにより、FGFR3のmRNAの発現が抑制される。
注8) ドラッグ・リポジショニング
既存の医薬品や開発を中止した候補化合物より新しい薬理作用を見出し、新たな疾患治療薬として開発すること。
注9) 科学技術振興機構 戦略的創造研究推進事業 チーム型研究 (CREST)
研究領域 「人工多能性幹細胞(iPS細胞)作製・制御等の医療基盤技術」
(研究統括:須田 年生 慶應義塾大学 医学部 教授)
研究課題名 「組織幹細胞/前駆細胞を誘導するディレクテッドリプログラミング技術の開発」
研究代表者 妻木 範行 (京都大学iPS細胞研究所 教授)
研究期間 平成21年10月~27年3月
注10) 科学技術振興機構 再生医療実現拠点ネットワークプログラム 疾患・組織別実用化研究拠点(拠点B)
拠点名 iPS細胞由来軟骨細胞を用いた軟骨疾患再生治療法の開発拠点
研究代表者 妻木 範行 (京都大学iPS細胞研究所 教授)
研究期間 平成25年7月~35年3月
注11) 科学技術振興機構再生医療実現拠点ネットワークプログラム 疾患特異的iPS細胞を活用した難病研究
拠点名 疾患特異的iPS細胞を活用した筋骨格系難病研究
研究代表者 戸口田 淳也 (京都大学再生医科学研究所/iPS細胞研究所 教授/副所長)
研究期間 平成25年1月~30年3月






















