研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2019年7月1日
ヒトiPS細胞から骨格筋細胞を作製し、既存薬の中から筋ジストロフィー病態改善効果を期待できる化合物を見出すことに成功
ポイント
- ジスフェルリン異常症は希少難治性の筋ジストロフィーで、筋肉の細胞膜が損傷した時に引き起こされる『膜修復』という機能が弱く、日常生活の中で徐々に骨格筋細胞へのダメージが蓄積し、四肢の筋肉が動かなくなる患者さんが多いためQOL注1)が低下する疾患である。
- ジスフェルリン異常症患者さんの中でも、日本で最も多いW999Cのミスセンス変異注2)タイプの患者さんからiPS細胞を作製し、治療薬開発に向けた研究を行なった。
- 患者さん由来iPS細胞に骨格筋特異的転写因子(MyoD1)を強制発現注3)させて骨格筋細胞を分化誘導させるシステムを用いて、CiRAと武田薬品工業株式会社の共同研究プログラムであるT-CiRA注4)において薬剤スクリーニング注5)を行い、既存薬ライブラリー注6)から抗がん剤であるノコダゾール注7)を見出した。
- ノコダゾールが患者さんのiPS細胞由来骨格筋細胞において膜修復機能を保持したジスフェルリンのタンパク質量を増加させることを発見し、更にノコダゾールによって患者さん由来の細胞の膜修復機能が回復することを見出した。
國分優子研究員(CiRA臨床応用研究部門、T-CiRA櫻井PJ)、薙野智子研究員(武田薬品工業株式会社、T-CiRA櫻井PJ)、櫻井英俊准教授(CiRA臨床応用研究部門、T-CiRA櫻井PJ)らの研究グループは、ジスフェルリン異常症の患者さん由来のiPS細胞から作製した骨格筋細胞を用いて薬剤スクリーニングを実施した結果、ジスフェルリンのタンパク質量を増加させる化合物として既存薬ライブラリーからノコダゾールという抗がん剤を見出すことに初めて成功しました。
この研究成果は2019年6月28日に米国科学誌「STEM CELLS Translational Medicine」にオンライン公開されました。
ジスフェルリン異常症は、ジスフェルリンという遺伝子の変異によって引き起こされる希少難治性の筋ジストロフィーであり、日本では約200人の患者さんが診断されていますが、これまでのところ治療薬は存在していません。この疾患では筋肉の細胞膜が損傷した時に引き起こされる『膜修復』という機能がジスフェルリン変異の結果として弱くなっているため、日常生活の中で徐々に筋肉細胞へのダメージが蓄積して筋力が低下し、最終的に四肢が動かなくなる患者さんが多く、QOLの低下が問題となっています。
ジスフェルリン異常症のうちで今回研究対象としたのは、日本で最も多いW999Cミスセンス変異と呼ばれる変異を有している患者さんの細胞です。この変異を有するジスフェルリンは、細胞内でタンパク質の折りたたみが正常になされず異常な構造のタンパク質が合成されてしまいます。この異常なジスフェルリンタンパク質はまだ膜修復機能を有していると考えられていますが、構造異常により細胞内の監視機能によって積極的に分解されるため、結果として膜の修復機能に異常をきたすことが明らかとなっています。櫻井研究室ではこれまで、ジスフェルリン異常症患者さん由来のiPS細胞を作製し、それを骨格筋細胞へと分化誘導させてジスフェルリン異常症の膜修復異常という病態を細胞レベルで再現することに2013年(Tanaka. et.al, Plos One 8(4):e61540)に成功しています。
今回は、治療薬開発を行うプロジェクトの一環として、ジスフェルリン異常症ミスセンス変異患者さんのiPS細胞由来骨格筋細胞を用いて、まず初めに既存薬ライブラリーを使って既に別の疾患の治療薬として販売されている薬剤でジスフェルリン異常症の治療が可能かを検証しました。
1. 評価系の構築
まず、ジスフェルリン異常症患者さんと健常人からiPS細胞を作製し、骨格筋特異的転写因子(MyoD1)の強制発現により骨格筋細胞を分化誘導させるシステムを構築しました(図1)。次に、多量のサンプル処理のため384ウェルプレートを用いて安定的な評価系を構築しました(図2)。
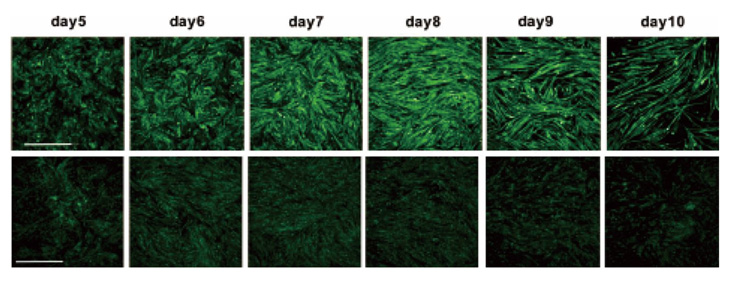
図1:健常人(上)と患者さん(下)iPS細胞由来骨格筋細胞の分化過程。
緑:ジスフェルリンの免疫染色像。この染色結果から、day7,day8が最も分化レベルが良好なため、day7で化合物添加、day8で薬効評価の実施を決定した。
スケールバー:500μm
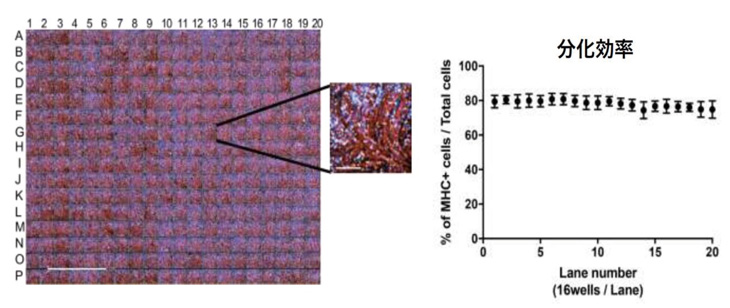
図2(左):384ウェルプレートを用いたスクリーニング系構築。
(全てのウェルで等しく骨格筋細胞を分化できている。)
赤:骨格筋マーカーMyosin Heavy Chainの免疫染色像。
青:核。
(右):全ウェルでの分化効率の安定性(約80%)を示す。
2. スクリーニングでノコダゾールをヒット化合物として同定。
さらに、構築した評価系を用いて、T-CiRA共同研究プログラムにおいて薬剤スクリーニングを実施した結果、ノコダゾールという化合物がジスフェルリンのタンパク質を濃度依存的に増加させることを発見しました(図3)。
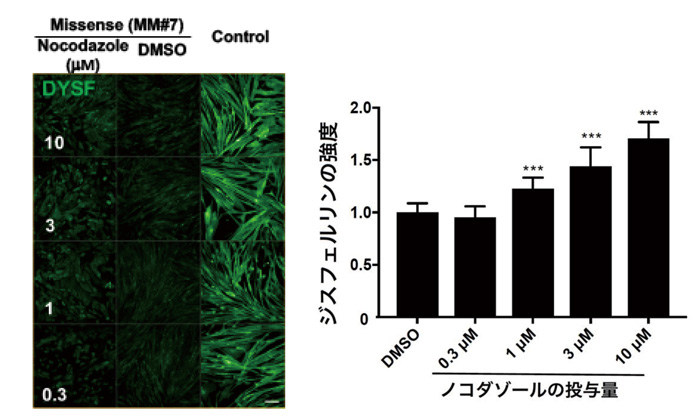
図3(左):ジスフェルリンの免疫染色像。
一番左:患者さんの細胞ではノコダゾールの濃度依存的にジスフェルリンが上昇している。
真ん中(DMSO:ネガティブコントロール)や一番右(Control:健常人細胞)ではその効果は観察されない。
(右):左の免疫染色像の強度をグラフ化したもの。
3. ノコダゾールの膜修復回復効果を検証。
次に、ノコダゾールによる膜修復回復効果の有無を検証するために、共焦点顕微鏡のレーザーを患者さんのiPS細胞由来骨格筋細胞の細胞膜に照射し、膜を損傷させてその修復過程を確認したところ、ノコダゾール添加群において膜修復機能の改善が観察されました(図4)。この結果から、ノコダゾールは細胞内のジスフェルリンタンパク質量を上昇させ、結果として膜修復機能の回復を引き起こすと考えられます。
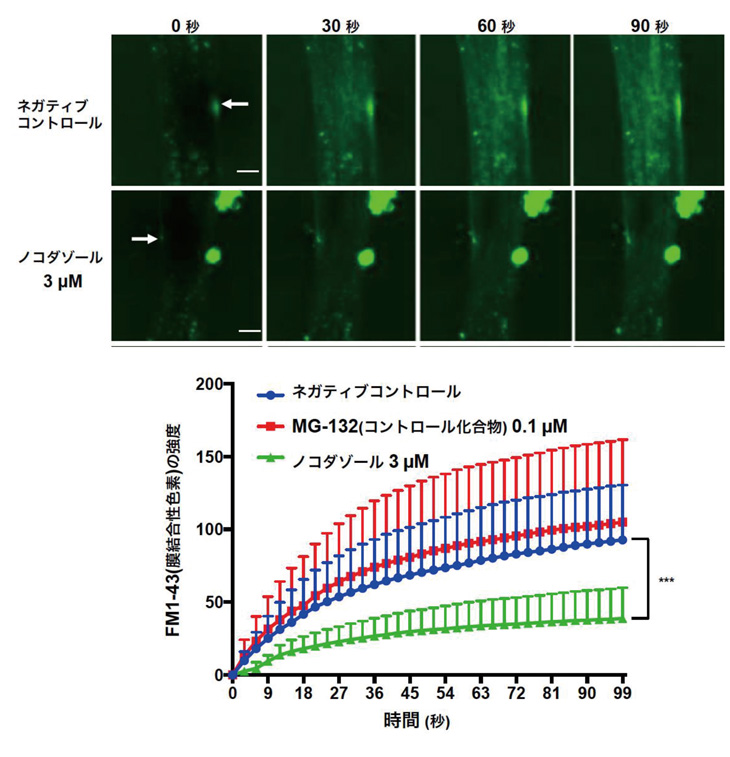
図4(上):レーザー顕微鏡による膜修復実験像。
緑:FM1-43という膜結合性の色素。培地に事前添加することにより、細胞膜に開いた穴から細胞内に入りこむ。FMの蛍光強度で膜修復機能を検証した。矢印:レーザー照射部位。
(下):上の画像をグラフ化したもの。
MG-132はコントロール化合物。ノコダゾール(緑)処理群は細胞膜に開いた穴がDMSO(青)処理群より早く閉じるので、FMの細胞内蛍光強度が低く保たれている。
4. ノコダゾールの膜修復回復効果に関するメカニズムを解析
最後に、ノコダゾールによる膜修復機能回復効果のメカニズムを解析するために、患者さんiPS細胞由来骨格筋細胞を用いてウェスタンブロッティング注8)を実施しました。その結果、ノコダゾールとコルヒチン添加サンプルにおいてジスフェルリンの蛋白質量の上昇が観察されました(コルヒチンは痛風の治療薬で、ノコダゾールと同様な作用、パクリタキセルは抗がん剤で、ノコダゾールと逆の作用を有しています。)それに加えて、オートファジー(自食作用)に関連する因子であるp62とLC3 II(LC3II/Iで評価)の上昇が観察されました(図5)。
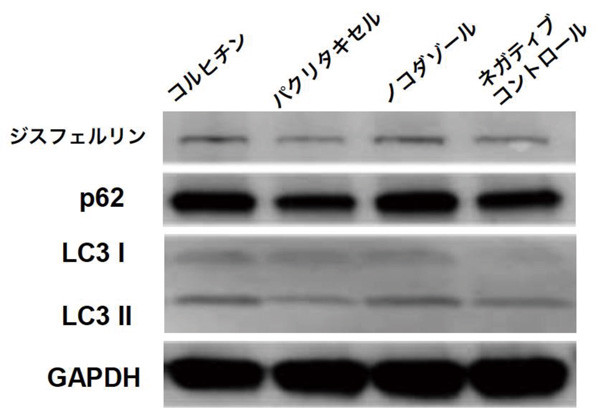
図5:患者さんiPS細胞由来骨格筋細胞を用いたウェスタンブロッティングによるジスフェルリン、p62,LC3 I, IIとGAPDH(内在性コントロール)の発現量の確認。
オートファジーによる分解経路に着目すると、細胞内の異常なタンパク質は通常の場合ユビキチンやp62によって標識され、微小管に沿って移動した後にオートファゴソームという膜の中に収納されます。
この時に、LC3 のタイプIがタイプIIへと変換されてオートファゴソームの膜に結合します。その後、ライソゾームという分解酵素を含んだ小胞とオートファゴソームが結合し、オートリソソームと呼ばれる構造をとり、内部の異常タンパク質が最終的に分解されます(図6上段)。図5の結果であるp62の蓄積とLC3IIの増加は、オートファジー経路の破綻を意味しています(図6下段)
今回の研究では、ノコダゾールが微小管の重合を阻害するため、ノコダゾール処理により構造異常を有するジスフェルリンの細胞内移動が妨げられて、ジスフェルリンがオートファジーにより分解されず、結果として細胞内に蓄積して膜修復機能が回復したと考えられます。
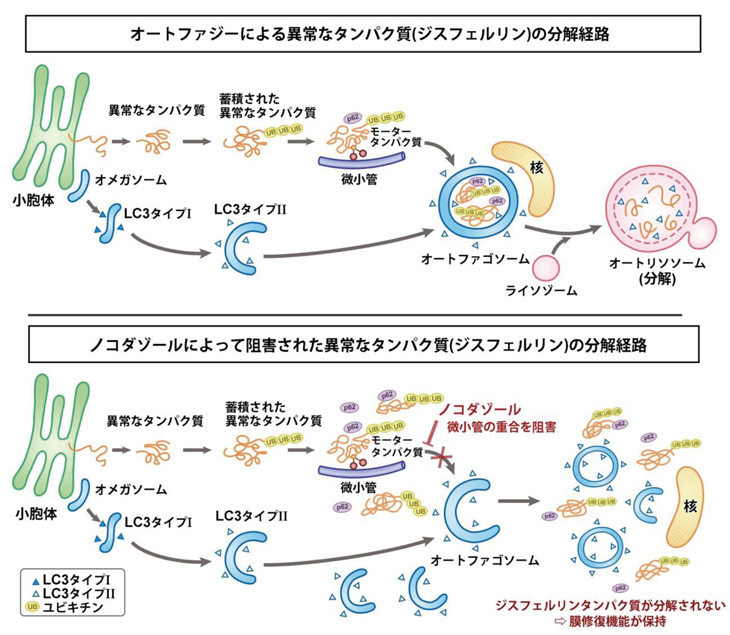
図6:異常なタンパク質(ジスフェルリン)の分解経路
上段:オートファジーによる分解経路
下段:ノコダゾールによって阻害された場合
本研究では、ジスフェルリン異常症のミスセンス変異タイプの患者さんのiPS細胞由来骨格筋細胞を用いて384ウェルプレートでの安定したハイスループットスクリーング注9)系を構築しました。このスクリーニング系を用いて、既存薬であるノコダゾールが微小管の重合を阻害し、オートファジーによるタンパク質分解を抑制することで細胞内のジスフェルリンのタンパク質量を増加させることを初めて明らかにしました。
また、ジスフェルリンのタンパク質が細胞内に蓄積した結果、膜修復機能が回復することが細胞レベルで明らかとなりました。
ノコダゾール自体は抗がん剤のため、長期間の投薬が必要となるジスフェルリン異常症患者さんにとっては細胞毒性が強く使用は難しいと考えられますが、今回の研究で見出された分解経路をターゲットとしてさらに研究を進めることによって、今後ジスフェルリン異常症に有効な治療薬を見出すことにつながると期待されます。また患者さん由来のiPS細胞を用いた骨格筋細胞によるスクリーニングで、有効な化合物が同定出来る事が証明され、他の筋疾患への応用も発展させていきたいと考えています。
- 論文名
Phenotypic drug screening for dysferlinopathy using patient derived-induced pluripotent stem cells - ジャーナル名
STEM CELLS Translational Medicine - 著者
Yuko Kokubu1,3, Tomoko Nagino2,3, Katsunori Sasa2,3, Tatsuo Oikawa2,3, Katsuya Miyake4, Akiko Kume2,3, Mikiko Fukuda1,3, Hiromitsu Fuse2,3, Ryuichi Tozawa2,3, Hidetoshi Sakurai1,3 - 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 武田薬品工業株式会社 T-CiRA Discovery
- T-CiRA共同研究プログラム
- 国際医療福祉大学
本研究は、下記機関より資金的支援を受けて実施されました。
-
国立研究開発法人 日本医療研究開発機構 再生医療実現拠点ネットワークプログラム
疾患特異的iPS細胞を活用した難病研究「疾患特異的iPS細胞を活用した筋骨格系難病研究」
疾患特異的iPS細胞の利活用促進・難病研究加速プログラム 「筋疾患に対する治療薬の創出を目指した研究」 - 武田薬品工業株式会社「T-CiRA共同研究プログラム」
注1)QOL
Quality of Lifeの略。日本語では、「生活の質」を意味する。
注2)ミスセンス変異
遺伝子の塩基配列が1個だけ変化することで、対応して翻訳されるアミノ酸が変化してしまうため、タンパク質としては合成されるがアミノ酸配列に変異を来してしまうタイプの遺伝子異常のこと。
今回の症例ではジスフェルリンタンパク質において、正常型では999番目のアミノ酸はトリプトファン(W)というアミノ酸が並んでいるはずだが、患者さんではシステイン(C)に変化しているため、タンパク質の立体構造が変化し、分解されやすくなる。
注3)骨格筋特異的転写因子(MyoD1)の強制発現系
骨格筋特異的転写因子MyoD1をテトラサイクリン誘導性promoter下に導入したシステムを用い、抗生物質であるドキシサイクリンを添加することにより
強制的にMyoD1遺伝子を発現させるシステム。これにより、iPS細胞から約1週間で骨格筋細胞を作製することができる。
注4)T-CiRA
京都大学と武田薬品工業株式会社との共同研究プログラム。櫻井研究室はT-CiRA櫻井PJとして骨格筋疾患である筋ジストロフィー治療のための研究を実施している。
注5)薬剤スクリーニング
数多くの候補化合物の中から、目的の活性をもつ候補分子を探索すること。
注6)既存薬ライブラリー
既に市販薬として発売されている化合物群。
注7)ノコダゾール
抗がん剤として臨床でも用いられている化合物。微小管の重合を阻害することにより有糸分裂を阻害し、細胞増殖を抑制してがん細胞を攻撃する。
細胞毒性が強いため長期間投与が必要なジスフェルリン異常症への使用は難しい。
注8)ウェスタンブロッティング
タンパク質の混合試料から特定のタンパク質を検出する手法。細胞から抽出したタンパク質試料を電気泳動で分離し、検出したいタンパク質に対する特異的な抗体を用いて抗原抗体反応の原理で、目的のタンパク質を定量する事ができる。
注9)ハイスループットスクリーニング
ロボットを使用し可能な限り自動化して大量の化合物スクリーニングを一度に実施する方法。