研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2019年9月6日
細胞老化による発がん抑制作用を個体レベルで解明 ~細胞老化の仕組みを利用した新たながん治療法開発に向けて~
ポイント
- 明細胞肉腫(Clear Cell Sarcoma : CCS)注1)の細胞株からiPS細胞(CCS-iPSCs)を作製し、がん細胞であるCCSと同じ遺伝子変異を全身に持つキメラマウス注2)の作製に成功した。
- CCS-iPSCsから作製したキメラマウスでは皮下組織で腫瘍が発生したが、他の組織では遺伝子変異が存在するにもかかわらず細胞老化注3)により腫瘍の形成が抑制されていた。
- 細胞老化による発がん抑制メカニズムを明らかにするとともに、その分子基盤を標的とする新たながん治療法開発の可能性を見出した。
岐阜大学医学部整形外科(研究当時:京都大学iPS細胞研究所)の河村真吾 助教、東京大学医科学研究所の伊藤謙治 特任研究員、山田泰広 教授らの研究グループは、明細胞肉腫(Clear Cell Sarcoma : CCS)のマウスモデルに形成された腫瘍の細胞株からiPS細胞を樹立し、このiPS細胞をマウスの胚盤胞注4)に移植することで、CCSと同じ遺伝子変異を持つキメラマウスを作製しました。これまで、発がんには遺伝子変異が重要であることがわかっていましたが、遺伝子変異以外の他の要因の重要性は十分にわかっていませんでした。本研究では、作製したキメラマウスの組織を詳細に調べることで、遺伝子変異が存在しても多くの組織では腫瘍は形成されないことを示しました。また、このキメラマウスでの腫瘍抑制には細胞老化が関与していることを明らかにしました。さらに、この分子基盤を明らかにすることで、がん細胞に細胞老化を誘導し、がん細胞の増殖を抑制できることを示しました。本研究成果は、発がんには遺伝子変異だけでなく、細胞・組織ごとに異なるエピゲノム注5)も重要であることを個体レベルで明らかにするとともに、がん細胞のエピゲノムを標的として人為的に細胞老化を誘導することで発がんを抑制するという、新たながん治療法開発の可能性を提示しました。
遺伝子変異(DNAの配列異常)は発がんの原因の一つと考えられています。一方で、細胞・組織ごとに異なるエピゲノム(遺伝子配列の使い方)も発がんにおいて重要であることが示唆されています。また近年、個体の老化に関与している細胞老化が、発がんの抑制機構として働いていることがわかってきました。本研究では、若者に発生するが高齢者では少ないCCSに着目し、発がんにおけるエピゲノム制御の重要性と細胞老化の役割を個体レベルで解明することを目指して研究を行いました。
1. 明細胞肉腫(Clear Cell Sarcoma : CCS)由来のiPS細胞(CCS-iPSCs)から
キメラマウスの作製に成功(図1)
我々の研究グループは、CCSのマウスモデルに形成される腫瘍からCCSの細胞株を樹立していました(Yamada et al., JCI 2013)。今回の研究では、このがん細胞株からiPS細胞(CCS-iPSCs)を樹立して研究に用いました。CCS-iPSCsをマウスの胚盤胞に移植することで、CCSの遺伝子変異(DNAの 配列異常)を持ち、かつ薬剤依存的にCCSのドライバーとなる融合遺伝子(EWS/ATF1融合遺伝子)を発現誘導することが可能な細胞を全身に持つキメラマウスの作製に成功しました。このキメラマウスに薬剤を飲ませてEWS/ATF1融合遺伝子の発現を再誘導したところ、全身のさまざまな組織でEWS/ATF1を発現しているにもかかわらず、皮下組織でしか腫瘍は形成されないことを明らかにしました。このことから、発がんには遺伝子変異だけでなく、細胞・組織ごとに異なるエピゲノム(遺伝子配列の使い方)も重要であることが示されました。
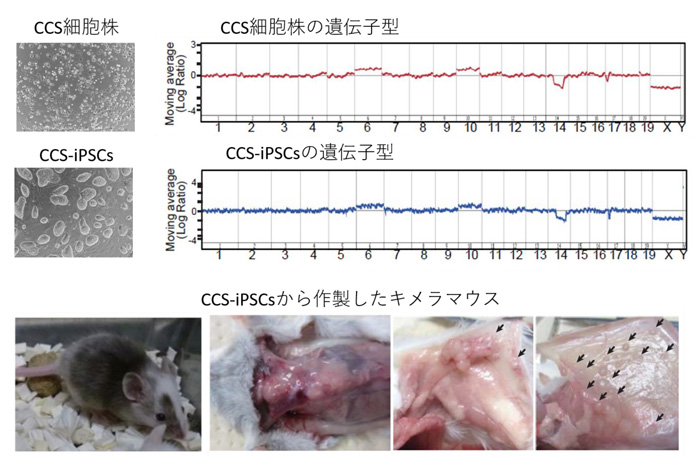
図1:CCS-iPSCsからキメラマウスの作製に成功
CCS細胞株から樹立したiPS細胞(CCS-iPSCs)は、がん細胞であるCCS細胞株と同じ遺伝子配列情報をもっていた(上図)。CCS-iPSCsから作製したキメラマウスでは、速やかに皮下組織に腫瘍の形成が認められた(下図、矢印)。
2. CCS-iPSCsを用いて作製したキメラマウスにおいて、腫瘍の形成が認められなかった
多くの組織では細胞老化が起きることを発見(図2)
続いて、CCS-iPSCsを用いて作製したキメラマウスでの発がん過程を詳細に解析しました。近年の研究により、細胞老化ががん抑制機構として働いている可能性が提示されていることから、細胞老化を示すマーカーとして知られている遺伝子群(p21, p53)の発現に着目しました。その結果、腫瘍が形成されなかった多くの組織では、これらの細胞老化に関連する遺伝子群が発現しており、さらに細胞増殖も停止していることから、細胞老化が起きていることがわかりました。一方で、腫瘍が形成された皮下組織では細胞老化の回避が起こり、速やかに活発な細胞増殖が誘導されることを示しました。
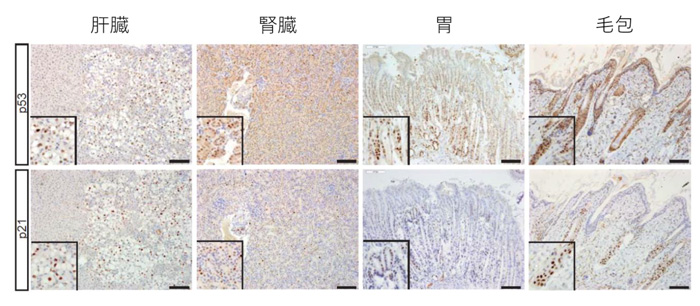
図2:作製したキメラマウスにおいて、腫瘍の形成が認められなかった多くの組織では細胞老化が起こっていた
ここに示す全ての組織(肝臓、腎臓、胃、毛包)では細胞老化に関与するp53やp21遺伝子の発現が確認され、細胞老化が起こっていることがわかった。
3. 細胞老化により腫瘍が抑制される
分子基盤を解明(図3)
がん細胞と同じ遺伝子変異をもつにもかかわらず、細胞老化が誘導され細胞増殖が停止するメカニズムを明らかにするために、CCSと同じ遺伝子変異をもつキメラマウス胎児由来の線維芽細胞注6)を用いて大規模なエピゲノム解析を行いました。その結果、線維芽細胞では遺伝子発現に重要な役割をもつエンハンサー領域注7)が元々のがん細胞であるCCSとは大きく異なることがわかりました。さらに、この知見を踏まえ、CCSの細胞株において認められる特定のエンハンサー領域を人為的に変化させることによりがん細胞であるCCSに細胞老化が誘導され、細胞増殖が抑制できることがわかりました。これらの結果から、がん細胞のエピゲノム状態を制御して細胞老化を誘導することで新たながん治療法を開発出来る可能性を提示しました。
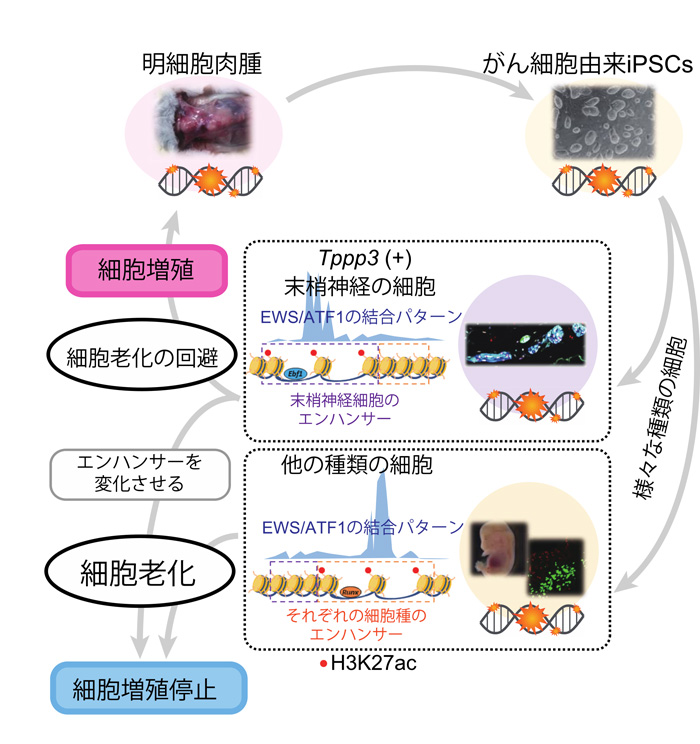
図3:細胞老化の誘導による新たながん治療法開発の可能性
同じ遺伝子変異をもつにもかかわらず、細胞老化を回避できる細胞は末梢神経の細胞のみであった。細胞老化の誘導/回避にはエンハンサー領域の違いが重要であることを明らかにした。CCS細胞株のエンハンサー領域を変化させると、CCS細胞の老化細胞の割合が増加し、細胞増殖が抑制されることがわかった。
本研究では、発がんの抑制における細胞老化の重要性を個体レベルで明らかにしました。また、細胞・組織ごとに異なるエピゲノム、特にエンハンサー領域の違いが、細胞老化誘導の違い、さらには腫瘍形成の違いの原因となっていることを明らかにしました。また、がん細胞で認められるエンハンサー領域を人為的に変化させることで、がん細胞に細胞老化を誘導し、細胞増殖を抑制することを示しました。以上の結果から、がん細胞のエピゲノムを標的とすることで細胞老化の仕組みを利用したがんの制御法の開発に貢献できる可能性が示されました。
- 論文名
Cell-type dependent enhancer binding of the EWS/ATF1 fusion gene in clear cell sarcomas - ジャーナル名
Nature communications - 著者
Shingo Komura, Kenji Ito, Sho Ohta, Tomoyo Ukai, Mio Kabata, Fumiaki Itakura, Katsunori Semi, Yutaka Matsuda, Kyoichi Hashimoto, Hirofumi Shibata, Masamitsu Sone, Norihide Jo, Kazuya Sekiguchi, Takatoshi Ohno, Haruhiko Akiyama, Katsuji Shimizu, Knut Woltjen, Manabu Ozawa, Junya Toguchida, Takuya Yamamoto, Yasuhiro Yamada*
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「時空間老化制御マウスを用いた細胞老化が及ぼす個体生命機能の理解」(研究開発代表者:山田泰広)、次世代がん医療創生研究事業(P-CREATE)における研究開発課題「異分野先端技術融合による薬剤抵抗性を標的とした革新的複合治療戦略の開発」(研究開発代表者:山田泰広)および日本学術振興会(科研費 基盤A)「リプログラミング技術を応用したがん研究」(研究代表者:山田泰広)の一環で行われました。
注1)明細胞肉腫(Clear Cell Sarcoma : CCS)
皮下組織や筋肉などの軟部組織から発生する悪性腫瘍を軟部肉腫といい、その中でも皮膚や四肢(特に下肢)などの軟部組織によくできる腫瘍。20歳から30歳代の若者によく発症することが知られる。EWS遺伝子とATF1遺伝子が融合した遺伝子(EWS/ATF1融合遺伝子)がドライバー遺伝子として知られている。
注2)キメラマウス
2種類以上の異なる系統のマウスの細胞と発生初期の胚を融合させることにより、人工的に作られるマウス。全身が移植した細胞と胚の遺伝的に異なる細胞から成る。
注3)細胞老化
細胞が分裂を停止し、増殖できない状態が引き起こされる現象。細胞の分裂寿命の他、がん遺伝子の活性化や酸化ストレス、DNA損傷などによって誘導されることがわかっている。細胞老化は個体の老化の原因となっていることが考えられている一方で、発がんの抑制機構として働くことが知られている。
注4)胚盤胞
哺乳類の受精卵で、卵割期の終わった時期にある胚のこと。
注5)エピゲノム
DNAの塩基配列を変えることなく、遺伝子のはたらきを決めるしくみをエピジェネティクスとよび、その情報の集まりをエピゲノムという。主にDNAのメチル化やヒドロキシメチル化、ヒストンタンパク質の修飾(メチル化、アセチル化、リン酸化など)やクロマチン(DNAとヒストンタンパク質の複合体)構造の変換などが知られている。
注6)線維芽細胞
皮膚などの結合組織を構成する主要な細胞。 コラーゲン(膠原線維)などの成分を作り出す。
注7)エンハンサー領域
遺伝子の発現量を増加させる作用をもつDNA領域のことをいう。通常、エンハンサー領域のクロマチン構造はオープンになっており、遺伝子発現に関わるさまざまなタンパク質が結合出来るようになっている。