
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2025年4月4日
若年性認知症を来す前頭側頭葉変性症に対する治療薬候補と治療標的分子のiPS創薬による同定
ポイント
- 若年性認知症を来す前頭側頭葉変性症患者さんのiPS細胞を用いて既存薬(注1)スクリーニングを行い、治療薬候補を見出しました。
- メカニズムとして、CACNA2D2を前頭側頭葉変性症の治療標的として同定しました。
- 本研究結果により、前頭側頭葉変性症患者さんを対象とした臨床試験を計画しています。
今村恵子特定拠点講師および井上治久教授(京都大学CiRA増殖分化機構研究部門)らの研究グループは、大阪大学医学部附属病院神経科・精神科 池田学教授、森康治講師、量子科学技術研究開発機構(QST)量子医科学研究所 樋口真人センター長、新潟大学脳研究所 佐原成彦特任准教授(2025年3月31日までQSTに所属)、川崎医科大学 砂田芳秀学長、同神経内科学 大澤裕特任准教授、久徳弓子講師らの研究グループとともに、前頭側頭葉変性症患者さんのiPS細胞を用いた既存薬スクリーニングにより治療薬候補を見出し、CACNA2D2を前頭側頭葉変性症の治療標的として同定しました。
この研究成果は2025年3月29日に欧州科学誌「European Journal of Cell Biology」でオンライン公開されました。
前頭側頭葉変性症(FTLD)は、指定難病の一つで若年性認知症の最も一般的な原因の一つとして知られています。FTLDの患者さんは、性格や行動の変化や言葉がうまく話せなくなるといった症状が現れ、さらに手足の動かしにくさや筋肉の萎縮などの症状がみられることもあります。これらの症状は患者さんの社会生活や生活の質に大きく影響しますが、残念ながら現在はFTLDを根本的に治す薬はありません。
FTLDは、脳の神経細胞やグリア細胞に異常なタンパク質がたまることが原因となる場合が多く、特にタウ(Tau)やTDP-43と呼ばれるタンパク質の蓄積が関係しています。FTLD-Tauは、タウタンパク質が脳に異常にたまって脳の萎縮を引き起こすタイプのFTLDです。特に、タウオリゴマーと呼ばれる異常な形をしたタウタンパク質が蓄積することが、神経細胞にとって有害であると考えられています。
研究グループは、これまでに、FTLD-Tauの患者さんのiPS細胞を用いた研究を行い、異常なタウタンパク質であるタウオリゴマーが患者さんの神経細胞に蓄積し、神経細胞死を来しやすいこと、神経細胞の興奮が過剰になっていることを見出しました。さらに、神経の過剰な興奮とタウタンパク質の蓄積、そして神経細胞の障害は密接に関係していることを報告しました(CiRAプレスリリース:2016年10月10日)。
本研究では、FTLD-Tauの患者さんのiPS細胞から作製した神経細胞を用いて、治療薬のスクリーニングを行いました。
研究グループは、FTLDの治療薬を見つけるために、FTLD-Tauの患者さんのiPS細胞から神経細胞を作製し、神経細胞死の抑制効果を示す薬を調べるスクリーニングを行いました。その結果、別の脳の疾患で用いられるガバペンチンという既存薬が、タウオリゴマーの蓄積を抑えながら神経細胞死を防ぐ効果があることを見出しました。
さらに、プレガバリンやミロガバリンなどのガバペンチノイドと呼ばれるガバペンチンと類似した薬も、同様にFTLD患者さんの神経細胞死を抑制する効果を示しました。これらの薬は、電位依存性カルシウムチャネルの一部であるα2δサブユニットに結合し、その中でもα2δ1とα2δ2という2つのタイプを標的とすることが知られています。
そこで、どちらのサブユニットがFTLD-Tauに関係しているのかを調べるため、FTLD患者さんのiPS細胞において、α2δ1とα2δ2をコードする遺伝子であるCACNA2D1とCACNA2D2のノックアウト(注2)実験を行いました。その結果から、CACNA2D2のノックアウトにより、FTLD-Tauの神経細胞死とタウオリゴマー蓄積が抑制され、α2δ2がFTLD-Tauの神経変性に重要な役割を果たしていることが分かりました。
さらに、FTLD-Tau患者さんの細胞から作った脳オルガノイドでも、FTLD-Tauの神経変性の特徴が見られ、CACNA2D2遺伝子(α2δ2をコードする遺伝子)をノックアウトすると、これらの神経変性に関連する遺伝子発現の異常が一部改善されました。この研究結果は、α2δ2がFTLD-Tauの治療標的として有望であることを示しています。
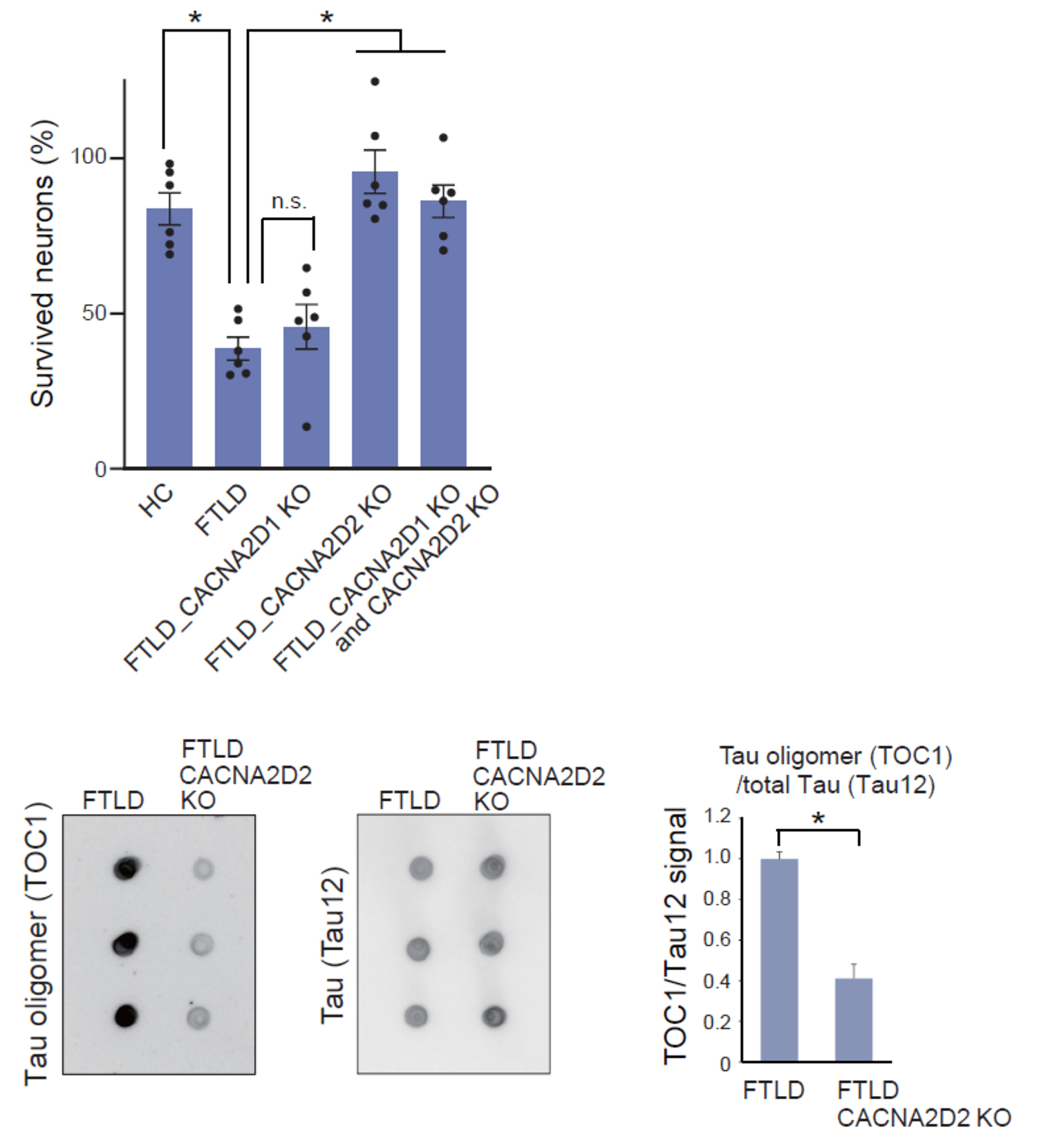
【図の説明】
上段:
FTLD-Tau患者さんのiPS細胞において、CACNA2D1、CACNA2D2のノックアウト(KO)を行った際の神経細胞の生存率。CACNA2D2のノックアウトによって神経細胞の生存率が増加した。
下段:
FTLD-Tau患者さんのiPS細胞において、CACNA2D2のノックアウト(KO)を行った際のタウオリゴマー蓄積の評価。CACNA2D2のノックアウトによってタウオリゴマーの蓄積が減少した。TOC1はタウオリゴマーを検出する抗体、Tau12はすべてのタウタンパクを検出する抗体。
FTLD-Tau患者さんのiPS細胞を用いた薬剤スクリーニングとメカニズムの解析により、CACNA2D2遺伝子がコードするα2δ2がFTLD-Tauの治療標的となりうることが示されました。CACNA2D2を標的とする既存薬であるガバペンチン、プレガバリン、ミロガバリンが、FTLDの治療薬として有望である可能性が示されました。
-
前頭側頭葉変性症の前方向的臨床情報収集体制を構築している
大阪大学医学部附属病院神経科・精神科 池田学教授のコメント:
「この病気は、性格や行動の病的変化、認知症などを生じる根本的治療薬のない病気です。本研究結果は、これまでなかった前頭側頭葉変性症のメカニズムに基づく治療法の開発につながるため、この研究結果にもとづき、前頭側頭葉変性症患者さんを対象とした臨床試験を計画しています。」
- 論文名
iPSC Screening identifies CACNA2D2 as a Potential Therapeutic Target for FTLD-Tau - ジャーナル名
European Journal of Cell Biology - 著者
Keiko Imamura1,2,3, Ayako Nagahashi1,3, Aya Okusa1,3, Tomoki Sakasai1,3, Kayoko Tsukita1,2, Yumiko Kutoku4, Yutaka Ohsawa4, Yoshihide Sunada4, Naruhiko Sahara5, Nicholas M. Kanaan6, Makoto Higuchi5, Kohji Mori7, Manabu Ikeda7, Haruhisa Inoue1,2,3*
*Corresponding author - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 理化学研究所 バイオリソースセンター
- 理化学研究所 革新知能統合研究所(AIP)
- 川崎医科大学
- 量子科学技術研究開発機構(QST)量子医科学研究所
- College of Human Medicine, Michigan State University
- 大阪大学医学部附属病院神経科・精神科
本研究は、下記機関より支援を受けて実施されました。
- AMED 疾患特異的iPS細胞の利活用促進・難病研究加速プログラム(JP22bm0804034)
- AMED 脳神経科学統合プログラム(JP24wm0625501)
注1)既存薬
すでに販売されており、病院や薬局で処方されている薬。
注2)ノックアウト
特定の遺伝子の働きを人工的に止めること。ある遺伝子がどんな働きをしているのかを調べたいときに、その遺伝子がない状態でどんな変化が起こるかを観察することにより、その遺伝子の役割を明らかにできる。






















