
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2025年4月24日
ヒトiPS細胞由来呼吸器オルガノイドを用いたRSウイルス感染症研究
ポイント
- ヒト呼吸器オルガノイド注1)にRSウイルスは効率よく感染しました。
- RSウイルスに感染したヒト呼吸器オルガノイドにおいて、呼吸器上皮層の破壊、自然免疫応答、炎症応答を観察できました。
- ヒト呼吸器オルガノイドを用いて、RSウイルスの治療薬および予防薬を評価できました。
橋本 里菜 研究員(CiRA増殖分化機構研究部門・研究当時、現・東京科学大学総合研究院難治疾患研究所)、渡邉 幸夫 研究員(CiRA同部門・研究当時)、高山 和雄 講師(CiRA同部門・研究当時、現・東京科学大学同研究所 教授)らの研究チームは、ヒトiPS細胞より分化誘導した呼吸器オルガノイドを用いて、RSウイルス感染時における宿主応答を解析しました。また、ヒト呼吸器オルガノイドを用いてRSウイルスに対するモノクローナル抗体および米国でRSウイルス感染症の治療薬として認可されているリバビリンの抗ウイルス効果を評価しました。
研究チームが開発したヒト呼吸器オルガノイドは、呼吸器上皮細胞だけでなくマクロファージや線維芽細胞、血管内皮細胞を含んでいるため、炎症注2)などをより正確に再現することができます。本研究では、RSウイルスを感染させたヒト呼吸器オルガノイドを用いて、RSウイルス感染時のヒト呼吸器における宿主応答を詳細に解析しました。また、ヒト呼吸器オルガノイドを用いてモノクローナル抗体およびリバビリンの抗ウイルス効果の比較を行いました。以上より、ヒト呼吸器オルガノイドはRSウイルス感染症病態解析および創薬研究のための有用なツールとなる可能性が示唆されました。
この研究成果は2025年4月22日(米国時間)に「Life Science Alliance」でオンライン公開されました。
RSウイルスは、主に乳幼児に感染し、重症化すると呼吸困難を伴う下気道炎を呈する呼吸器感染症です。患者が多いにも関わらず、RSV感染病態に対する理解は未だ限定的で、抗ウイルス薬の開発は十分ではありません。その原因として、RSV感染症モデルの確立が不十分であることがあげられます。そこで本研究では、呼吸器を構成する呼吸器上皮細胞や免疫細胞、線維芽細胞、血管内皮細胞を含むヒト呼吸器オルガノイドをRSV感染症モデルとして使用できないか検証しました。
1)RSウイルスはヒト呼吸器オルガノイドに効率よく感染する
ヒト呼吸器オルガノイドにRSウイルスを感染させ、4日間培養しました。培養上清中のウイルス力価は、経時的に増加しました(図1A)。また、感染4日後のRSウイルスmRNAおよびRSウイルス融合タンパク質(Fタンパク質)注3)の高い発現が確認でき(図1B、1C)、電子顕微鏡によってRSウイルス粒子が観察されました(図1D)。蛍光染色画像では、アセチル化αチューブリン陽性の線毛細胞注4)からなる上皮層が、RSウイルス感染により破壊される様子が確認できました(図1E)。以上の結果から、RSウイルスはヒト呼吸器オルガノイドに効率よく感染することが示唆されました。
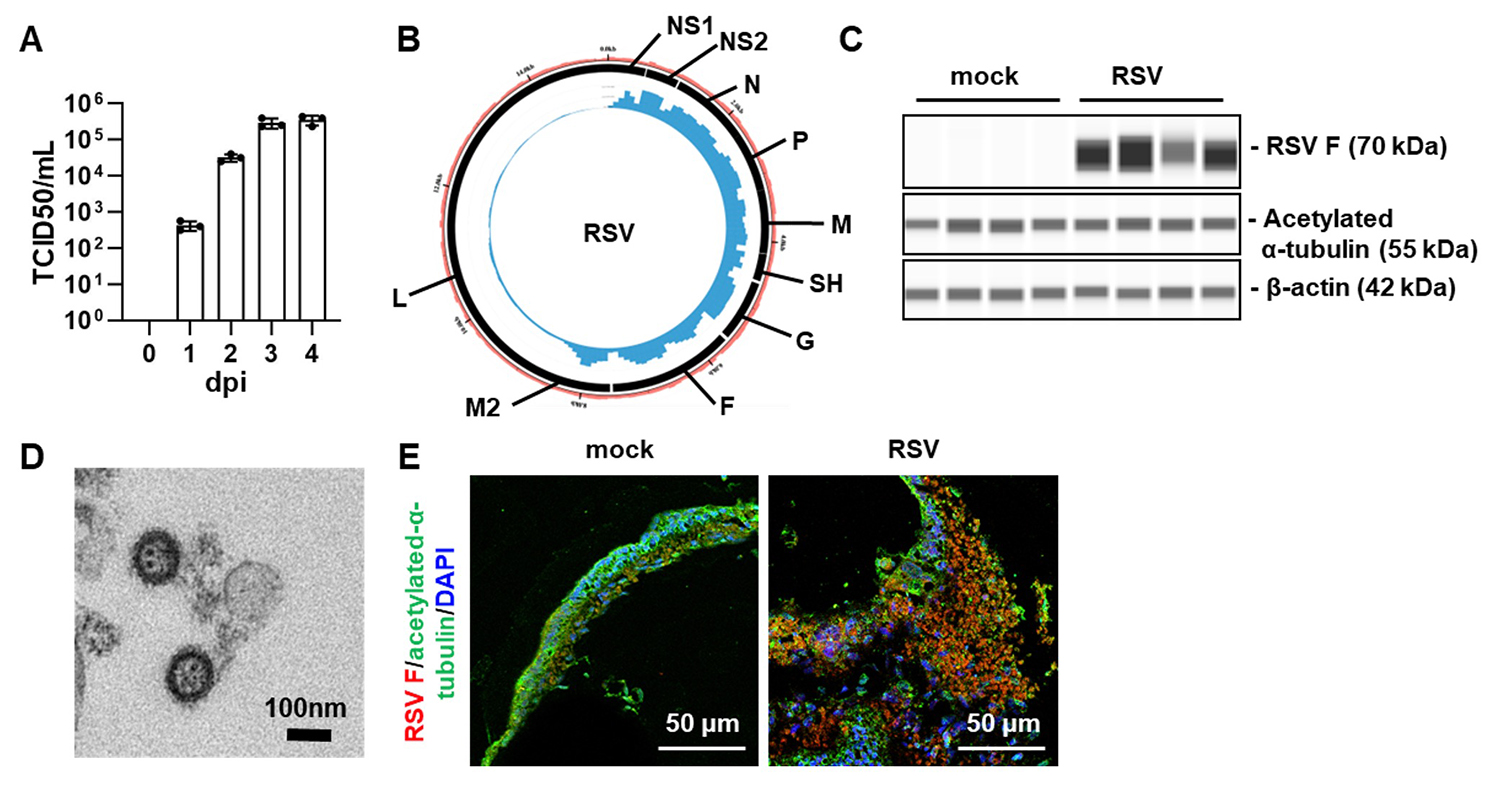
図1:ヒト呼吸器オルガノイドのRSウイルス感染実験
ヒト呼吸器オルガノイドにRSウイルスを感染させ、4日間培養した。
(A)培養上清中のウイルス力価の経時的変化
(B)RNA-seq解析データに基づくサーコスプロット
(外側の黒線:RSウイルスの遺伝子、内側の青いエリア:RSウイルスの各遺伝子の発現量)
(C)非感染群(mock)、感染群(RSV)におけるRSウイルスFタンパク質発現量
(D)ヒト呼吸器オルガノイド内で確認されたRSウイルスの電子顕微鏡画像
(E)非感染群(mock)、感染群(RSV)における蛍光顕微鏡
(赤:RSウイルスFタンパク質、緑:線毛細胞、青:核)
2)RSウイルス感染ヒト呼吸器オルガノイドにおける宿主応答の解析
次に、ヒト呼吸器オルガノイドにおけるRSウイルス感染時の宿主応答の解析を行いました。ヘマトキシリン・エオシン(H&E)染色およびシリウスレッド染色の結果から、RSウイルスを感染させたヒト呼吸器オルガノイドにおいて呼吸器上皮層が破壊され、コラーゲンが蓄積する様子が確認できました(図2A、2B)。
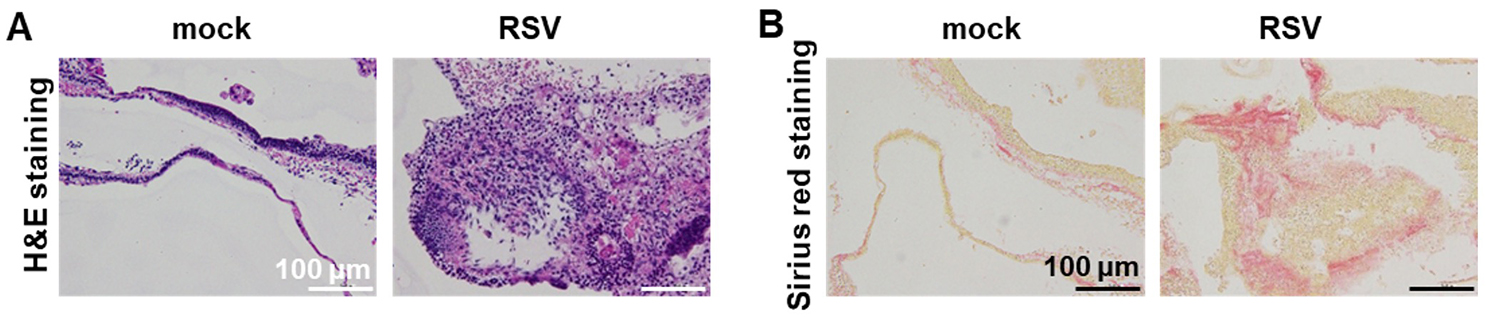
図2:RSウイルス感染ヒト呼吸器オルガノイドの組織学的解析
(A)非感染群(mock)、感染群(RSV)におけるH&E染色画像
(B)非感染群(mock)、感染群(RSV)におけるシリウスレッド染色画像
(赤色がコラーゲンを示す)
RSウイルス感染ヒト呼吸器オルガノイドを用いて、RNAシーケンス解析を実施しました。その結果、RSウイルス感染により有意な発現上昇した遺伝子が381個、発現低下した遺伝子が120個確認できました(図3A)。381個の発現上昇遺伝子を用いたエンリッチメント解析より、インターフェロン(IFN)-γ応答を含む自然免疫応答や炎症応答に関与する遺伝子群の発現が上昇していることが示唆されました(図3B)。また、培養上清中に含まれるサイトカイン量を測定したところ、IFN-γやインターロイキン(IL)-8を含む多くのサイトカイン量の増加が確認できました(図3C)。以上の結果から、RSウイルスを感染させたヒト呼吸器オルガノイドにおいて、呼吸器上皮層の破壊、コラーゲンの蓄積、自然免疫応答や炎症応答が観察できることが分かりました。
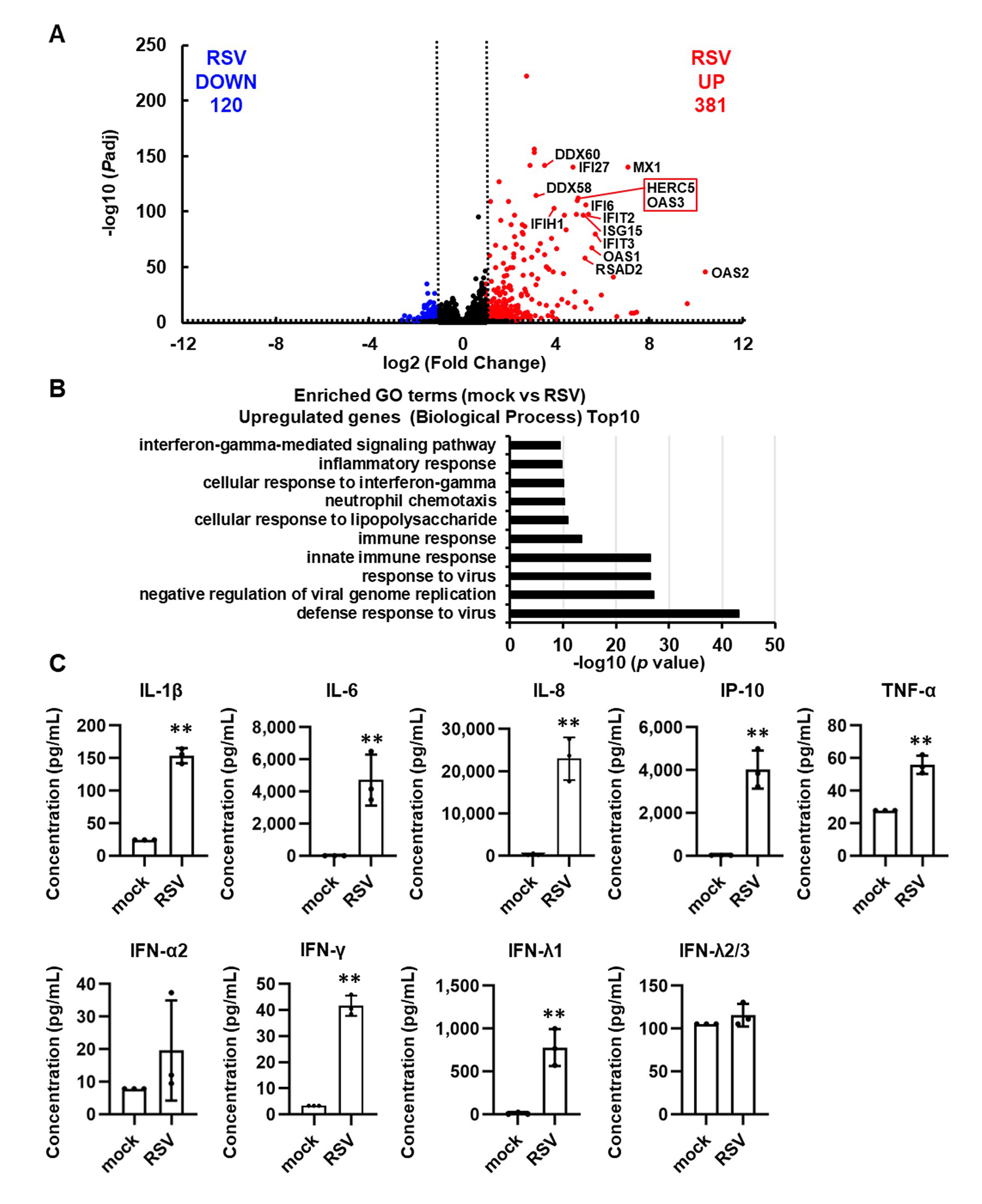
図3:RSウイルス感染ヒト呼吸器オルガノイドにおける宿主応答の解析
(A)RNA-seq解析データに基づくヴォルケーノプロット
(赤:RSウイルス感染により発現上昇した遺伝子(381個)、青:RSウイルス感染により発現低下した遺伝子(120個))
(B)発現上昇遺伝子(381個)のエンリッチメント解析に基づく上位10個の遺伝子オントロジー
(C)非感染群(mock)、感染群(RSV)における培養上清中のサイトカイン量
(**p<0.01を示す)
3)RSウイルスに対するモノクローナル抗体およびリバビリンの評価
最後に、ヒトRSウイルスに対するモノクローナル抗体4種(ニルセビマブ、スプタブマブ、クレスロビマブ、パリビズマブ)およびリバビリンの評価を行いました。パリビズマブは1998年に、ニルセビマブは2023年にRSウイルス感染症の予防薬として承認されたモノクローナル抗体であり、その有効性は臨床的にも認められています。一方でリバビリンはRSウイルス感染症の治療薬として用いられることもありましたが、有効性が十分ではないこと、対象患者や投与法が限定的であることなど課題がありました。これらモノクローナル抗体およびリバビリンを作用させたヒト呼吸器オルガノイドにRSウイルスを感染させ、4日後のウイルス力価を測定しました。その結果、モノクローナル抗体は作用濃度依存的にウイルス力価が減少する一方で、リバビリンは高濃度作用群においてもウイルス力価が十分に低下しませんでした(図4A)。また、ニルセビマブおよびパリビズマブを作用させたヒト呼吸器オルガノイドのシングルセルRNAシーケンス解析を行いました。その結果、I型肺胞上皮細胞やII型肺胞上皮細胞注5)、線毛細胞、分泌細胞注6)におけるRSウイルス核タンパク質(Nタンパク質)注7)の発現量が、ニルセビマブおよびパリビズマブ作用によって有意に低下していることが分かりました(図4B)。さらに、II型肺胞上皮細胞や線毛細胞、分泌細胞における自然免疫応答関連遺伝子(ISG、IFI6)はニルセビマブおよびパリビズマブ作用によって低下していました(図4C)。以上の結果から、ヒト呼吸器オルガノイドは、RSウイルスの治療薬および予防薬の評価が可能であることが示唆されました。
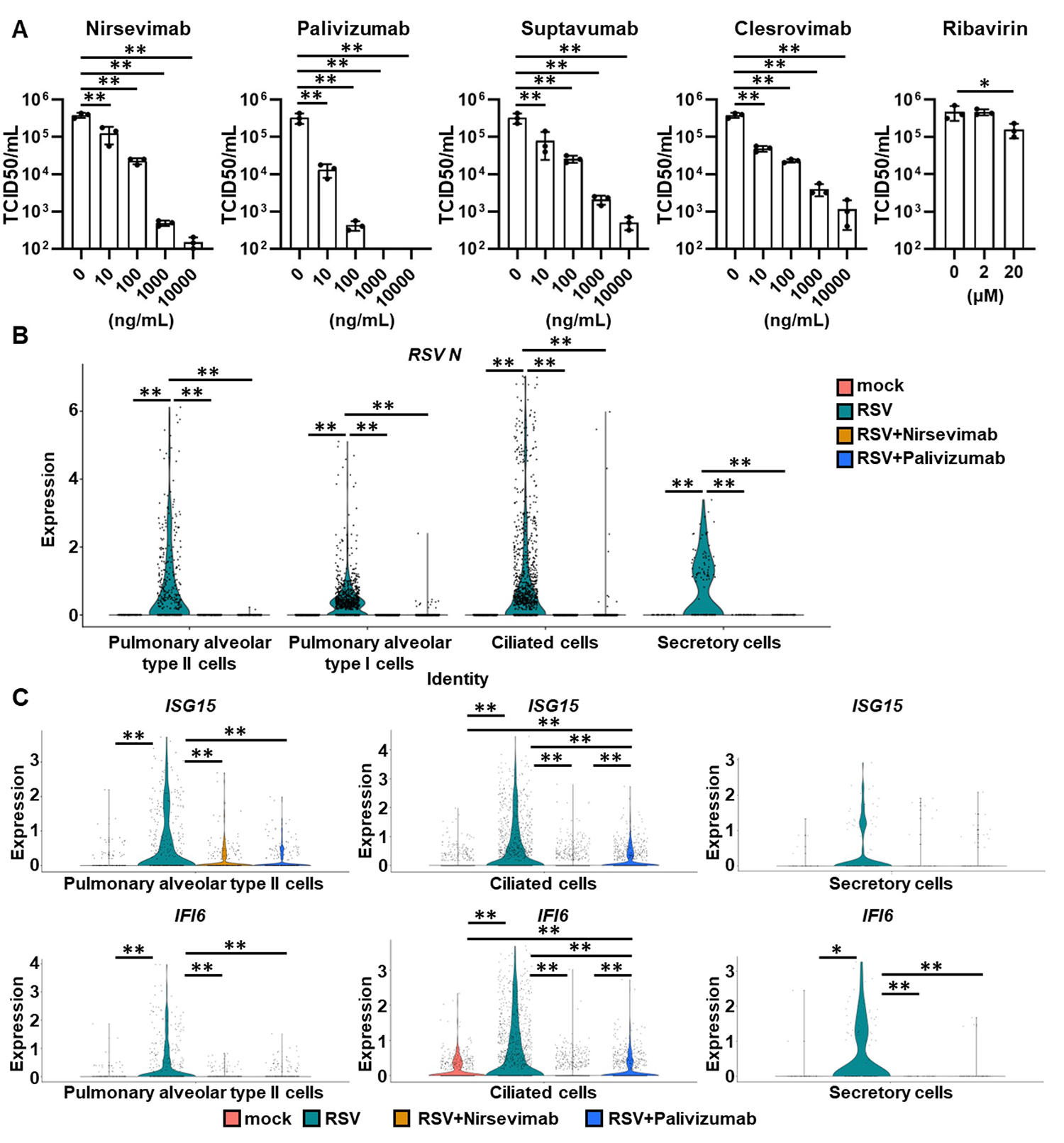
図4:ヒト呼吸器オルガノイドを用いたモノクローナル抗体およびリバビリンの有効性評価
(A)モノクローナル抗体4種(ニルセビマブ、パリビズマブ、スプタブマブ、クレスロビマブ)およびリバビリンをそれぞれ作用させたヒト呼吸器オルガノイドに、RSウイルスを感染させた。感染4日後の培養上清を用いて、ウイルス力価を測定した。
(B,C)ニルセビマブおよびパリビズマブを作用させたヒト呼吸器オルガノイドの各細胞における、RSウイルスNタンパク質の発現量(B)および自然免疫応答関連遺伝子(C)。
**p<0.01を示す。
本研究では、RSウイルスがヒト呼吸器オルガノイドにおいて効率よく感染することを示し、呼吸器上皮層の破壊、コラーゲンの蓄積、自然免疫および炎症反応の評価が可能なことを確認しました。 また、ヒト呼吸器オルガノイドを用いて、RSウイルス感染症予防薬として使用されるモノクローナル抗体の効果は確認された一方で、RSウイルス感染症治療薬として用いられるリバビリンの効果はほとんど確認されませんでした。ヒト呼吸器オルガノイドは、RSウイルス感染症病態解析や治療薬および予防薬の開発のための重要なモデルとなることが期待されます。
- 論文名
Human iPS cell-derived respiratory organoids as a model for respiratory syncytial virus infection - ジャーナル名
Life Science Alliance - 著者
Rina Hashimoto1,2*, Yukio Watanabe1*, Abeer Keshta1, Masaya Sugiyama3, Yuki Kitai4, Ai Hirabayashi5,6, Naoko Yasuhara1, Shiho Morimoto1, Ayaka Sakamoto1, Yasufumi Matsumura7, Hidekazu Nishimura8, Takeshi Noda5,6,9, Takuya Yamamoto1,10,11, Miki Nagao7, Makoto Takeda4, Kazuo Takayama1,2**
*筆頭著者 **責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 東京科学大学 総合研究院難治疾患研究所・人体模倣システム学分野
- 国立国際医療研究センター 研究所感染病態研究部
- 東京大学大学院医学系研究科 医学部・微生物学教室
- 京都大学医生物学研究所 微細構造ウイルス学分野
- 科学技術振興機構 CREST
- 京都大学大学院医学研究科 臨床病態検査学
- 仙台医療センター 臨床研究部 ウイルスセンター
- 京都大学大学院生命科学研究科 微細構造ウイルス学分野
- 京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi)
- 理化学研究所 革新知能統合研究センター(AIP)
本研究は、下記機関より支援を受けて実施されました。
- iPS細胞研究基金
- 日本医療研究開発機構(AMED)(JP21gm1610005、JP23fk0210135、JP23bm1323001、JP23jf0126002、JP243fa627001)
- 日本学術振興会(JSPS)研究拠点形成事業(A.先端拠点形成型)(JPJSCCA20240006)
- 京都大学・ウイルス感染症・生命科学先端融合的共同研究拠点
注1)ヒト呼吸器オルガノイド
ヒトiPS細胞より分化誘導した呼吸器オルガノイド。気道上皮細胞および肺胞上皮細胞どちらも有しているだけでなく、肺胞マクロファージ、線維芽細胞、血管内皮細胞でも構成されている。
注2)炎症
病原体の侵入や組織損傷などをきっかけに、上皮細胞あるいは血管内皮細胞、免疫細胞から炎症性サイトカイン等の放出から始まる連鎖的な免疫応答反応。炎症発生後の組織修復の過程で、活性化した線維芽細胞が細胞外マトリクスを産生する。
注3)RSウイルス融合タンパク質(Fタンパク質)
RSウイルスの構造タンパク質のひとつ。宿主細胞への膜融合の際に重要な役割を果たす。
注4)線毛細胞
気道上皮層を構成する細胞のひとつ。線毛をもち、異物を外に出す働きを持つ。
注5)I型、II型肺胞上皮細胞
肺胞上皮層を構成する細胞。I型肺胞上皮細胞は酸素や二酸化炭素などのガス交換に重要な働きを示す。II型肺胞上皮細胞は肺がつぶれないようにする活性物質(サーファクタント)を分泌し、I型肺胞上皮細胞に分化する幹細胞としての役割をもつ。
注6)分泌細胞
気道上皮層を構成する細胞のうち、粘液などを分泌する細胞の総称。
注7)RSウイルス核タンパク質(Nタンパク質)
RSウイルスの非構造タンパク質のひとつ。ウイルス複製に重要な役割を果たす。






















