
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2013年11月19日
大規模解析により品質の悪い多能性幹細胞の見分け方を開発
青井三千代助教(神戸大学大学院医学研究科/元京都大学CiRA)、大貫茉里研究員(京都大学CiRA)、高橋和利講師(京都大学CiRA)、山中伸弥教授(京都大学 CiRA)らの研究グループは、ヒトiPS/ES細胞を大規模に解析し、神経細胞へと誘導した際に未分化な細胞が残り、マウスの脳に移植すると奇形腫を形成する(品質が悪い)iPS細胞株があることを見いだしました。また、それらの株には、ある特徴的な遺伝子が働いていることを明らかにしました。 本研究成果は2013年11月18日(月)以降(米国東部時間)に米国科学誌「Proceedings of the National Academy of Sciences」のオンライン版に掲載されました。
ポイント
- 合計59株のヒトiPS細胞とヒトES細胞を同じ条件で培養して比較検討したところ、単一の遺伝子の発現注1)やDNAのメチル化注2)によって両者を区別することはできなかった。
- ヒトiPS/ES細胞を神経細胞に分化誘導したところ、未分化な細胞が残り、マウスの脳に移植すると奇形腫注3)を形成するiPS細胞株があることがわかった。また、それらの細胞株に共通して発現の高い遺伝子を見出した。
- 再生医療に利用する際、品質の良いiPS細胞と悪い細胞を見分ける指標として利用可能。
ここ数年、iPS細胞とES細胞の違いについて、様々な報告がなされてきましたが、これまでの報告では比較に用いる細胞株の数が少ない点や、培養条件が統一されていないという問題点がありました。 そこで、今回はヒトiPS細胞49株、ヒトES細胞10株を同じ条件で培養し、それぞれの性能を比較検討しました。その結果、遺伝子の発現パターンやDNAのメチル化の状態については、一遺伝子で両者を識別することはできませんでした。 また、神経細胞への分化能力を検討した所、一部未分化な細胞が残り、マウスの脳に移植すると奇形腫を形成するiPS細胞株がありました。また、この品質の悪いiPS細胞株では共通して強く働く遺伝子があることも分かりました。 この特徴を踏まえて、再生医療等に使うiPS細胞から品質の悪いiPS細胞を取り除くことが可能になると考えられます。
1) 単一の遺伝子発現やDNAメチル化ではヒトiPS細胞とES細胞は明確に区別できなかった。
4種の体細胞(皮膚線維芽細胞注4)・歯髄幹細胞・臍帯血細胞・末梢血単核球)から、3つの遺伝子導入方法(レトロウイルス、エピソーマルプラスミド、センダイウイルス)注5)を用いて49株のヒトiPS細胞を樹立しました(Table 1)。
また、これらに加え、10株のヒトES細胞を同じ方法で培養し、それぞれの遺伝子発現パターンやDNAのメチル化状態を比較しました。
その結果、今回我々が用いた系では、単独でヒトiPS細胞とES細胞を識別できる指標となるような遺伝子はありませんでした(Fig. 1)。
Table. 1 使用したiPS細胞の由来と樹立方法
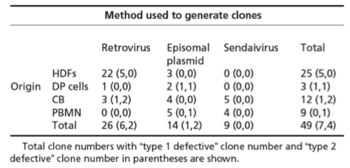
HDF:皮膚線維芽細胞
DP:歯髄幹細胞
CB:臍帯血細胞
PBMN:末梢血単核球
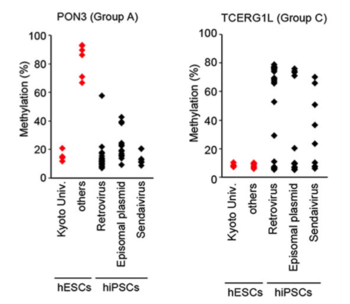
Fig.1 ヒトiPS細胞とES細胞とでDNAメチル化状態を比較した結果
以前にヒトiPS細胞とES細胞を識別する指標になると報告された2つの遺伝子PON3(左)とTCERG1L(右)のDNAメチル化状態について調べた結果を示した。
今回我々が用いた系では両者でメチル化状態はオーバーラップしており、これらを指標にiPS細胞とES細胞を識別することはできなかった。
2) 神経細胞へと分化させても、一部の未分化細胞が残る品質の悪いiPS細胞があった。また、それらを見分けるための指標となる遺伝子を見出した。
iPS細胞およびES細胞の分化能力を検証するために、培養ディッシュ上で40株のiPS細胞と10株のES細胞を神経細胞へと分化させました。
どの細胞株も80%以上の効率で神経細胞へと分化することが確認できましたが、一部のiPS細胞株では10%以上の未分化な細胞が残ってしまうことがわかりました(Fig. 2A)。
また、分化誘導後の細胞を、マウスの脳に移植すると、これらの品質の悪い細胞株は奇形腫を形成することもわかりました。
これらの細胞株を事前に予測するために、 品質の悪い細胞株("defective")と良い株("good")との間で遺伝子発現のパターンを比較したところ、品質の悪い細胞株で共通して強く発現しており、指標となりうる遺伝子群を見出しました(Fig. 2B, C)。
また、これらの遺伝子群の発現には、太古の昔にヒトのゲノム上に挿入された内在性レトロウイルスが関与している可能性も示唆されました。
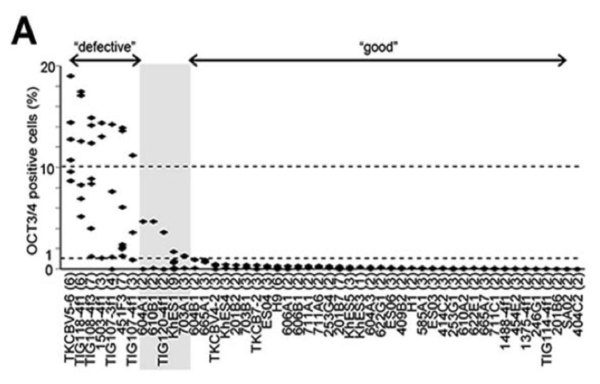
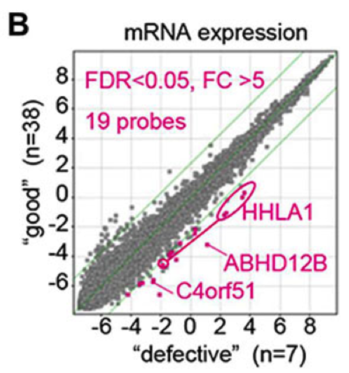
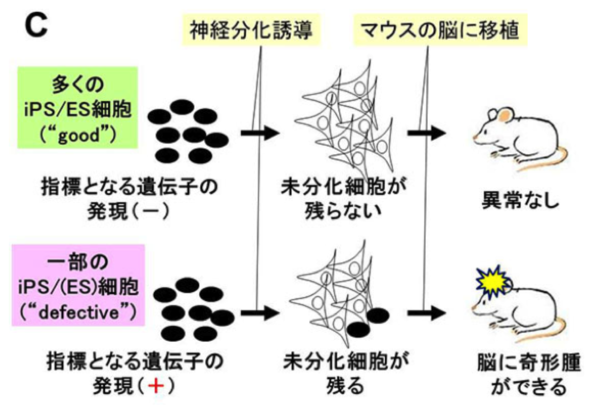
Fig.2 品質の悪いiPS細胞を識別する遺伝子群の同定
(A)40株のヒトiPS細胞と10株のヒトES細胞を神経細胞へと分化させ、未分化マーカーであるOCT3/4を指標に未分化細胞の残存率を測定した。品質の悪い株を "defective"とし良い株を "good"とした。
(B)品質の悪い株"defective"と良い株"good"との間で遺伝子発現のパターンを比較した。マゼンダ色が品質の悪い株で発現が高かった遺伝子群。特に3つの遺伝子に着目した。
(C)指標となる遺伝子の発現の有無で神経分化誘導、移植実験を行うことなく、品質の悪い細胞を予測できることが期待される。
本研究では多数のiPS細胞・ES細胞株を用いて両者の違いを比較検討しましたが、単独で両者を識別できる指標となるような遺伝子はありませんでした。 また、iPS細胞には、神経細胞へ分化させても未分化細胞が残る品質の悪いものが一部あり、質の良い細胞株と比較して発現量の高い遺伝子群があることも明らかにしました。 この成果を利用することで、再生医療などでiPS細胞を利用する際に、品質の悪いiPS細胞を除去することが可能になると考えられます。
- 論文名
"Differentiation defective phenotypes revealed by large scale analysis of human pluripotent stem cells" - ジャーナル名
PNAS - 著者
Michiyo Koyanagi-Aoi1,*, Mari Ohnuki1,*, Kazutoshi Takahashi1, Keisuke Okita1 , Hisashi Noma2, Yuka Sawamura1, Ito Teramoto1, Megumi Narita1, Yoshiko Sato1, Tomoko Ichisaka1, Naoki Amano1, Akira Watanabe1, Asuka Morizane1, 3, Yasuhiro Yamada1, 4, Tosiya Sato5, Jun Takahashi1, 3 and Shinya Yamanaka1, 6, **
* 筆頭著者
**責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 統計数理研究所
- 京都大学再生医科学研究所
- 京都大学 物質--細胞統合システム拠点(iCeMS)
- 京都大学大学院医学研究科
- グラッドストーン研究所
本研究は、下記機関より資金的支援を受けて実施されました。
- 文部科学省 科学研究費補助金
- 文部科学省 再生医療の実現化プロジェクト
- 文部科学省 再生医療の実現化プロジェクト
- 内閣府 最先端研究開発支援プロジェクト(FIRST)
- 日本学術振興会特別研究員制度
注1) 遺伝子の発現
遺伝情報が実際に機能すること。一般的には遺伝情報はDNAの形で保存されており、mRNAに写しとって(転写して)、タンパク質へと翻訳されることで機能を発揮する事が多い。中にはRNAの状態で機能するものもある。
注2) DNAのメチル化
哺乳類の場合、DNAのシトシン塩基の5位末端の水素(-H)がメチル基(-CH3)に置き換わることをいう。遺伝子の働きを調整する領域がメチル化されると遺伝子の発現が抑制され、逆にメチル基が外れる(脱メチル化) と、遺伝子の発現が活発になることが知られている。塩基配列の変化に依らない遺伝子発現の機構(エピジェネティクス)の一つ。
注3) 奇形腫(テラトーマ)
ES細胞やiPS細胞を免疫不全マウスの皮下などに注射すると、腫瘍を形成する。この腫瘍はテラトーマと呼ばれ、様々な種類の組織が混在している。
注4) 線維芽細胞
結合組織を構成する最も主要な細胞。多くの臓器に存在する。何らかの損傷により組織に傷が生じると、この細胞が増殖し修復する。
注5) 3つの遺伝子導入方法
レトロウイルス:
初めて山中教授らによってiPS細胞が見つけられた時に使われていた方法。レトロウイルスは細胞の染色体(遺伝子)の中に初期化遺伝子を埋め込んでしまうため、がん化のリスクが高いとされている
エピソーマルプラスミド:
2011年に沖田講師ら(CiRA)が発表した方法。染色体に遺伝子を埋め込まず、分裂するに従って外から加えた初期化因子がなくなっていくため、よりがん化のリスクが少ない手法とされる。
センダイウイルス:
染色体に初期化遺伝子を埋め込まないため、がん化のリスクが少ないとされている手法。






















