
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2016年4月29日
ヒト角膜上皮分化を規定している新分子を発見
~OVOL2は角膜上皮における上皮性恒常維持に関与~
北澤耕司助教(京都府立医科大学 特任講座 感覚器未来医療学)、升井伸治講師(京都大学CiRA)と木下茂教授(京都府立医科大学 特任講座 感覚器未来医療学)らのグループは、OVOL2が角膜上皮を機能的に維持していることを発見しました。
我々人類は外界からの情報の80%を目から得ており、視覚機能の維持は必須の課題であります。視覚を維持するには光の取り込み口にある角膜が透明であることが必要不可欠であり、角膜が混濁すると視力低下をきたし失明にいたります。角膜の治療をはじめ、様々な疾患で再生医療の研究が進む中、特定の細胞を適切に誘導する技術が必要となってきています。しかし、角膜上皮細胞の分化がどのように規定されているかはまだわかっていません。
升井講師らの研究グループはiPS干渉法(注1)を用いて、OVOL2を含む6つの転写因子セットが、ヒト角膜上皮の性質を決定しているキーとなる因子であることを見出しました。このセットをヒト皮膚線維芽細胞に導入することによって、2週間で角膜上皮特異的タンパク質を発現している細胞を誘導することに成功しました。角膜上皮細胞においてOVOL2をノックダウン(注2)させると、角膜上皮の重要な機能の1つである異物の侵入をブロックするバリア機能が大きく低下しました。また、その維持メカニズムとして、上皮間葉転換(注3)を介していることがわかりました。
今回の研究成果により、難治性の角膜疾患に対して、iPS細胞からの分化誘導の高効率化につながることが強く期待されます。
本研究成果は、2016年4月28日12:00 pm ESTに米国科学雑誌(Cell Reports)のオンライン電子版で公開されました。
ポイント
- OVOL2がヒト角膜上皮の上皮性維持に関与していることを発見
- OVOL2は線維芽細胞から角膜上皮細胞への分化転換に寄与
- OVOL2は角膜上皮細胞の上皮性を維持している
- 外胚葉からの神経系列と皮膚系列の分化に上皮間葉転換メカニズムが関与
日常生活を営む中で、外界からの情報の80%以上を視覚に頼っているといわれています。そして視覚に必要な角膜がどのような分子により恒常性が維持されているのか、そのメカニズムはこれまで明らかではありませんでした。胚が発生する過程では、外胚葉は神経外胚葉と表層外胚葉に分かれ、後者から角膜は作られます。神経外胚葉由来の神経細胞と表層外胚葉由来の角膜上皮細胞はどちらも同じマスター転写因子PAX6が働いていることが知られており、遺伝子発現上は似た細胞といえます。これらの細胞を分けるメカニズムを明らかにできれば、iPS細胞などから角膜上皮細胞を作出する技術開発に貢献できると考えられます。近年、細胞の分化には転写因子が大きな役割を果たすことがわかってきました。神経外胚葉由来の細胞では分化を規定する転写因子が多く報告されていますが、表層外胚葉由来細胞では多くありません。そこで本研究では、角膜上皮細胞の分化を規定する転写因子の同定を試みました。
1)角膜上皮機能を維持している分子の網羅的スクリーニング
角膜上皮細胞の性質を決めている分子を見つけるために、マイクロアレイ(注4)による発現解析を行い、角膜上皮で特異的に発現している転写因子を絞り込みました。さらに、CiRAの升井講師が独自に開発したiPS干渉法を用いて、角膜上皮としての性質を決定づける分子として、OVOL2を含む6つの転写因子セットに絞り込みました。
2)OVOL2を含む6つの転写因子は角膜上皮発現プロファイルを誘導
OVOL2を含む6つの転写因子セットをヒト皮膚線維芽細胞に導入することにより、およそ2週間で角膜上皮様の細胞が誘導されてきました(誘導細胞)。誘導細胞では、角膜上皮に特異的なタンパク質であるケラチン3および12、上皮系に特徴的なタンパク質であるE-カドヘリンの発現を認めました(図1)。さらに、遺伝子全体の発現もヒト角膜上皮細胞に近くなっていました。
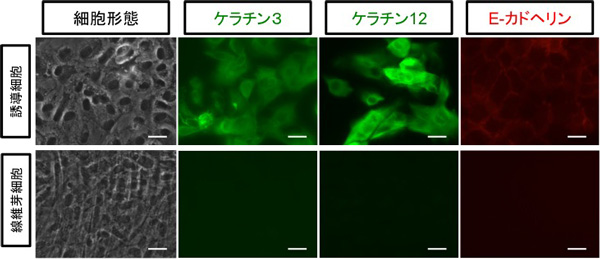
図1. 誘導細胞では角膜上皮特異的マーカーであるケラチン3、
ケラチン12、E-カドヘリンの発現を認める。
3) OVOL2は角膜上皮の上皮機能維持に働く
6つの転写因子のうち、角膜上皮における機能が全く知られていなかったOVOL2について、ヒト角膜上皮細胞における機能解析をおこないました。角膜上皮細胞にsiRNA(注5)を作用させてOVOL2のノックダウンを行ったところ、細胞形態が線維芽細胞様に変化しました。また、角膜上皮特異的なタンパク質であるケラチン12およびE-カドヘリンの発現の低下を認めました(図2)。さらに角膜上皮バリア機能が、顕著に低下しました(図3)。このことは、角膜上皮細胞に特徴的な遺伝子発現を制御する因子としてOVOL2を同定できた事を示します。
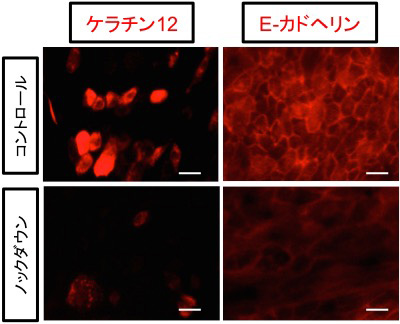
図2. OVOL2のノックダウンにより角膜上皮特異的マーカーであるケラチン12およびE-カドヘリンの発現が低下する
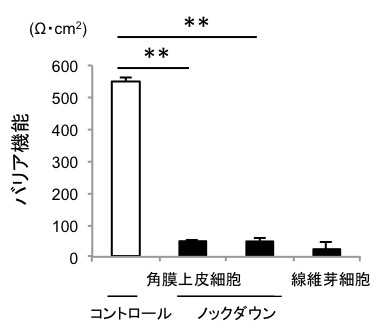
図3. OVOL2のノックダウンにより角膜上皮機能の
1つであるバリア機能が低下する
4)OVOL2は神経外胚葉と表層外胚葉間の分化状態を制御している
公開されている遺伝子発現データを再解析したところ、神経外胚葉由来細胞ではおしなべて間葉系細胞に特徴的な遺伝子(間葉遺伝子)が発現し、上皮に特徴的な遺伝子(上皮遺伝子)が抑制されていることがわかりました。間葉遺伝子と上皮遺伝子は、相互に抑制することが知られています。表層外胚葉由来の角膜上皮細胞においてOVOL2をノックダウンすると、間葉遺伝子と神経系遺伝子の発現が上昇し、神経外胚葉の様な発現パターンを示しました。反対に、神経外胚葉由来の細胞である神経細胞にOVOL2を導入したところ、誘導された細胞は上皮様の形態を呈し(図4)、角膜上皮特異的マーカーであるケラチン12およびE-カドヘリンの発現が上昇し、角膜上皮細胞の性質を示しました(図5)。また、この遺伝子発現の上昇は間葉遺伝子であるZeb1の発現により抑制されることがわかりました(図5)。このようなダイナミックな遺伝子発現の変化は、発生段階で上皮細胞が間葉系細胞へと変化する現象である、上皮間葉転換においても見られる現象です。このことは、OVOL2が上皮間葉転換メカニズムを介して角膜上皮細胞を維持していることを示しています。また、神経外胚葉由来細胞と表層外胚葉由来細胞が間葉・上皮遺伝子の相互抑制機構によって隔てられていることを示唆しています。
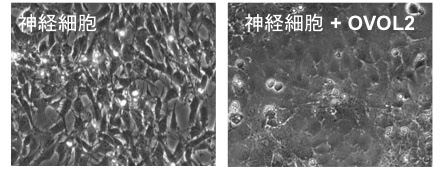
図4. OVOL2の導入により上皮系細胞に分化転換した
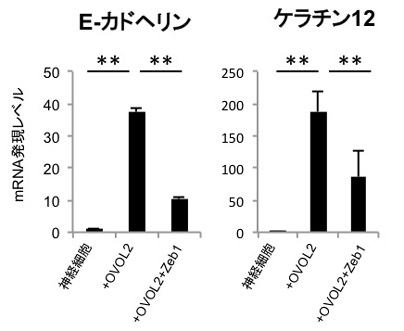
図5. 誘導細胞はE-カドヘリンおよびケラチン12の発現上昇を認め、
間葉系遺伝子であるZeb1の強制発現によって、発現は抑制された
OVOL2は、角膜上皮のバリア機能を含めた上皮性を維持しており、上皮間葉転換を介して制御している事が明らかになりました。また、神経外胚葉由来細胞と表層外胚葉由来細胞とが、間葉遺伝子と上皮遺伝子の間にみられる相互抑制的なはたらきによって隔てられている示唆が得られました(図6)。一般に、異なる種類の細胞の間において、上皮遺伝子と間葉遺伝子のような相互抑制的な遺伝子が、他にも存在する可能性が考えられます。このように分化に必要な転写因子セットが解明されることにより、様々な細胞への分化転換を可能とするメカニズムの解明へつながります。
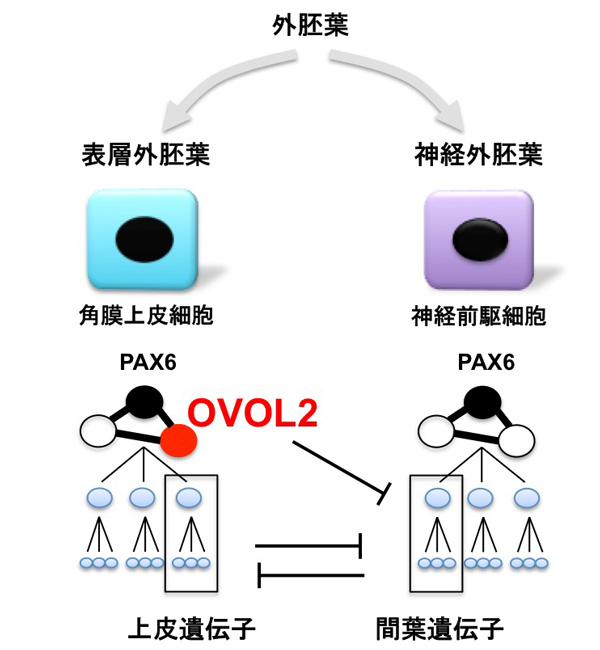
図6. OVOL2は上皮間葉転換の抑制を介して角膜上皮細胞を維持する
また本研究の成果は、角膜の医療につながる知見を与えます。Stevens-Johnson症候群、眼類天庖蒼、熱化学外傷などの角膜上皮幹細胞が枯渇してしまうような最重症眼表面疾患に対して、培養口腔粘膜上皮細胞(注6)を用いた再生医療が行われています。しかし、培養口腔粘膜上皮は角膜上皮とは性質が異なるため、移植手術の効果が限定的です。また、iPS/ES細胞から角膜上皮細胞への分化誘導は培養期間が長く、誘導効率が低いといった課題があります。本研究結果により、角膜上皮細胞の特異性を維持している分子を解明し、短期間で高効率に高品質な角膜上皮細胞を作製できることが期待されます。
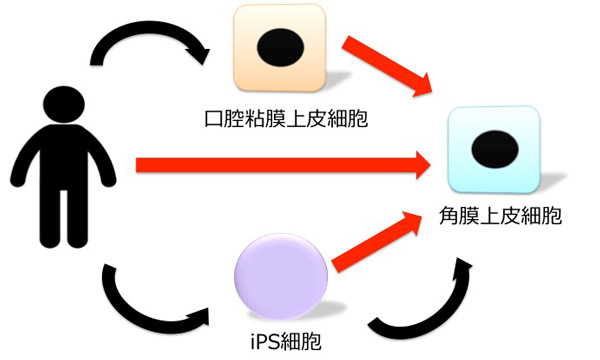
・短期間 ・高効率 ・高品質
図7. 本研究の結果から、様々な細胞から短期間で高効率に、
高品質な角膜上皮細胞を作製することが期待される
本研究は、主として下記の期間より資金的支援を受けて実施されました。
- 科学技術振興機構(JST) CREST
- 日本学術振興会(JSPS)科学研究費補助金
- 日本医療研究開発機構(AMED)
再生医療実現拠点ネットワークプログラム「iPS細胞研究中核拠点」 - iPS細胞研究基金
- 内閣府 最先端研究開発支援プログラム(FIRST)
- 論文名
OVOL2 maintains the transcriptional program of human corneal epithelium by suppressing epithelial-to-mesenchymal transition - ジャーナル名
Cell Reports 15:1-10 - 著者
Koji Kitazawa, Takafusa Hikichi, Takahiro Nakamura, Kanae Mitsunaga, Azusa Tanaka, Masahiro Nakamura, Tatsuya Yamakawa, Shiori Furukawa, Mieko Takasaka, Naoki Goshima, Akira Watanabe, Keisuke Okita, Satoshi Kawasaki, Morio Ueno, Shigeru Kinoshita* and Shinji Masui*(以上、全員記載)
* 責任著者
参照URL Cell Reports誌(http://cellreports.cell.com)
<用語説明>
-
注1. iPS干渉法
初期化を阻害する転写因子が分化を促進するメカニズム*を利用して行うスクリーニング方法。
* Hikichi T, Matoba R, Ikeda T, (Masui S) et al. Transcription factors interfering with dedifferentiation induce cell type-specific transcriptional profiles. Proc. Natl. Acad. Sci. USA. 2013 Apr 16;110(16):6412-7.
-
注2. ノックダウン
人為的に標的遺伝子の発現レベルを抑制すること。
- 注3. 上皮間葉転換
上皮細胞が周囲の細胞との接着機能を失い、遊走・浸潤能を獲得して間葉系の細胞へと変化すること。発生の段階で多様な組織を作る上で重要な働きをしている。 -
注4. マイクロアレイ
一度に膨大な数のDNAやたんぱく質を網羅的に検査することができる解析技術。
-
注5. siRNA (small interfering RNA)
21-23塩基対からなる低分子二本鎖RNAで、細胞内に導入する事で遺伝子発現を抑制する。
-
注6. 培養口腔粘膜上皮細胞
角膜上皮幹細胞の代替細胞としてすでに臨床応用されていてその有効性が確認されている一方で、長期観察では、角膜内への血管侵入やバリア機能が低下、再混濁などの問題が指摘されている。






















