
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2017年8月31日
パーキンソン病霊長類モデルにおけるヒトiPS細胞由来ドパミン神経前駆細胞の移植の有効性と安全性の確認
ポイント
- パーキンソン病霊長類モデル(サル)にヒトiPS細胞由来ドパミン神経前駆細胞注1)を移植し、術後のサルの行動解析によりパーキンソン病の症状が軽減されていることを観測した。
- 移植したヒトiPS細胞由来ドパミン神経前駆細胞が脳内に生着し機能していることを、MRI注2)とPET注3)および脳切片の組織学的解析によって確認した。
- 少なくとも移植後2年以内において脳内で腫瘍を形成しないことを確認した。
パーキンソン病ではドパミン神経細胞が減少することにより様々な運動症状が起こります。iPS細胞由来のドパミン神経前駆細胞を脳に移植することによってその症状を軽減する治療法開発を目指した研究が行われてきました。治療法として確立するには、移植した細胞が長期間にわたって機能すること、安全性が確保できることを検証することが必要ですが、これまでヒトiPS細胞由来のドパミン神経前駆細胞を用いたパーキンソン病霊長類モデルでの長期解析の結果は報告されていませんでした。
今回、菊地哲広研究員、髙橋淳教授(京都大学CiRA臨床応用研究部門)らの研究グループは、理化学研究所ライフサイエンス技術基盤研究センター等との共同研究により、パーキンソン病霊長類モデル(サル)にiPS細胞由来ドパミン神経前駆細胞を移植することによって、治療法の有効性と安全性の確認を行いました。
まず、ヒトiPS細胞由来ドパミン神経前駆細胞をパーキンソン病モデルのサルの脳に移植し、移植後のサルの行動解析からパーキンソン病の症状が軽減されていることを観測しました。この際、パーキンソン病患者由来、また、健康な人由来のiPS細胞から作製したドパミン神経前駆細胞のいずれを移植した場合においても同様の結果が確認されました。次に、移植した細胞が脳内に生着し機能していることをMRIとPET画像を用いて調べ、後に摘出した脳の細胞組織の解析でMRIとPET画像が有効であることを確認しました。さらに、少なくとも移植後2年以内において脳内で腫瘍を形成していないことを確認しました。
本研究で得られた結果は、ヒトiPS細胞由来のドパミン神経前駆細胞をパーキンソン病患者に移植する治療法が有効かつ安全である可能性を示しています。
この研究成果は2017年8月30日午後6時(英国時間:日本時間8月31日午前2時)に英国科学誌「Nature」でオンライン公開されました。
パーキンソン病は、脳のドパミン神経細胞が減少し、それらの細胞が産生するドパミン量が減ることで、手足の震えや体のこわばり、運動減少などの症状が出る進行性の神経難病です。従来の薬物や電極を脳に植え込む治療法である程度の症状の改善はできますが、それらの治療法ではドパミン神経細胞そのものの減少を食い止めることはできず、病状の悪化に伴い症状の改善が困難になります。
そこで、ドパミン神経前駆細胞を脳に移植することで、ドパミンの産生工場を増やし、パーキンソン病の症状の改善を目指す治療法開発に期待が寄せられています。これまでヒトES細胞やiPS細胞由来のドパミン神経前駆細胞をパーキンソン病モデルラットやサルの脳に移植する研究が行われ、病状の改善が報告されています。
しかし、こうした細胞移植が治療法として確立するには、移植した細胞が長期間にわたって機能するのか、また、安全性が確保できるかどうかの検証が必要です。これまで、ヒトiPS細胞由来ドパミン神経前駆細胞を移植した霊長類モデルでの長期解析の結果は、報告されていませんでした。
1)パーキンソン病モデルのサルを用いた行動解析(有効性の確認)
本研究では、まずヒトiPS細胞からドパミン神経前駆細胞を作製しました。そして、以前に髙橋教授らのグループ(土井ら 2014)が開発した「コリン」というタンパク質を発現している細胞を選別する方法で、混在する初期神経幹細胞を除去し、目的の中脳ドパミン神経前駆細胞を濃縮しました。なお、この手法を用いたパーキンソン病モデルラットの実験では、細胞移植後に行動異常が改善し、かつ腫瘍形成が認められないことを報告しています。
作製・純化したドパミン神経前駆細胞をパーキンソン病モデルのカニクイザルの脳に移植しました。この際、パーキンソン病患者由来のiPS細胞から作製したドパミン神経前駆細胞は健康な人由来のものより脆弱である可能性もあるため、双方をそれぞれサルに移植し、有効性を検証しました。
移植後の神経症状を定量的に測定するため、パーキンソン病特有の症状を数値化したパーキンソン病スコアを定義し(表1)、パーキンソン病スコアを用いてサルの行動を観測しました。すると、移植後の経過によってパーキンソン病スコアが改善されている結果を得ました(図1a)。これは、移植後時間が経つにつれパーキンソン病の症状が軽減されている事を意味します。この結果は、健康な人由来iPS細胞からのドパミン神経前駆細胞を移植したグループとパーキンソン患者由来iPS細胞からのドパミン神経前駆細胞を移植したグループとで違いはありませんでした。
さらに、移植後のサルの様子をビデオ撮影し、90分間の動作を解析しました。すると、移植後のサルにおいて有意な動作の増加を確認しました(図1b)。

表1:パーキンソン病(PD)モデルサルのPDスコアの定義
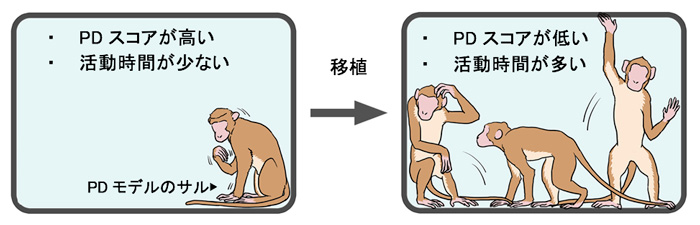
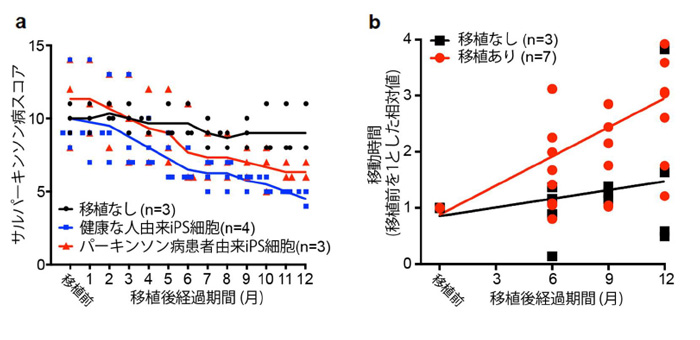
図1:パーキンソン病モデルサルの行動解析
(a)表1で定義したパーキンソン病スコアを用いた、パーキンソン病モデルサルの観測結果。
(b)サルの行動時間の解析結果。閾値を5000ピクセル/0.033秒としたときの90分間の動画のピクセル変化を示した。
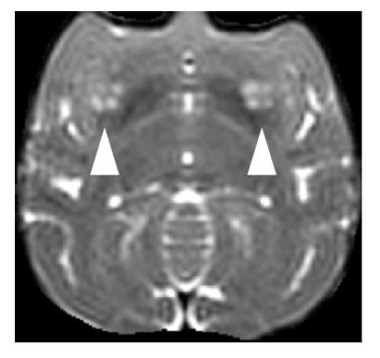
図2:移植後のサルのMRI画像
(矢印が細胞移植部分を示す)
2)MRIとPET画像による移植した細胞の分布と機能の確認(安全性の確認)
次に、iPS細胞から作製したドパミン神経細胞の安全性を確かめるため、移植後最長24ヶ月までのMRIとPET画像(PET薬剤として[18F]DOPA注4)を投与)を使い、移植した細胞が生着しているか調べました。
まず、細胞を移植した部分の体積をMRI画像(図2)から術後経過を追って算出しました(図3)。すると、術後9ヶ月程度まで移植部分が徐々に大きくなり、その後増大が止まることが分かりました。
観察終了時の移植組織の体積は39.4±21.2mm3 (平均±標準偏差)となり、移植後に周辺の組織・構造物を圧迫・変形する可能性は低いと考えられました。また、脳切片の組織学的解析では細胞増殖や腫瘍性病変は認められませんでした。
さらに、MRI画像で算出した移植部分の体積は、後に摘出した脳切片のSTEM121(ヒト細胞特異的マーカー)による免疫染色部分とほぼ一致することを確認できたので、MRI画像が移植片の分布形態を検査する上で有用であることが分かりました。
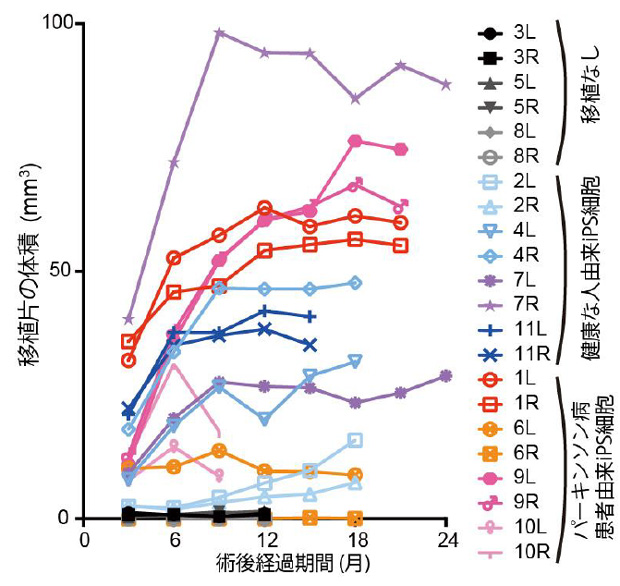
図3:MRI画像により算出した細胞移植部分の体積の推移
これらの体積は細胞増殖や移植細胞の拡散および神経突起伸展などを反映していると考えられる。LRは左右を示す。
最後に、移植した細胞が脳内でドパミン神経細胞としての機能を果たしているかを調べました。移植後のサルの脳において免疫染色によりドパミン神経細胞に特徴的なマーカーを検出できたことを確認し(図4)、[18F]DOPA -PETを用いてドパミン合成を経時的に調べました。 すると、移植をした脳の被殻(ひかく)において、ドパミンの合成が時間経過と共に増加していく様子が分かりました。この結果と神経細胞の生着との間に相関関係があることが示されたため、ドパミン神経細胞が脳内で機能していると考えられました。また、この結果より[18F]DOPA-PETがドパミン神経細胞の機能を調べる上で有用であることが示されました。
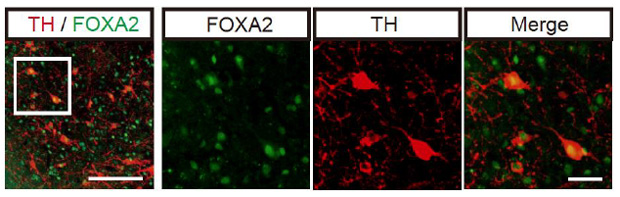
図4:サルの神経細胞の免疫染色
TH, FOXA2:ドパミン神経細胞マーカー
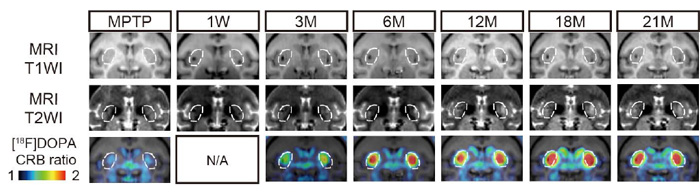
図5:MRIとPET画像の術後経過
白の点線内が脳の被殻(ひかく)にドパミン神経前駆細胞を移植した部分。下側のPET画像では被殻において、赤色で示した[18F]DOPAが多く取り込まれている部分が経時的によって増大していく様子が分かる。
基礎研究の成果をどのような過程を経て臨床につなげさらに治療法として確立させるかは、医学研究において大きな課題です。それは臓器や疾患によって違うであろうし、正解はないのかもしれません。本研究は、その課題に対する本研究グループなりの回答です。すなわち、霊長類モデルを用いて実際の臨床と同じ移植を行い、組織学的解析も含めてその有効性と安全性を検証する。その検証を経て次は臨床での治験に移行するというものです。
本研究では、髙橋淳教授らの研究グループが2014年に確立した、パーキンソン病に対する細胞移植の非臨床試験のプロトコールを霊長類モデルに用い、長期の経過観察を行うことによって、iPS細胞由来ドパミン神経前駆細胞移植の安全性や有効性をより詳細に確認することができました。また、iPS細胞を用いた細胞移植には、自家移植と他家移植の双方が想定されますが、パーキンソン病患者由来のiPS細胞から作製したドパミン神経前駆細胞、健康な人由来のiPS細胞から作製したドパミン神経前駆細胞いずれを移植した場合も安全性高く脳内で機能することが分かりました。これらの結果に基づき、iPS細胞を用いたパーキンソン病の細胞移植療法の治験に向けて申請準備を進めたいと考えています。
- 論文名
Human iPS cell-derived dopaminergic neurons function in a primate Parkinson's disease model - ジャーナル名
Nature - 著者
Tetsuhiro Kikuchi1, Asuka Morizane1, Daisuke Doi1, Hiroaki Magotani1, Hirotaka Onoe2, Takuya Hayashi2, Hiroshi Mizuma2, Sayuki Takara2, Ryosuke Takahashi3, Haruhisa Inoue4, Satoshi Morita5, Michio Yamamoto5, Keisuke Okita6, Masato Nakagawa6, Malin Parmar7, Jun Takahashi1,8 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA) 臨床応用研究部門
- 理化学研究所ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門
- 京都大学大学院医学研究科 脳病態生理学講座 臨床神経学(神経内科)
- 京都大学iPS細胞研究所(CiRA) 増殖分化機構研究部門
- 京都大学大学院医学研究科 医学統計生物情報学
- 京都大学iPS細胞研究所(CiRA) 未来生命科学開拓部門
- ルンド大学ワレンベルグ神経科学センター、ルンド幹細胞センター
- 京都大学大学院医学研究科 脳神経外科
本研究は、下記機関より資金的支援を受けて実施されました。
- 文部科学省 再生医療の実現化ハイウェイ
- AMED 再生医療実現拠点ネットワークプログラム(疾患・組織別実用化研究拠点)
注1) ドパミン神経前駆細胞
神経伝達物質としてドパミンを放出するドパミン神経細胞の前駆細胞。パーキンソン病モデル動物を用いた研究から、ドパミン神経前駆細胞を移植することによって脳内に成熟ドパミン神経細胞を効率的に生着させられることが明らかになっている
注2) MRI(核磁気共鳴画像法)
核磁気共鳴という原理を利用して生体内の断面画像を解析できる方法。被曝の心配がなく、経時的な3次元情報を得ることもできる。
注3) PET(陽電子放出断層撮影)
プラスの電気を帯びた電子を放出する同位元素(アイソトープ)で標識された薬剤(PET薬剤)を注射し、体内分布を特殊なカメラで断層撮影する装置。がんの性質などの検査に有用な診断機器。
注4) [18F]DOPA ([18F]fluoro-l-dopa)
ドパミンの前駆物質であるドーパの標識化合物である。[18F]DOPA-PETはPETを用いて[18F]DOPAを測定することにより、ドパミンの代謝の様子を評価できる。






















