
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2017年9月28日
ヒトiPS/ES細胞からエリスロポエチン産生細胞の作製に成功 〜腎性貧血に対する細胞療法の可能性〜
ポイント
- エリスロポエチン(EPO)注1産生細胞の作製に世界で初めて成功した
- 腎性貧血注2に対して細胞療法の可能性を初めて示した
- 新しい貧血治療薬を開発するツールとしても期待できる
人見浩史研究員(香川大学医学部薬理学、CiRA増殖分化機構研究部門)、西山成教授(香川大学医学部薬理学)および長船健二教授(CiRA増殖分化機構研究部門)らの研究グループは、ヒトiPS/ES細胞から、EPOを産生する細胞の作製に成功しました。
赤血球の産生を促進する因子であるEPOは腎臓にあるEPO産生細胞で作られます。腎臓に障害が生じるとEPOの産生が減り、腎性貧血となります。これまでは腎性貧血の治療法として人工ヒトEPO製剤が使用されてきましたが、EPOの血中濃度を一定に保つことが難しいことや、EPO製剤が高価であることなど課題もありました。今回の研究ではヒトiPS/ES細胞からEPO産生細胞を作製する方法を世界で初めて確立し、この細胞を腎性貧血モデルマウスに移植すると安定的なEPOの分泌と治療効果が観察され、腎性貧血に対する細胞療法の可能性を示しました。また、今回開発した細胞は、EPO産生を刺激する薬剤のスクリーニングにも利用することができ、腎性貧血の新たな治療薬開発にも有用であると期待されます。
本研究成果は2017年9月27日(米国東部時間)に「Science Translational Medicine」で公開されました。
全身に酸素を運ぶ赤血球は、EPOという物質の血中濃度に応じて産生量が調節されています。EPOは胎児期には肝臓の細胞から作られますが、成人では腎臓にあるEPO産生細胞から放出されます。そのため、腎臓に障害が発生するとEPO産生細胞の働きが弱くなり、EPOの量が減少、赤血球の産生量も低下し、貧血状態になります。これを腎性貧血といいます。これまではヒトのEPOを人工的に作った製剤が開発されており、それを腎性貧血の患者さんに注射で投与することにより赤血球の産生を促していました。しかし、そもそも製剤が高額であることと、正常な状態のようにある程度一定の血中濃度になるよう調整するのが難しい、またEPOに対する抗体が体内で作られてしまうことがあるなど課題もありました。そこで研究グループはヒトiPS/ES細胞からEPO産生細胞を作ることを試みました。
1) ヒトiPS/ES細胞からEPO産生細胞を作製した
ヒトiPS細胞(253G4)を中胚葉や内胚葉注3へと誘導する因子であるアクチビンなどを加えた培養液で7日間培養した後、別の培養液に変更して14日間培養しEPO産生細胞を作製しました。この細胞はEPOに対する抗体で染色することができ、EPOを産生していることがわかりました(Fig. 1)。
他のiPS細胞7種(201B6, 201B7, 253G1, 585A1, 604A3, 606A1, 606B1)およびES細胞2種(KhES3, H9)でも、細胞によって産生能力に違いは見られましたが、同じ方法でEPO産生細胞を作製することができました。
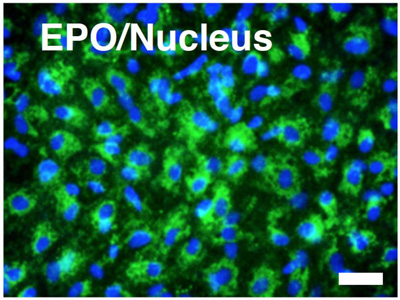
Fig. 1 EPO産生細胞の確認
緑:EPO
青:核
スケールバー:40 μm
画面中の緑色に染色されている細胞はEPOを
産生していることがわかる。
2) 作製したEPO産生細胞をマウスに移植すると腎性貧血の症状が改善された
薬剤投与により腎不全と腎性貧血を起こしたマウスの腎臓に、ヒトiPS細胞由来のEPO産生細胞(5.0×105個の塊を20個、合計1.0×107個)を移植しました。血液中の赤血球の量を表す指標であるヘマトクリット値(Hct)を計測すると、移植後4週目には正常な値にまで到達し、28週目まで効果が持続しました(Fig. 2)。これらの結果により、腎性貧血に対してiPS/ES細胞由来のEPO産生細胞を移植するという治療の可能性が示されました。
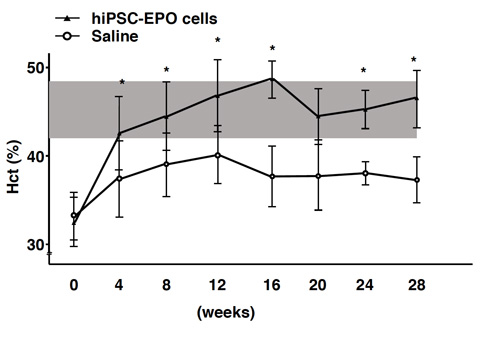
Fig. 2 iPS細胞由来のEPO産生細胞の移植効果
▲:ヒトiPS細胞由来のEPO産生細胞を移植した群
○:細胞を移植していない群
灰色の領域は正常なマウスでのHct値の範囲を示している。
値は平均値±標準誤差を表す(n=4)、 *p<0.05 vs Saline
3) 低酸素刺激や貧血治療の候補薬剤に反応してEPO分泌が促進された
生体内のEPO産生細胞は貧血による低酸素刺激に反応してEPO分泌を増やすことが知られています。ヒトiPS細胞由来のEPO産生細胞が同じ性質を有しているかどうかを確認したところ、酸素濃度1%の低酸素刺激に反応してEPO産生量と分泌量を増やすことが分かりました(Fig. 3A)。また、EPO分泌を促進することが知られている貧血治療薬候補の薬剤(DFOおよびFG4592)にも反応してEPO産生量と分泌量を増やすことも確認しました(Fig. 3B)。これらの結果により、iPS/ES細胞由来のEPO産生細胞を新しい貧血治療薬を開発するツールとして使用できる可能性が示されました。
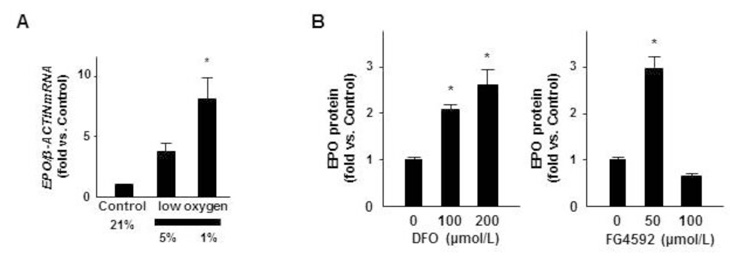
Fig. 3 iPS細胞由来のEPO産生細胞の低酸素や薬剤に対する反応
(A) 21%の正常酸素および5%と1%の低酸素刺激に対するEPO産生量(mRNA量)の変化。
(B) EPO分泌を増やすことが知られる2種の薬剤に対するEPO分泌量(タンパク質量)の変化。
値は平均値±標準誤差を表す(n=4)、 *p<0.05 vs control
今回の研究により、ヒトiPS/ES細胞からEPO産生細胞の作製に成功し、その細胞を用いて腎性貧血の細胞治療の可能性を示すことができました。また、iPS/ES細胞由来のEPO産生細胞は腎性貧血の治療薬スクリーニングにも有用であると考えられます。
- 論文名
"Human pluripotent stem cell-derived erythropoietin-producing cells ameliorate renal anemia in mice" - ジャーナル名
Science Translational Medicine - 著者
Hirofumi Hitomi1,2, Tomoko Kasahara1, Naoko Katagiri1, Azusa Hoshina1, Shin-Ichi Mae1, Maki Kotaka1, Takafumi Toyohara1, Asadur Rahman2, Daisuke Nakano2, Akira Niwa1, Megumu K. Saito1, Tatsutoshi Nakahata1, Akira Nishiyama2, Kenji Osafune1* - 著者の所属機関
- 京都大学iPS細胞研究所
- 香川大学医学部薬理学
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本医療研究開発機構(AMED) 再生医療実現拠点ネットワークプログラム 「iPS細胞研究中核拠点」
- 文部科学省 科学研究費補助金 (22790786, 22790792, 24591204 and 15K09266)
- iPS細胞研究基金
- Sanju Alumni Research Grant
- かなえ医薬振興財団
- 第一三共生命科学研究振興財団
注1) エリスロポエチン(EPO)
赤血球の産生を促進する因子の一つであるタンパク質。胎児期には肝臓で産生されるが、成人の場合はほぼ腎臓でのみ産生される。生体内にあるものと全く同じものではないが、似た構造のタンパク質を人工的に作ることができるようになっており、腎性貧血の薬として使われている。
注2) 腎性貧血
腎臓の働きが低下することが原因で、EPOの分泌が減り、赤血球を作る能力が低下し、貧血状態となっていること。
注3) 中胚葉・内胚葉
動物の発生初期にみられる細胞の名前。内胚葉は将来消化管や肝臓・すい臓といった臓器の細胞に分化する。中胚葉は将来筋肉や血液、腎臓などの細胞に分化する。






















