
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2020年6月9日
細胞周期を止めて、より正確なゲノム編集を行う
CRISPR/Cas9などのゲノム編集技術1)は、遺伝子変異を人工的に作り出すことが可能です。しかし、その技術はDNAの長さを変えることはできず、よってDNAの長さの違いによって生まれる病気のモデルを作るには課題があると言われています。今回、トーマス・ルーク・モーリセン大学院生(京都大学CiRA未来生命科学開拓部門)、クヌート・ウォルツェン准教授(京都大学CiRA同部門)の研究グループは、iPS細胞を使って、細胞周期に変化をもたらす刺激(化学ショックまたは低温度ショック)を活用した、より精度の高いゲノム編集技術を開発することに成功しました。
この研究成果は、2020年6月8日(日本時間)に「Nature Communications」でオンライン公開されました。
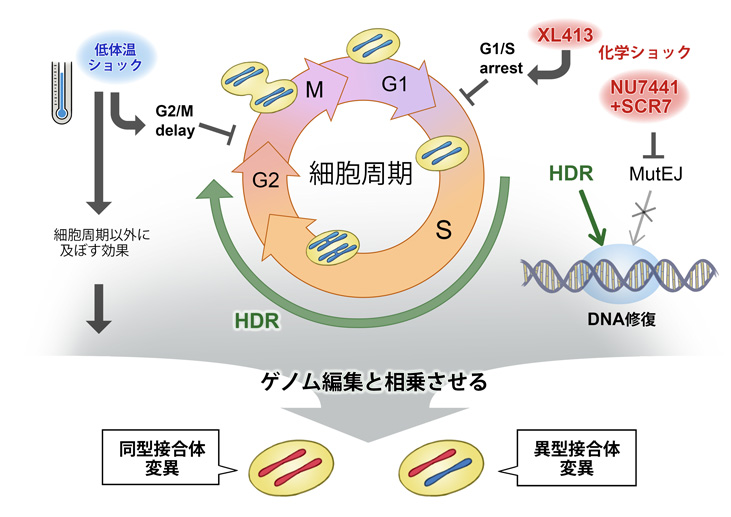
DNAは生命を形づくる重要な物質ですが、驚くほど脆く、それゆえに損傷を受けると修復する機能が細胞には備わっています。DNAの修復機構の代表的なものに相同組換え修復(homology directed repair: HDR)2)と非相同末端結合(non homologous end joining: NHEJ)3)があります。NHEJは比較的簡単で修復が早いですが、ランダムにDNAの部位が直されるので、間違って修復されることが多いです。一方、HDRは「あらかじめ方向性が定まった」DNAを狙って修復を行うので、頻度が少なく難しいですがより正確性が高い機構と言えます。
HDRは修復の過程で一時的にDNAの複製が必要となるため、細胞周期4)のなかでも一部の期間にしか働きませんが、NHEJはいつでも働きます。この偏りを変えるため、研究グループは細胞にCRISPR-Cas9システム導入直後二日間、通常の培養条件よりも少し低い温度におくこと(低体温ショック)で、HDRの寄与を増やすことに成功しました。これは、細胞周期とは関係のない低体温ショックによる何かしらの効果も考えられますが、低体温ショックが細胞周期をHDRの寄与が高い期間に止めるからだと仮説をたてられます。
さらに、低体温にする実験とは別に、化学的な作用によって細胞周期を止める実験も行い、低体温ショックと同様、HDRの寄与を高めることに成功しました。さらに、NHEJを抑える化学的物質を加えると、よりHDRの寄与が高まりました。
通常、ゲノム編集を行うと、編集後は遺伝子座が同じ対立遺伝子からなる同型接合体となります。しかし、自然には人間の遺伝子は母方と父方それぞれから遺伝子座を継承するので、優性遺伝疾患や多因子性疾患の場合、遺伝子座が異なる対立遺伝子からなる異型接合体である可能性が高いです。それゆえ、人工的にゲノム編集を行って正確な病態モデルを作製する場合、異型接合体を作製する技術が求められます。そこで、研究グループは、CRISPR-Cas9システムでゲノム編集を行う際、片方の対立遺伝子に編集が行われないような非表現突然変異を使ったDNA鋳型を用いて異型接合体を作製することに成功しました。さらに、細胞周期に変化をもたらす刺激(化学ショックまたは低温度ショック)を加えると、より異型接合体を作製する効率を高めることができました。
今回、細胞周期をコントロールすることによりDNA修復機構を人工的に操作でき、同型接合体、異型接合体となるゲノム編集が可能になりました。本技術の応用によって、より正確な病態モデルの作製することが期待され、今後の医学研究に大きな影響をもたらします。
- 論文名
Synergistic gene editing in human iPS cells via cell cycle and DNA repair modulation - ジャーナル名
Nature Communications - 著者
Thomas L. Maurissen1,2 and Knut Woltjen2*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
本研究は、下記機関より支援を受けて実施されました。
- The Hubert Tuor Foundation (スイス)
- 大塚敏美育英奨学財団
- 日本医療研究開発機構(AMED)
注1) ゲノム編集技術
人工DNA切断酵素によってゲノムDNAにDNA二本鎖切断を誘導し、その修復過程において、標的遺伝子への欠失や挿入変異を導入(遺伝子ノックアウト)したり、ドナーベクターのゲノム DNA への組み込みを促進することで遺伝子を挿入(遺伝子ノックイン)したりする最先端の遺伝子改変技術。CRISPR (Clustered Regularly Interspaced Short Palindromic Repeat)は、Cas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使い、ガイドRNAのターゲット配列を特異的に切断することができる。
注2) 相同組換え修復(homology directed repair;HDR)
DNAの塩基配列がよく似た部位(相同部位)で起こる組換えを利用した修復機構。
注3) 非相同末端結合(Non-Homologous End-joining ; NHEJ)
二本鎖切断の際、末端を直接繋ぎ合わせてDNA修復を行う機構。DNA末端の接合部において変異が起こりやすい
注4) 細胞周期
一つの細胞が分裂して増殖するとき、細胞のDNAの複製と分配が起こり、核や細胞質が分裂し、二つの娘細胞となる。この一連の事象を細胞周期という。






















