
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2020年8月5日
腎臓オルガノイド技術を用いた遺伝性腎疾患の新たな病態モデルの開発
ポイント
- ゲノム編集技術注1)により常染色体優性多発性嚢胞腎 (ADPKD) 注2)の原因遺伝子であるPKD1遺伝子に変異を持つヒトiPS細胞株を作製した。
- ゲノム編集によるPKD1変異ヒトiPS細胞株、およびADPKD患者さん由来ヒトiPS細胞株を用いて腎臓オルガノイド注3)を作製し、薬剤処理を施すことで培養皿上での腎嚢胞の再現に成功した。
- 腎臓オルガノイドを用いたADPKDの病態モデルは、将来的に治療薬候補の探索的スクリーニング注4)に応用することが期待される。
ADPKDは腎不全注5)の原因となる遺伝性疾患として最多であり、腎臓では嚢胞(液体が貯留した袋状の構造物)が多発し徐々に増大することで、成人期以降に腎機能が低下していきます。近年、腎嚢胞の増大を遅らせる薬剤(トルバプタン)が一部の症例で使用できるようになりましたが、根本的な治療法は開発されておらず、多くの患者さんが最終的に人工透析などの腎代替療法注6)を必要とします。
ADPKDについて、これまで多くの基礎研究がマウスやラットなどの動物モデルを用いて行われてきましたが、十分な発症メカニズムの解明には至っていません。動物モデルを用いた研究では、生物種の違いについて考慮する必要があり、さらにヒトのADPKDと遺伝学的な背景が同一ではない場合が多いことから、ヒト細胞を用いた新たな病態モデルを開発する必要がありました。
今回、清水 達也 共同研究員(筑波大学大学院、CiRA増殖分化機構研究部門)、山縣 邦弘 教授(筑波大学大学院)、長船 健二 教授(CiRA同部門)らの研究グループは、疾患特異的ヒトiPS細胞注7)から作製した腎臓オルガノイドを用いて、ADPKDの腎嚢胞を培養皿上で再現した新たな病態モデルを開発しました。さらに、動物モデルを用いた過去の研究で腎嚢胞の増大抑制効果が確認されている薬剤の影響を調べることで、治療薬候補の探索的スクリーニングにおける今回のモデルの可能性を示しました。
この研究成果は、2020年8月4日に米科学誌「Biochemical and Biophysical Research Communications」で公開されました。
ADPKDは遺伝性腎疾患の中で最も患者数の多い病気であり、世界の末期腎不全症例の4-10%はこの疾患が原因となっています。原因遺伝子としてPKD1またはPKD2が知られており、患者さんでは生まれつきいずれかの遺伝子の2セットあるうちの一方に変異を有しています(ヘテロ変異)。PKD1に変異を持つ症例が約85%と多く、PKD2に変異を持つ症例よりも末期腎不全への進行がやや早いとされています。ヒトのADPKDについて詳しく調べるには、遺伝的な背景が一致するヒトのモデルが望まれます。患者さん由来の細胞や組織を調べることも有用ですが、腎嚢胞が生じる初期にどのようなことが起こっているのかは捉えるのが難しいと考えられます。その点、iPS細胞などの多能性幹細胞注8)から作製したヒトの組織を調べることは、従来の研究にない可能性を有しています。これまで、PKD1またはPKD2のゲノム編集を行ったホモ変異(2セットある遺伝子の両方に変異を有する)のヒトES細胞を用いて腎臓オルガノイドを作製し、培養皿上で嚢胞構造を再現した報告はありましたが、iPS細胞、特に患者さん由来ヒトiPS細胞を用いて腎嚢胞を再現した報告はありませんでした。そこで、長船教授らの研究グループは、ADPKD特異的ヒトiPS細胞から作製した腎臓オルガノイドを用いて、新たな病態モデルを開発することを目指しました。
1)ゲノム編集によりPKD1変異ヒトiPS細胞株を樹立し、腎臓オルガノイドに分化誘導後、薬剤処理を施すことで培養皿上での腎嚢胞の再現に成功した。
PKD1の変異によって腎臓オルガノイドにどのような影響が出るか調べるため、健常者由来のヒトiPS細胞に対してゲノム編集を行い、PKD1変異ヒトiPS細胞株(ヘテロ変異、およびホモ変異)を樹立しました。さらに、当研究グループで開発された分化誘導法を用いてPKD1変異ヒトiPS細胞株から腎臓オルガノイドを作製し、病的な変化がないか調べました。これまでの研究で、ADPKDでは細胞内のcAMPという分子の量が増加していると報告されています。PKD1変異ヒトiPS細胞株から作製された腎臓オルガノイドは、それだけでは明らかな異常はみられませんでしたが(図1上段)、細胞内のcAMPを増加させるフォルスコリンという薬剤で処理することで、腎臓オルガノイド内に嚢胞構造が再現されました(図1下段、白く抜けている部分が嚢胞)。PKD1ホモ変異株(PKD1-/-)と比べると差は小さいものの、患者さんと同じくPKD1ヘテロ変異(PKD1+/-)の状態でも、嚢胞の面積率が増大することがわかりました。
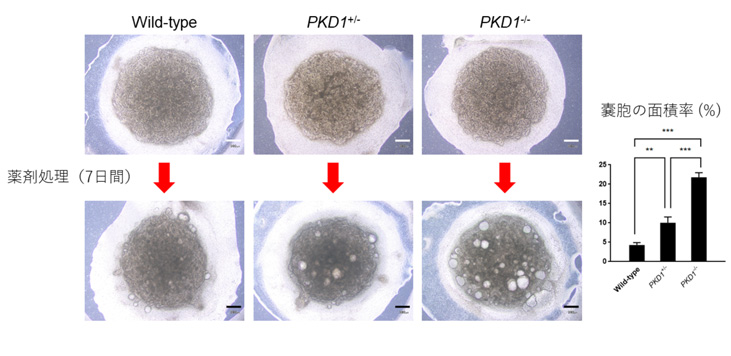
図1:ゲノム編集によるPKD1変異ヒトiPS細胞から作製した腎臓オルガノイド(上段)と
薬剤処理後の嚢胞形成の様子(下段)
左:変異なし(Wild-type)
中央:ヘテロ変異株(PKD1+/-)
右:ホモ変異株(PKD1-/-)
2) ADPKD患者さん由来ヒトiPS細胞株から腎臓オルガノイドを作製し、薬剤処理を施すことで培養皿上での腎嚢胞の再現に成功した
患者さん由来ヒトiPS細胞は、実際の患者さんと同一の遺伝的バックグラウンドを有しており、将来実際にADPKDを発症する可能性を有しています。以前に本研究グループで樹立されたADPKD患者さん由来ヒトiPS細胞株、および健常者由来ヒトiPS細胞株(それぞれ2株ずつ)を用いて腎臓オルガノイドを作製し、同様の実験を行ったところ、ADPKD患者さん由来ヒトiPS細胞株から作製した腎臓オルガノイドでは、健常者由来ヒトiPS細胞株から作製した腎臓オルガノイドよりも、嚢胞の面積率が大きいことがわかりました(図2)。さらに、嚢胞が腎臓オルガノイド中のどのような組織に由来するか免疫染色を行って調べたところ、動物モデルやヒトにおける知見と一致して、尿細管と呼ばれる部位が拡張してできていることがわかりました(図3 アスタリスクや矢印で示す箇所)。
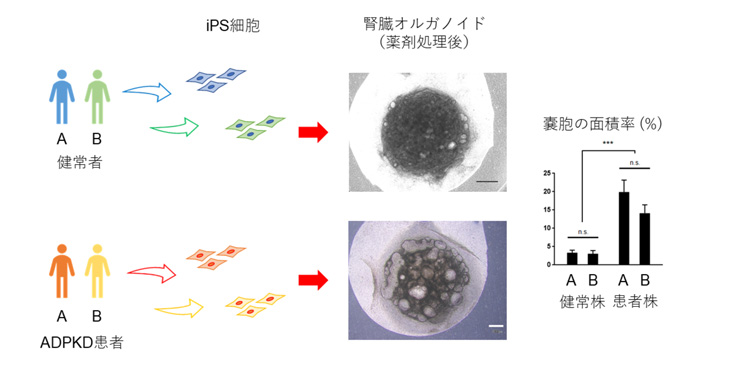
図2:健常者由来iPS細胞と患者さん由来iPS細胞で腎臓オルガノイドの嚢胞形成を比較した
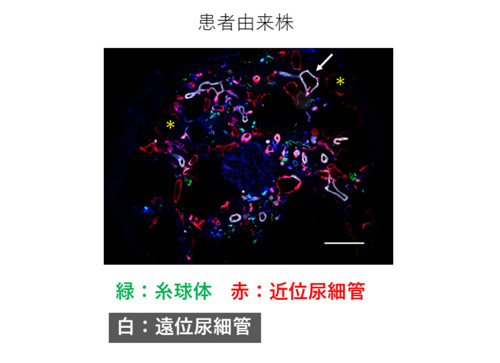
図3:腎臓オルガノイドの嚢胞の由来を示す染色像
3) 患者さん由来ヒトiPS細胞から作製した腎臓オルガノイドを用いて、既報薬剤の嚢胞増大抑制効果を確認した
最後に、今回作製したモデルが病態モデルとしての妥当性を持つか、動物モデルを用いた研究で嚢胞の増大抑制効果が知られている薬剤を用いて調べました。患者さん由来ヒトiPS細胞から作製された腎臓オルガノイドにおける薬剤の効果は、実際の患者さんの腎臓に対する効果を予測することが期待されます。薬剤投与に伴う毒性などの影響を今後評価していく必要がありますが、今回の検討では、過去に嚢胞の増大抑制効果が報告されているCFTR阻害薬およびmTOR阻害薬の投与において、嚢胞の面積率の低下を認め、治療薬候補の探索的スクリーニングにおける今回のモデルの有用性が示唆されました。
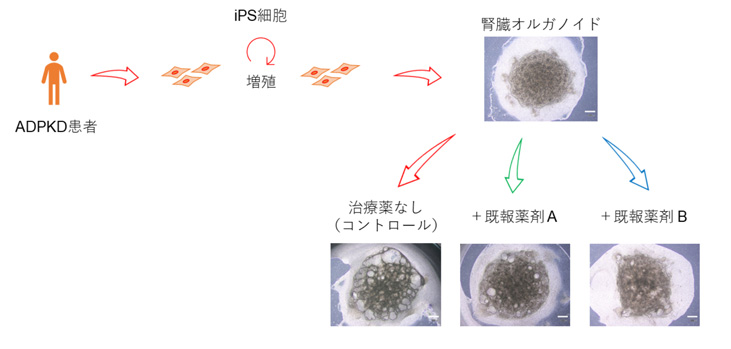
図4:患者さん由来iPS細胞から作製した腎臓オルガノイドを用いて、
既存薬剤の嚢胞増大抑制効果を確認した
既報薬剤A:CFTR阻害薬
既報薬剤B:mTOR阻害薬
疾患特異的ヒトiPS細胞から作製した腎臓オルガノイドを用いて、ADPKDの新規病態モデルを開発しました。また、このようなモデルが将来的に治療薬探索のプラットフォームとして利用できる可能性を示しました。本研究の成果は、ヒトのADPKDの病態解明や、探索的スクリーニングによる治療薬候補の同定に貢献することが期待されます。
- 論文名
A novel ADPKD model using kidney organoids derived from disease-specific human iPSCs - ジャーナル名
Biochemical and Biophysical Research Communications - 著者
Tatsuya Shimizu1,2, Shin-ichi Mae1, Toshikazu Araoka1, Keisuke Okita1, Akitsu Hotta1, Kunihiro Yamagata2, Kenji Osafune1 - 著者の所属機関
- 京都大学iPS細胞研究所 (CiRA) 増殖分化機構研究部門
- 筑波大学大学院 人間総合科学研究科 疾患制御医学専攻 腎臓内科学分野
本研究は、下記機関より支援を受けて実施されました。
-
国立研究開発法人日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム
「技術開発個別課題」、「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」
注1)ゲノム編集技術
ゲノムDNA上の特定標的部位にDNA損傷を起こすことでDNA配列を改変する技術。今回用いたCRISPR/Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats / CRISPR associated protein 9)システムでは、Cas9というDNA切断酵素と、切断させたい場所へCas9を誘導するガイドRNAによって、任意の場所のDNAを切断する。
注2)常染色体優性多発性嚢胞腎(ADPKD)
両側の腎臓に多数の嚢胞が次第に発生・増大して、徐々に腎機能障害が進行する最も頻度の高い遺伝性嚢胞性腎疾患。腎臓以外にも、肝臓や膵臓などに嚢胞が生じることもある。全身の血管にも異常があり、高血圧、脳動脈瘤、心臓の弁異常を伴う頻度が高いことが分かっている。近年、トルバプタンという薬が嚢胞の増大を抑制することが注目されているが、根治的な治療法は現在のところない。
注3)オルガノイド
多能性幹細胞や組織ごとの様々な前駆細胞から作製される、三次元構造をもつミニ臓器のこと。
注4)スクリーニング
多能性幹細胞はほぼ無限に増幅が可能であり、特に患者さん由来ヒトiPS細胞から作製される組織は実際の患者さんの組織と同様の性質を持つことが考えられるため、創薬研究や薬剤毒性評価の大規模スクリーニングのためのプラットフォームとして利用が期待される。
注5)腎不全
腎臓では血液をろ過して尿を作ることで、体内の老廃物を排泄したり、体液のバランスを維持しており、さらに腎臓で作られるホルモンの働きにより、貧血を予防したり骨代謝を保っている。これらの腎臓の機能が失われた状態を腎不全と呼ぶ。
注6)腎代替療法
腎不全が進行すると、機能が低下した腎臓の代わりに血液透析や腹膜透析、腎移植といった治療を行う必要があり、これらの治療法を総称して腎代替療法と呼ぶ。
注7)疾患特異的iPS細胞
疾患に関連した情報を保持したiPS細胞のことを疾患特異的iPS細胞と呼ぶ。実際の患者さんから作製した患者さん由来ヒトiPS細胞のほか、ゲノム編集により遺伝性疾患の原因遺伝子に変異を導入したiPS細胞も、疾患特異的iPS細胞に含めることができる。
注8)多能性幹細胞
iPS細胞(人工多能性幹細胞)やES細胞(胚性幹細胞)など、高い増殖能と、さまざまな種類の細胞に分化することができる多能性をもった細胞。






















