
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2021年6月21日
ヒトのiPS細胞から新生児レベルまで成熟した心筋細胞を作製する
ポイント
- ヒトiPS細胞由来の心筋細胞はこれまで成熟度の低さが課題であった。今回、化合物スクリーニング注1)により心筋細胞の成熟を促進する化合物(ERRγ作動薬注2))を同定した。
- ERRγ作動薬で処理したヒトiPS細胞由来の心筋細胞は、T管構造注3)を有し、構造的、代謝的、電気生理学的に新生児の心筋細胞に相当するレベルにまで成熟した。
- 本手法を用いることで、新生児レベルの心筋細胞を短期間で効率的に得られ、今後の創薬研究や病態モデル、細胞治療などへの応用が期待できる。
三木健嗣(現ハーバード大学兼マサチューセッツ総合病院リサーチフェロー、元CiRA増殖分化機構研究部門特定助教兼T-CiRAプログラム研究員)、出口康平(武田薬品工業株式会社リサーチ、T-CiRAディスカバリー主任研究員)、小圷美聡(CiRA増殖分化機構研究部門兼T-CiRAプログラム研究員)、西本誠之(武田薬品工業株式会社リサーチ、T-CiRAディスカバリー主席研究員)吉田善紀(CiRA増殖分化機構研究部門准教授、 T-CiRAプログラム主任研究員)らの研究グループは、約9000種類の化合物から、エストロゲン関連受容体γ(ERRγ)作動薬がヒトiPS細胞由来心筋細胞の成熟を促進することを発見し、ERRγ作動薬を用いると、T管構造を有する心筋細胞にまで成熟させることを見出しました。
本研究成果は、成熟度の低さが課題であったヒトiPS細胞由来心筋細胞に短期間に、単一の化合物を添加することで、新生児心筋細胞に相当するレベルにまで成熟度が亢進したことを示すものであり、今後、疾患の発症メカニズム解明や新規治療戦略の確立が加速することが期待できる。
この研究成果は2021年6月21日午後6時(日本時間)に英国科学誌「Nature Communications」でオンライン公開されました。
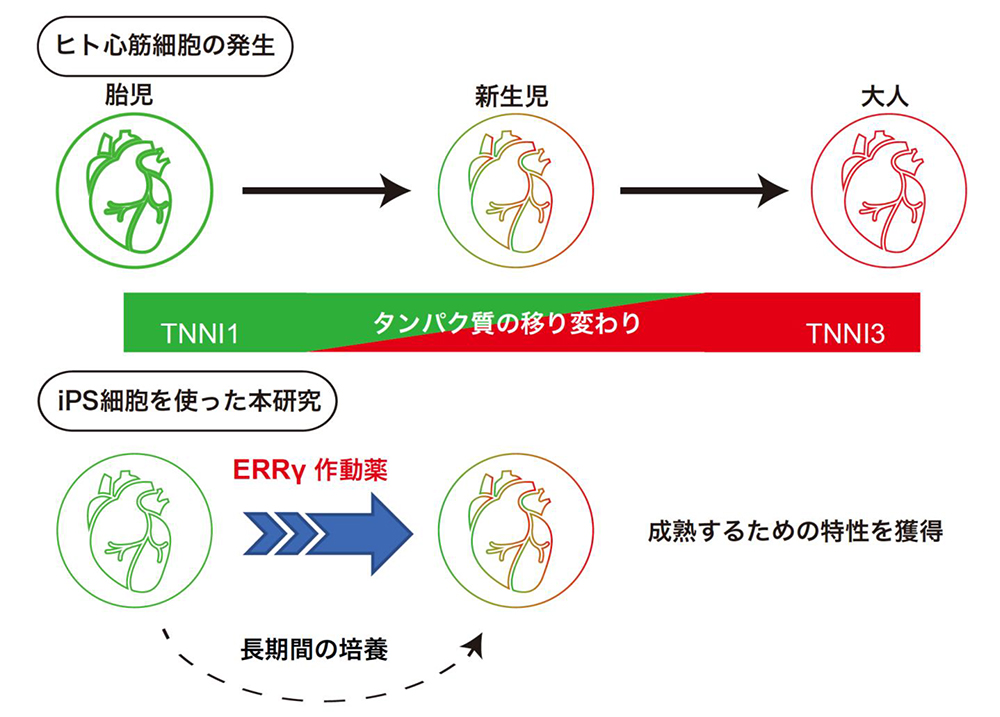
論文概要図
ヒトiPS細胞を含む多能性幹細胞由来の心筋細胞は、様々な心疾患研究や薬剤試験、再生医療への応用が期待される一方、分化して得られる心筋細胞は胎児レベルの心筋細胞に相当し、成熟度の面で大きな課題がありました。
研究グループは、心臓発生において心筋細胞の成熟度に伴い変化するトロポニン注4)というタンパク質の移り変わり (胎児型:TNNI1、成人型:TNNI3)に着目し、これら2つのタンパク質の量に応じて蛍光するダブルレポーターヒトiPS細胞を作製することで、心筋細胞の成熟度を可視化することを試みました。そして、そのダブルレポーターiPS細胞株を用いて約9000種類の化合物からTNNI1からTNNI3へのトロポニンタンパク質の移り変わりを促進する化合物を探索しました(論文概要図)。
1) ダブルレポーターヒトiPS細胞の樹立及び化合物スクリーニング
本研究では、CRISPR/Cas9ゲノム編集技術注5)により、TNNI1及びTNNI3の遺伝子座に、それぞれEmGFP及びmCherryのレポーター遺伝子を挿入したヒトiPS細胞株を樹立しました。このダブルレポーターヒトiPS細胞はTNNI1の発現が強い場合は緑色に、TNNI3の発現が強い場合は赤色に蛍光します(図1)。
約9000化合物の中からTNNI3-mCherryの発現を促進する化合物をスクリーニングしたところ、いくつかの候補化合物に絞り込むことができました。更に、その候補化合物の標的分子に関する補足情報や細胞毒性解析の結果を精査し、ERRγ作動薬(T112)およびSKP2阻害薬注6)(T623)が、ヒトiPS細胞由来心筋細胞において毒性が低く、TNNI3へのタンパク質の移り変わりを促進する化合物であることを見出しました(図2)。
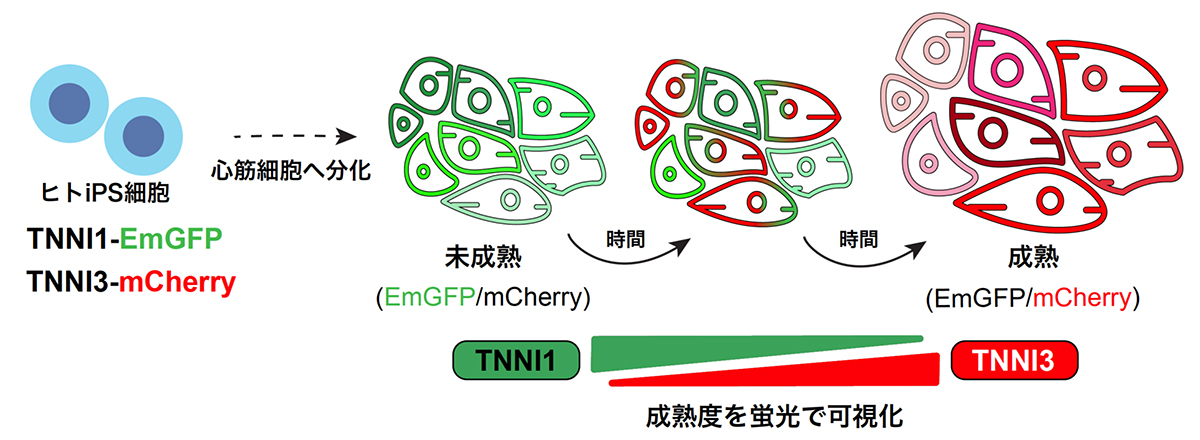
図1:ダブルレポーターヒトiPS細胞の特性を示す概要図
EmGFPおよびmCherryのレポーター遺伝子を挿入したヒトiPS細胞株は心筋細胞へ分化させると、
成熟度により緑色から赤色の蛍光を示す。
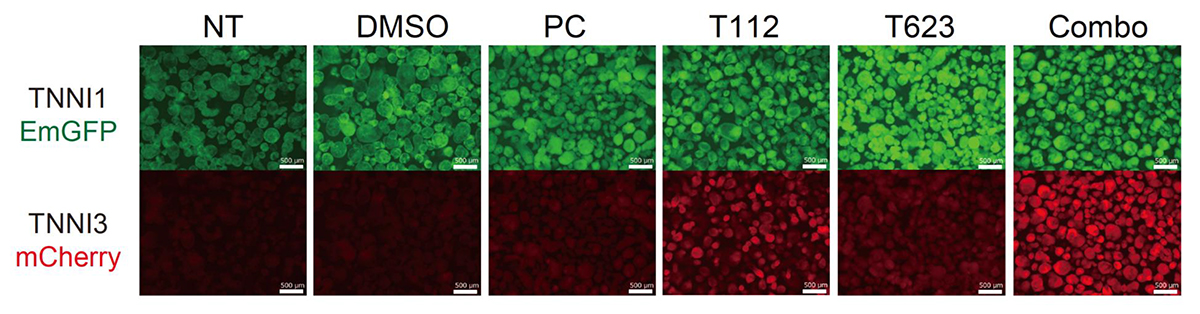
図2:ダブルレポーターヒトiPS細胞由来心筋細胞を用いた化合物スクリーニング
TNNI3-mCherryの発現を調べると、T112、T623およびCombo(T112とT623を混合したもの)がTNNI3へのタンパク質の移り変わりを促進する化合物であることが分かる。スケールバーは500μmを示す。
2) T112、T623および併用によるヒトiPS細胞由来心筋細胞の機能解析
次に、心筋細胞の成熟化の重要な指標の一つである代謝機能について調べました。エストロゲン関連受容体γ(ERRγ: T112)は酸化的リン酸化注7)やミトコンドリア生合成注8)に関わっていると考えられているため、これらの化合物で処理した心筋細胞のミトコンドリア活性(OCR:酸素消費速度)の解析を行いました。
その結果、T112処理群および併用群では基礎呼吸、最大呼吸、ATP注9)産生において有意にミトコンドリア活性上昇を確認しましたが、併用による相加効果は認められませんでした(図3)。即ち、T623は代謝機能の向上には寄与していないと推測されます。
更に、化合物処理による心筋細胞の収縮機能を解析したところ、T112処理および併用群においては、収縮や弛緩速度などの機能が有意に上昇しました。また、電気生理学的解析においても、T112処理群においては活動電位注10)の振幅などの値の上昇を確認しました。
これらの結果より、T112はTNNI3発現の上昇だけでなく、代謝機能、収縮機能、電気生理学的特性を向上させることがわかりました。
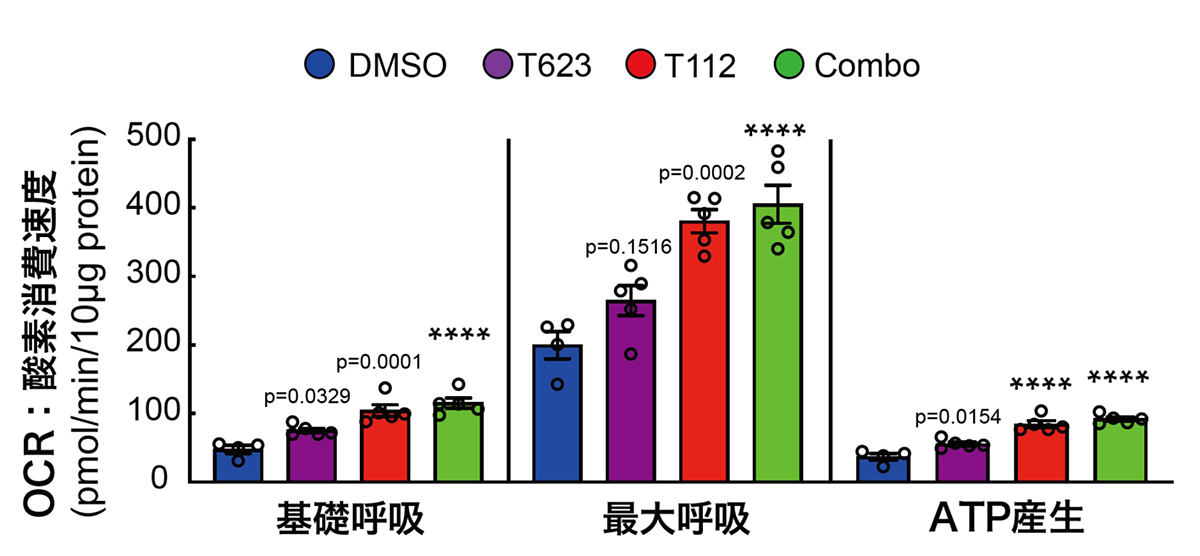
図3:ミトコンドリア活性(OCR:酸素消費速度)の解析
細胞の酸素消費速度を測定することによって、細胞のミトコンドリア機能を評価できる。T112処理群および併用群(Combo)では基礎呼吸、最大呼吸、AT産生においてミトコンドリア活性の上昇が有意に確認できる。(****はP<0.0001を示す。)
3) 化合物処理したヒトiPS細胞由来心筋細胞の電子顕微鏡注11)による構造解析
成熟した心筋細胞の一つの大きな特徴として、T管構造を有することが挙げられます。この解析をするために、電子顕微鏡を用いて化合物処理した心筋細胞を観察しました。
その結果、T112および併用群においてT管構造を認め、更にZ帯やM帯、I帯といった成熟心筋で認められるサルコメア注12)構造が確認できました(図4)。一方、コントロール(DMSO)群およびT623群においてはT管構造及びM帯は認められませんでした。また、これらの写真を用いてサルコメアの長さを解析したところ、DMSO群に比べて化合物処理群において有意な増加を認め、T112および併用群が最も長いサルコメア長を有していることがわかりました。これらの結果より、T112はヒトiPS細胞由来心筋細胞を、T管構造を有するレベルにまで成熟させることがわかりました。

図4:T112処理したヒトiPS細胞由来心筋細胞の電子顕微鏡写真
TT: T管構造、Z :Z帯、I: I帯を示す。スケールバーは500μm。
サルコメア長はZ帯で仕切られた間の距離で測定される。
サルコメアの中には2つのフィラメントが存在し、太いものがミオシン、細いものがアクチンである。これらのフィラメントがお互いに滑り込むことによってサルコメアが収縮する。
収縮前、細いフィラメントのみで構成される部分をI帯、細いフィラメントと太いフィラメントで構成される部分をA帯と呼び、A帯の中央には微細な横線の帯(M帯)が見える。
4)ERRγ欠損ヒトiPS細胞由来心筋細胞における成熟化の確認
最後に、T112がERRγ作動薬であることから、ERRγを欠損したヒトiPS細胞を作製し、その心筋細胞がT112により成熟するかどうかのメカニズム解析を行いました。
その結果、ERRγ欠損ヒトiPS細胞株由来の心筋細胞では、T112を添加してもTNNI3-mCherry陽性細胞の上昇は認められませんでした(図5a)。更にミトコンドリア活性の解析においてもDMSOと同様に基礎呼吸、最大呼吸、ATP産生の上昇は認められませんでした(図 5b)。これらの結果から、T112はERRγを介してTNNI3の発現上昇や代謝機能を促進していることがわかりました。
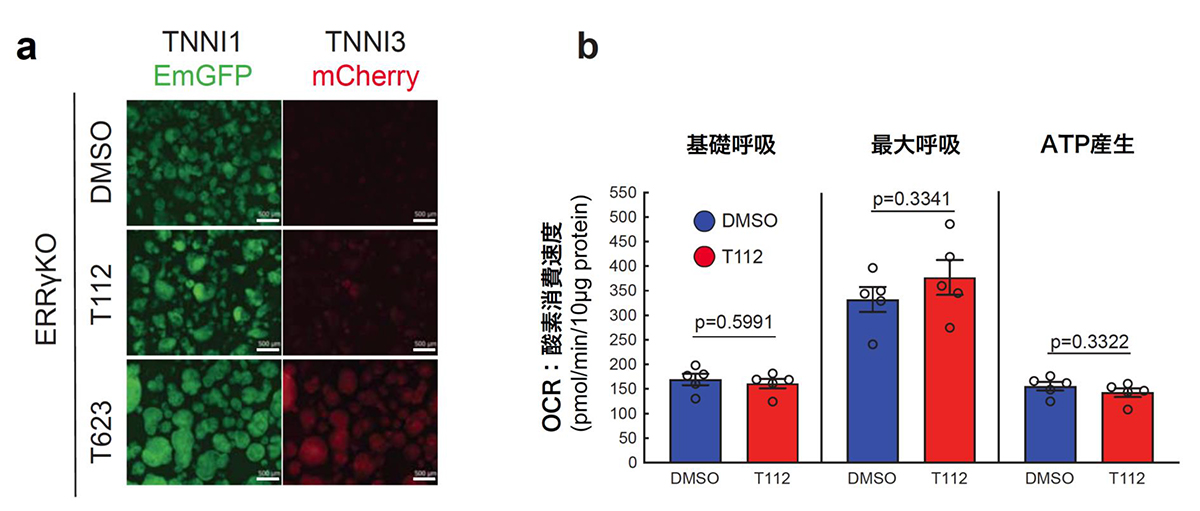
図5:ERRγ 欠損ヒトiPS細胞由来心筋細胞を用いたT112の効果の検証
(a)化合物スクリーニングにおいて、T623を添加すると若干のTNNI3-mCherry陽性細胞が認められるのに対し、コントロール(DMSO)及びT112においてはTNNI3-mCherry陽性細胞は認められない。
(b)ミトコンドリア活性(OCR:酸素消費速度)の解析。T112ではDMSOと同様に基礎呼吸、最大呼吸、ATP産生の上昇は認められない。
本研究では、ヒトiPS細胞由来心筋細胞を短期間、単一の化合物で処理することで、新生児の心筋細胞に相当するレベルまで成熟させることに成功しました。またその心筋細胞は構造的、代謝的、電気生理学的にもコントロール細胞に比べ有意に成熟し、T管構造を有することを示しました。これまで立体組織作製法などによりT管構造を持つ心筋細胞を作製した報告はありますが、通常の平面培養において化合物を作用させるだけでT管構造を持つ成熟心筋細胞を初めて作製することに成功しました。更に、ERRγが成熟過程において非常に重要な役割を果たしており、その作用を化合物で増強させることにより心筋細胞の成熟化を誘導させられることを初めて見出しました。
成人の心筋細胞はTNNI3のみが発現する細胞ですが、本研究において化合物処理により作製した心筋細胞はTNNI1とTNNI3の両方が発現している新生児の心筋細胞に相当する心筋細胞です。ERRγを化合物で活性化させることにより成熟化を誘導できるという本研究の成果は、試験管内で成人心筋細胞を作製するための重要な一歩になると考えられます。
今後、この化合物により成熟した心筋細胞を用いることで、これまでに表現型を認められなかった疾患モデルの構築やその創薬研究、更に成熟心筋細胞を用いた薬理試験や細胞治療などの研究が発展すると共に、成人レベルの心筋細胞への成熟化の研究などに発展することも期待されます。
- 論文名
ERRγ enhances cardiac maturation with T-tubule formation in human iPSC-derived cardiomyocytes - ジャーナル名
Nature Communications - 著者
Kenji Miki1,2*, Kohei Deguchi2,3*, Misato Nakanishi-Koakutsu1,2*, Antonio Lucena-Cacace1, Shigeru Kondo2,3, Yuya Fujiwara1,2, Takeshi Hatani1, Masako Sasaki1,2, Yuki Naka1,2, Chikako Okubo1, Megumi Narita1, Ikue Takei1,2, Stephanie C Napier2,3, Tsukasa Sugo4, Sachiko Imaichi3, Taku Monjo3, Tatsuya Ando3, Norihisa Tamura2,3, Kenichi Imahashi2,3, Tomoyuki Nishimoto2,3**, and Yoshinori Yoshida1,2**
*:筆頭著者、**:責任共著者 - 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- タケダ-CiRA 共同研究プログラム(T-CiRA)
- 武田薬品工業株式会社
- ジェナヘッドバイオ株式会社
本研究は、下記機関より支援を受けて実施されました。
- 武田薬品工業株式会社
- タケダ-CiRA共同研究プログラム(T-CiRA)
- Leducq財団
- セコム科学技術振興財団
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
(iPS細胞研究中核拠点) - 国立研究開発法人日本医療研究開発機構(AMED)医薬品等規制調和・評価研究事業
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実用化研究事業
- 日本学術振興会(JSPS)科研費
- iPS細胞研究基金
注1)化合物スクリーニング
多種多様な化合物を収納したカタログ(化合物ライブラリー)の中から、ロボットなどの自動装置を利用して、目的の化合物を選び出す技術のこと。
注2)エストロゲン関連受容体:ERRγ (Estrogen receptor-related receptorγ)
核内受容体のうちの一つ。エストロゲンという卵胞ホルモンに関連する物質に反応する。ミトコンドリア機能の調整に関与する。
注3)T管構造
心筋の筋細胞膜が細胞内に深く入り込んだ管状の構造物。T細管、横細管とも呼ばれる。
注4)トロポニン
トロポニン(Troponin)は骨格筋や心筋の収縮に不可欠な3つの蛋白質(トロポニンC(TnC), トロポニンI(TnI), トロポニンT(TnT))の複合体のこと。サルコメア注12)の中の細いフィラメントであるアクチンフィラメントの間の溝に沿って点在している。トロポニンIには3つのアイソフォームが存在し、心筋細胞では胎児期において骨格筋型トロポニンI(ssTnI又はTNNI1)が発現し、生後、心筋型トロポニンI(cTnI又はTNNI3)が発現し、成人では心筋型トロポニンIのみに変化する。
注5)CRISPR-Cas9ゲノム編集技術
ゲノム編集技術とは、ゲノムの特定標的部位にDNA損傷を誘導することでDNA配列を編集する技術の一つ。CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)-Cas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使うことで、任意の場所のDNAを切断することができる。切断されたDNAが修復する際にゲノムDNAの一部が欠失するため、遺伝子の機能(タンパク質発現)をノックアウトすることができる。
注6)S期キナーゼ関連タンパク質2(SKP2)阻害薬
細胞周期のS期(DNAの合成期)〜G2期(DNA合成から有糸分裂が起こるまでの間)に主に発現しているSKP2を阻害することで、細胞分裂を抑制する。
注7)酸化的リン酸化
エネルギーを産生する細胞内小器官であるミトコンドリアの中で起こる、酸素を使ってエネルギーに変換させる代謝過程のこと。
注8)ミトコンドリア生合成
ミトコンドリアが自分自身の構成成分を外部から取り込んで構造と機能を維持すること。
注9)ATP(アデノシン三リン酸)
体内に広く存在する分子で、エネルギーの放出や貯蔵に関わり、エネルギーを必要とする体内での化学反応に用いられている。「生体のエネルギー通貨」と呼ばれている。
注10)活動電位
心筋細胞膜では、細胞内外をナトリウムイオンやカルシウムイオン、カリウムイオンが透過するが、その透過性が刺激により変化し閾値を超えると、活動電位が発生し、それにより心臓が収縮する。
注11)電子顕微鏡
電子線を照射して対象物を拡大し観察する顕微鏡。一般的な光学顕微鏡よりもはるかに高い倍率で観察することができる。
注12)サルコメア
骨格筋は筋繊維によって形成される。そして筋繊維は多数の筋原繊維が束になったものである。この筋原繊維はZ帯でしきられており、このZ帯に仕切られた単位をサルコメアと呼ぶ。






















