
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2021年7月27日
転写因子HAND1とHAND2の発現パターンと役割の解明 〜ヒトiPS細胞から増殖能の高い心筋細胞を回収する〜
ポイント
- 心臓の発生に重要な働きをする転写因子HAND1とHAND2がどのように発現しているか調べるために、これらの発現量に応じて発色するトリプルレポーターiPS細胞株を作製した。
- 心筋細胞への分化誘導初期において、HAND1陽性細胞が心筋前駆細胞であることを示した。
- 細胞表面のタンパク質CD105注1)に対する抗体を用いて増殖能の高い心筋細胞を回収することに成功した。
大久保周子研究員(CiRA増殖分化機構研究部門)、吉田善紀准教授(CiRA同部門)らの研究グループは、トリプルレポーターiPS細胞株を作製し、心筋細胞への分化誘導過程の初期においてHAND1陽性細胞は心筋前駆細胞を示すこと、後期では、HAND1陽性細胞は高い増殖能を示し、HAND1、HAND2、LEF1が細胞増殖を制御していることを示しました。また、トリプルレポーター細胞株を用いて、CD105という細胞表面タンパク質に対する抗体を用いることで増殖能の高い心筋細胞を回収できることがわかりました。これにより、ヒトの心臓発生メカニズムの研究や増殖能の高い細胞を回収できることで細胞移植治療や創薬研究の効率化、ヒトの発生学の研究に貢献できると期待されます。
この研究成果は2021年7月22日に米国科学誌「Stem Cell Reports」でオンライン公開されました。
ヒトのiPS細胞から作製される心筋細胞は、再生医療、創薬研究や発生学への応用が期待されています。iPS細胞から心筋細胞への分化誘導の過程は、発生を模倣しているといわれていますが、詳しいメカニズムはわかっていません。
マウスの発生過程においてHAND1とHAND2という転写因子は心臓の形成において、重要な役割を果たすことが知られています。ヒトの発生過程でも、HAND1やHAND2に異常がある場合は、心臓の病気になることがわかっており、ヒトにおいても重要であることが示唆されています。また、ヒトの場合、HAND1は左心室注2)に強く発現し、HAND2は心房筋注3)に強く発現することがわかっています。しかし、ヒトの発生過程を胚を使って詳しく調べることは倫理的にも難しいため、iPS細胞を用いた研究による詳細なメカニズムの解明が期待されています。近年、iPS細胞を利用して心室筋注4)、心房筋へとつくり分けられるようになっていますが、HAND1やHAND2の発現動態やその働きについては詳しく調べられていません。
そこで本研究グループは、ゲノム編集注5)などの技術によってHAND1, HAND2, MYH6の発現量に応じてmCherry, EGFP, iRFP670という蛍光タンパク質の蛍光強度を示すトリプルレポーターiPS細胞を作製しました。MYH6は心筋細胞で陽性となる遺伝子です。このトリプルレポーター細胞株のシステムを用いてヒトiPS細胞から心筋細胞への分化誘導過程におけるHAND1,HAND2の発現パターンと役割の解明を目指して研究を行いました。
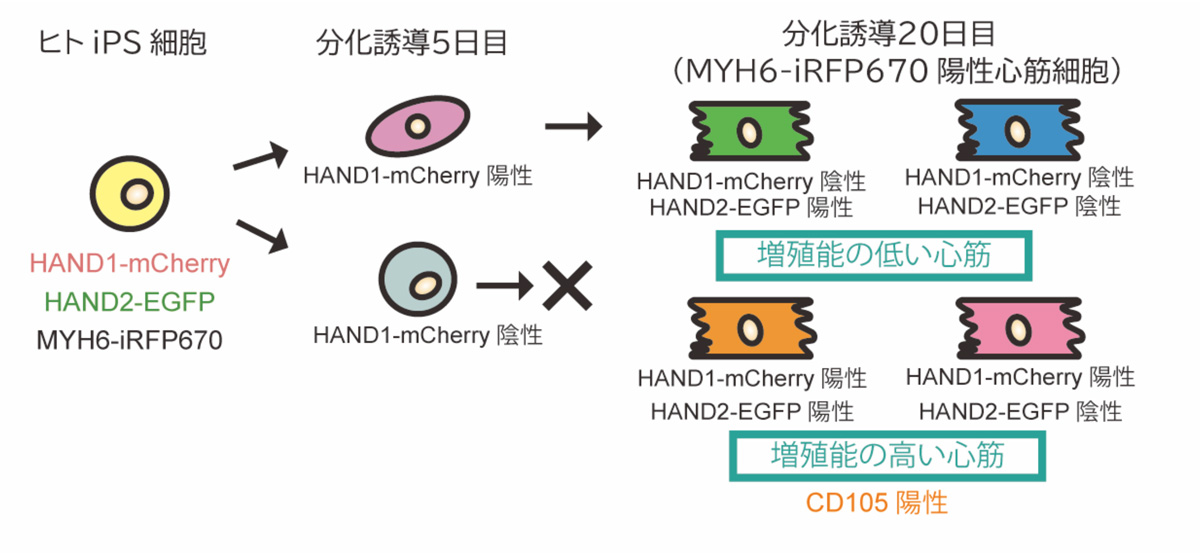
図1:概要
(1) レポーターiPS細胞株の作製と発現パターン
本研究グループは、心筋細胞の分化誘導過程におけるHAND1とHAND2の発現動態を観察するために、まずiPS細胞にCRISPR/Cas9注6)ゲノム編集技術を用いて、HAND1とHAND2の遺伝子座注7)にmCherryとEGFPという蛍光タンパク質の遺伝子配列を導入し、ダブルレポーター細胞株を作製しました。さらに、piggyBac注8)ベクターを用いてMYH6という心筋細胞で発現する遺伝子のプロモーターと、3つ目の蛍光タンパク質であるiRFP670の遺伝子配列を細胞に導入し、トリプルレポーターiPS細胞株を作製しました。このトリプルレポーターiPS細胞は、HAND1の発現をmCherry、HAND2の発現をEGFP、MYH6の発現をiRFP670で示します。
このトリプルレポーターiPS細胞を心筋細胞へと分化誘導させ、フローサイトメーター注9)で観察しました。すると、心筋細胞へとなる前の分化誘導5日目においてmCherry陽性細胞と陰性細胞の二つの集団があり、心筋細胞へと分化した後の20日目では、mCherry陰性EGFP陰性、mCherry陽性EGFP陰性、mCherry陰性EGFP陽性、mCherry陽性EGFP陽性の4つの集団があることがわかりました(図2)。
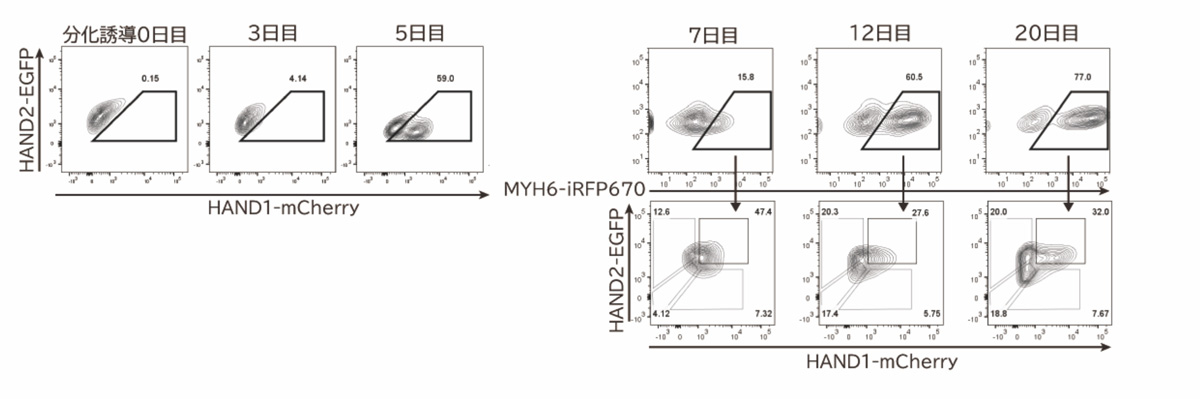
図2:iPS細胞から心筋細胞への分化誘導過程におけるHAND1,HAND2,MYH6の発現
iPS細胞から分化誘導20日目まで3,5,7,12日目の細胞を、フローサイトメーターを用いてHAND1-mCherry, HAND2-EGFP, MYH6-iRFP670の発現を検出した。5日目においてHAND1-mCherry陽性細胞と陰性細胞と二つの細胞集団が観察された。7日目よりMYH6陽性の心筋細胞が出現し、20日目の心筋細胞中では、4つの細胞集団があることがわかった。
(2) 分化誘導5日目のHAND1陽性細胞は心筋前駆細胞である
5日目のmCherry陽性細胞とmCherry陰性細胞の特徴を調べるために、それぞれの細胞を回収し、心筋細胞への運命決定に重要な転写因子の発現を調べました。その結果、mCherry陽性細胞でこれらの遺伝子が高く発現していることがわかりました(図3A)。また、心筋前駆細胞のマーカーであるPDGFRA, CD13という細胞表面タンパク質に対して免疫染色を行ったところ、mCherryの発現とこれらの因子の発現が相関しており(図3B)、HAND1陽性細胞は心筋前駆細胞であることがわかりました。
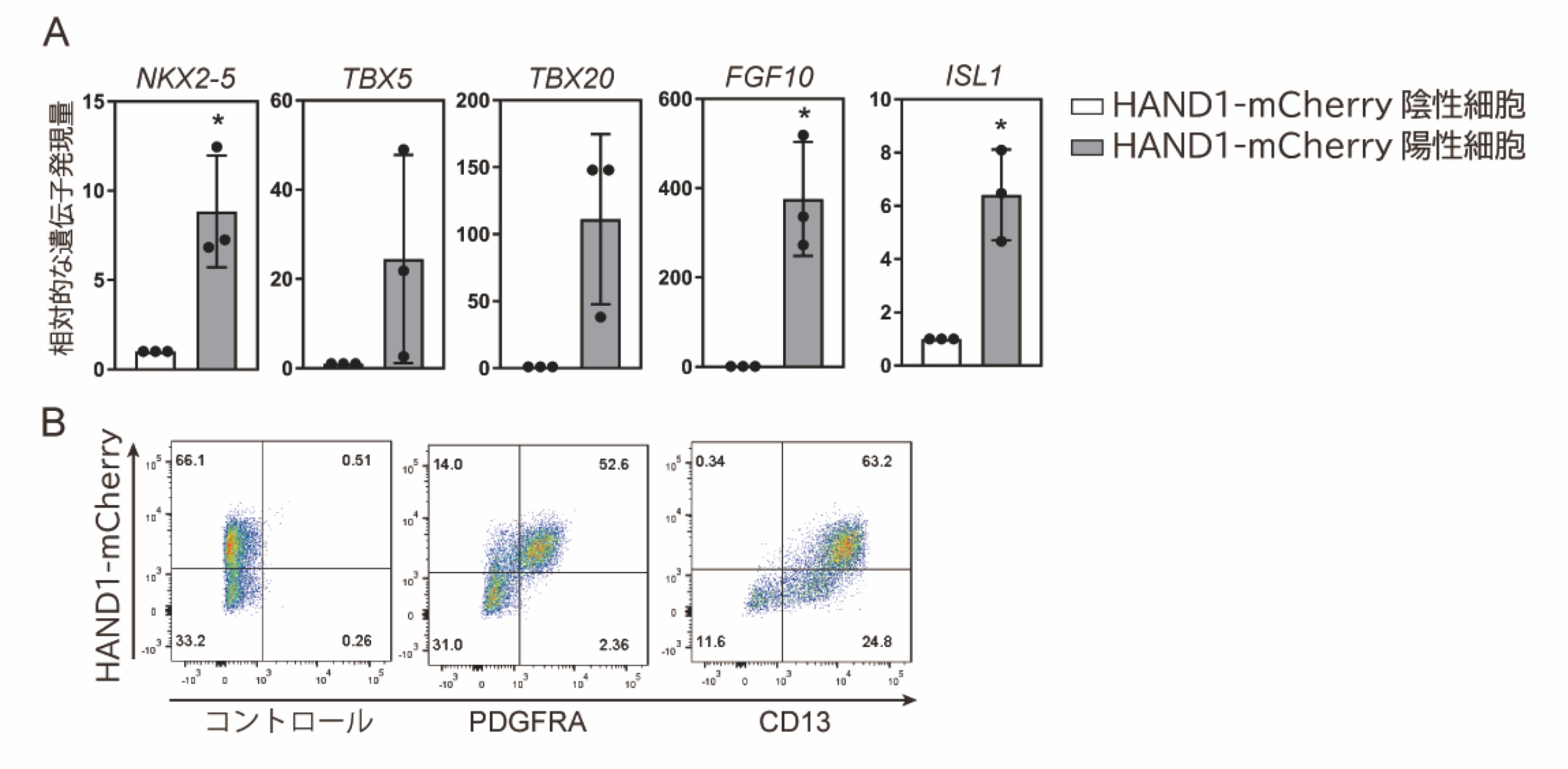
図3:分化誘導5日目のHAND1-mCherry陽性細胞は心筋前駆細胞マーカーを発現する
(A)iPS細胞から分化誘導5日目のHAND1-mCherry陽性細胞と陰性細胞を集め、心筋前駆細胞での発現が知られている遺伝子(NKX2-5, TBX5, TBX20, FGF10, ISL1)の発現量を調べた。(B)心筋前駆細胞の表面マーカーとして知られているPDGFRA及びCD13の抗体を用いたフローサイトメーターによりHAND1-mCherryとの相関を調べた。
(3)増殖能の高い心筋細胞のマーカーとしてCD105を同定
細胞増殖を検出するEdUという試薬を用いて、mCherry陽性細胞とmCherry陰性細胞のEdU陽性率を調べたところ、mCherry陽性細胞では陽性率が高いことから、mCherry陽性細胞は増殖能の高い心筋細胞であることが分かりました。最後に、増殖能の高い心筋細胞を回収するため、mCherry陽性細胞で高い発現を示す細胞表面にあるタンパク質の遺伝子を探索し、CD105に着目しました。心筋細胞からCD105陽性細胞と陰性細胞を分取したところ(図4A)、CD105陽性細胞はCD105陰性細胞に比べてEdU陽性率が高いことがわかりました(図4B)。以上より、抗CD105抗体を用いて増殖能の高い心筋細胞を回収することができるようになりました。
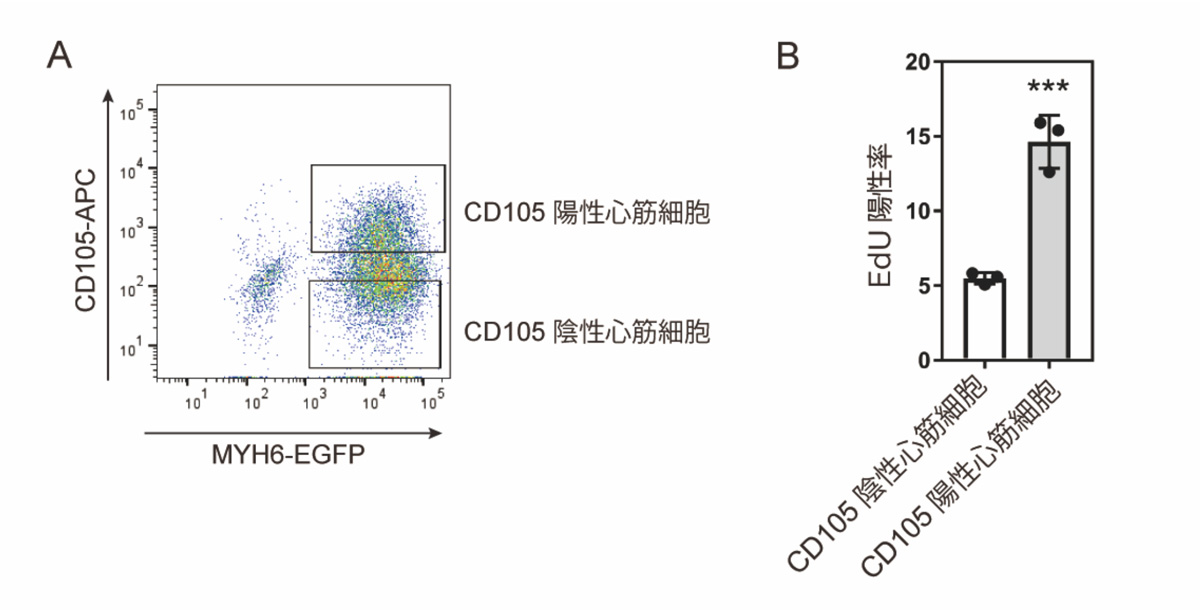
図4:抗CD105抗体を用いて細胞増殖能の高い心筋細胞を得る
(A)分化誘導20日目の心筋細胞(MYH6陽性)から、CD105陽性細胞と陰性細胞を分取した。(B)CD105陽性細胞のEdU陽性率は、CD105陰性細胞より高かった。
マウスの心臓の発生過程においてHAND1やHAND2は重要な働きをしていることはわかっていましたが、ヒトの発生や、ヒトのiPS細胞から心筋細胞への分化誘導において、HAND1やHAND2の発現動態や役割は詳細に調べられていませんでした。本研究では、iPS細胞をゲノム編集し、HAND1,HAND2,MYH6のトリプルレポーターiPS細胞株を作製することで、その発現動態を観察しました。その結果、分化誘導初期にはHAND1陽性細胞は心筋前駆細胞であること、また分化誘導後期では、HAND1陽性細胞は増殖能の高い心筋細胞であることを明らかにしました。さらに、CD105が増殖能力の高い心筋細胞を回収するマーカーとなることを発見しました。これらの発見は、ヒトの発生学への寄与や、再生医療において効率的な移植治療、創薬研究の効率化への効果が期待されます。
- 論文名
Expression dynamics of HAND1/2 in in vitro human cardiomyocyte differentiation - ジャーナル名
Stem Cell Reports -
著者
Chikako Okubo1, Megumi Narita1, Azusa Inagaki1, Misato Nishikawa1, Akitsu Hotta2,
Shinya Yamanaka3,4, Yoshinori Yoshida1*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所 増殖分化機構研究部門
- 京都大学iPS細胞研究所 臨床応用研究部門
- 京都大学iPS細胞研究所 未来生命開拓部門
- グラッドストーン研究所
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会 科学研究費 特別研究員奨励費
- 日本学術振興会 科学研究費 基盤研究(B)
- Leducq財団
- セコム科学技術振興財団
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
- 国立研究開発法人日本医療研究開発機構(AMED)医薬品等規制調和・評価研究事業
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実用化研究事業
注1) 抗CD105抗体
CD105というタンパク質に対して特異的に認識する抗体。抗CD105抗体に蛍光色素を付加し、フローサイトメーターを用いて、CD105陽性細胞を回収することができる。
注2) 左心室
左心室とは、心臓の4つの部屋のうち、全身に血液を送る最も筋肉の層が厚い部位
注3) 心房筋
心房筋とは、心臓の4つの部屋のうち、上部に位置する2つの部屋(左心房・右心房)を構成する筋肉細胞である。
注4) 心室筋
心室筋とは、心臓の4つの部屋のうち、下部に位置する2つの部屋(左心室・右心室)を構成する筋肉細胞である。
注5) ゲノム編集
ゲノム編集技術とは、ゲノムの特定標的部位にDNA損傷を誘導することでDNA配列を編集する技術の一つ。切断されたDNAが修復する際に、外部から導入したベクターを用いて目的の遺伝子配列(蛍光タンパク質など)を標的部位に挿入(ノックイン)することができる。
注6) CRISPR-Cas9
CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)-Cas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使うことで、任意の場所のDNAを切断することができる。
注7) 遺伝子座
染色体上の遺伝子の位置。
注8) piggyBac
ゲノム編集とは異なり特定部位を標的とせず、ランダムに目的の遺伝子配列を挿入するシステムの一つ。
注9) フローサイトメーター
細胞一つ一つに対してレーザーを照射し、蛍光を観察することができる装置。流動細胞計測計のこと。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を構成的に解析することができる。






















