
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2021年10月21日
TMPRSS2とカテプシンBを標的とした新型コロナウイルスの感染阻害
ポイント
- 新型コロナウイルス(SARS-CoV-2) 注1)感染においてTMPRSS2注2)とカテプシンB注3)が重要な役割を担うことを見出しました。
- TMPRSS2阻害剤とカテプシンB阻害剤の組合せによりSARS-CoV-2感染効率が低下することを確認しました。
- CRISPR干渉(CRISPRi)注4)とACE2注5)発現iPS細胞がSARS-CoV-2関連遺伝子の機能解明に役立つと考えられます。
これまで多くの受容体やプロテアーゼ注6)がSARS-CoV-2感染に必要であることが報告されています。アンジオテンシン変換酵素2(ACE2)はウイルス感染のために最も重要と考えられている受容体ですが、感染における他の受容体やプロテアーゼの寄与度は十分に調べられていません。
今回、橋本里菜 特定研究員(CiRA増殖分化機構研究部門)、高山和雄 講師(CiRA同部門)らの研究グループは、ACE2発現iPS細胞とCRISPRi技術を用いて、SARS-CoV-2感染における3種の受容体と6種のプロテアーゼの役割を調べました。
検証の結果、TMPRSS2あるいはカテプシンB発現を抑制することで、ウイルス量がそれぞれ20.6%あるいは0.84%にまで低下しました。また、TMPRSS2とカテプシンBの発現を同時に発現抑制すると、ウイルス量は0.036%にまで低下しました。同様にカテプシンB阻害剤とTMPRSS2阻害剤の組合せにおいて、ウイルス量は0.0078%にまで低下しました。同様の結果は、4種類のSARS-CoV-2変異株を用いても観察されました。
本研究では、iPS細胞において、TMPRSS2とカテプシンBがSARS-CoV-2感染に重要な役割を担うだけでなく、これらの遺伝子を標的とした化合物が有望な新型コロナウイルス感染症(COVID-19)注7)治療薬となることが示唆されました。また、ACE2発現iPS細胞に対して、CRISPRi技術を用いて標的遺伝子の発現量を約1%にまで低下させることにより、ウイルス感染における特定の遺伝子の機能の調査が可能なことが示されました。
本研究成果は2021年10月20日に「Molecular Therapy - Nucleic Acids」でオンライン公開されました。
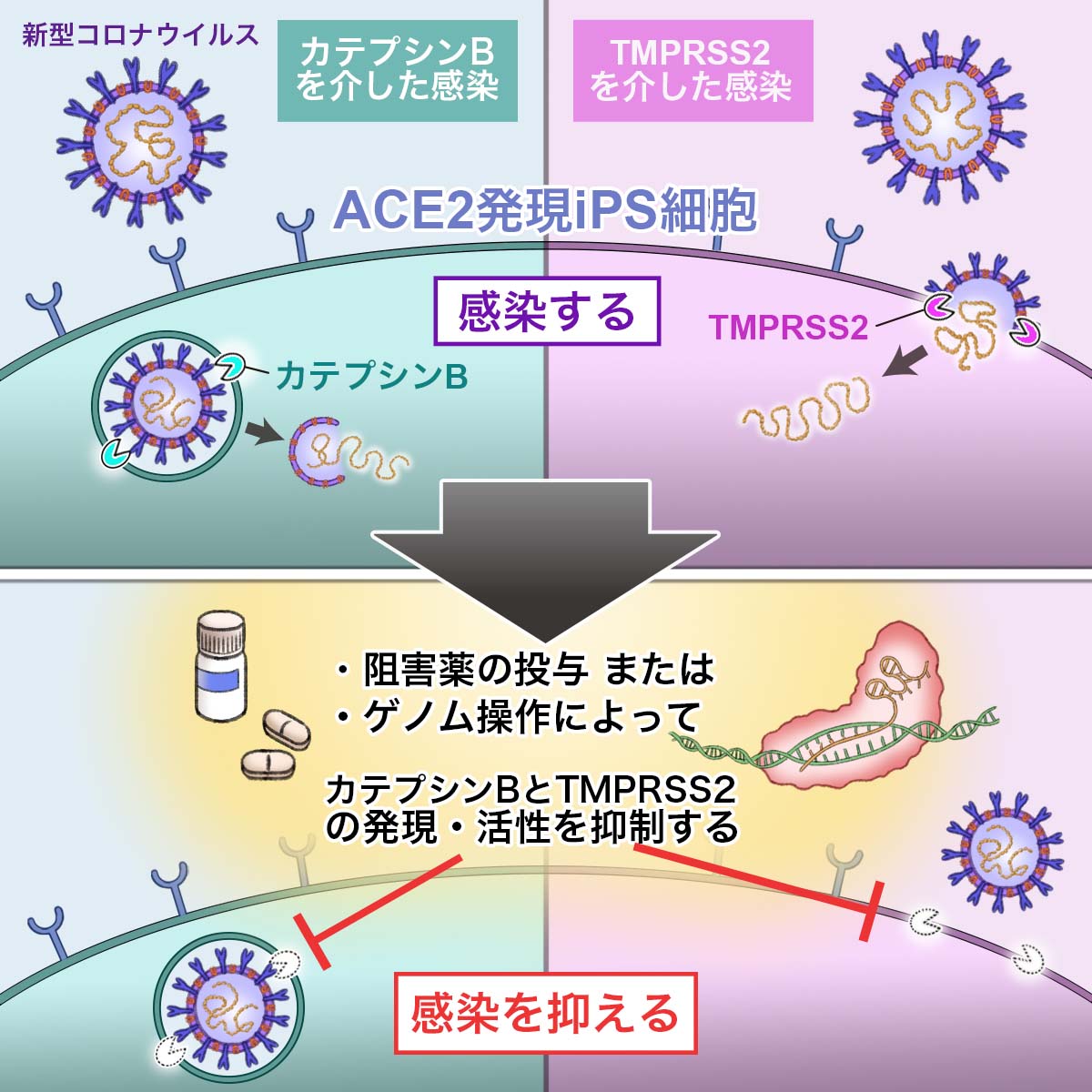
論文概要図
COVID-19治療薬を開発するためには、SARS-CoV-2の感染メカニズムを十分に解明する必要があります。SARS-CoV-2のスパイク(S)蛋白質は、細胞表面に発現するACE2に結合したのち、TMPRSS2等のプロテアーゼによって切断されます(論文概要図参照)。切断されたS蛋白質は細胞膜とウイルス外膜を融合させることにより、SARS-CoV-2の細胞内への侵入を促進します。そのため、SARS-CoV-2はACE2とTMPRSS2発現に依存して、感染すると考えられています。ところが最近、ACE2とTMPRSS2以外にも、複数の受容体やプロテアーゼがウイルス感染に重要な役割を担うことが相次いで報告されています。しかし、これらの受容体やプロテアーゼの機能を比較した報告はほとんどありません。
本研究では、SARS-CoV-2感染に関わる受容体とプロテアーゼの機能を比較するために、iPS細胞及びCRISPRi技術を用いました。iPS細胞においてCRISPRi技術を用いることで、標的の遺伝子の発現を約1%以下にまで抑制できることが報告されています。さらに、iPS細胞はあらゆる体細胞に分化できるため、標的の遺伝子を発現抑制した体細胞を作製することも可能です。
本研究グループは、未分化iPS細胞にSARS-CoV-2が感染するためにはACE2が不可欠であることを最近報告しており、ACE2発現iPS細胞を作製することで、ウイルスが感染・複製できることを確認しています(CiRAニュース:2021年4年19日「ACE発現ヒトiPS細胞を用いたSARS-CoV-2感染の個人差再現と原因究明」)。今回、ACE2発現iPS細胞及びCRISPRi技術を用いて、SARS-CoV-2感染に関わる受容体とプロテアーゼの機能を比較しました。
1) SARS-CoV-2感染における受容体とプロテアーゼの機能比較
本研究では、ACE2以外で、これまでにSARS-CoV-2感染への関与が報告されている3種の受容体(NRP1注8)、BSG注9)、IFNAR2注10))と6種のプロテアーゼ(TMPRSS2、TMPRSS4、TMPRSS11E、TMPRSS13注11)、カテプシンB、カテプシンL)の機能を比較検証しました。
CRISPRi技術を用いてiPS細胞の標的遺伝子の発現量を低下させたのち、ACE2を過剰発現させた上で、SARS-CoV-2感染実験を行いました。その結果、評価した受容体とプロテアーゼのうち、カテプシンB、カテプシンL、TMPRSS2については、遺伝子の発現量を低下させることにより、ACE2発現iPS細胞におけるウイルスRNAコピー数はそれぞれ11.7%、0.84%、20.6%に低下しました(図1)。したがって、検討した受容体とプロテアーゼのうち、カテプシンB、カテプシンL、TMPRSS2遺伝子は、iPS細胞におけるSARS-CoV-2感染に関与することが示唆されました。
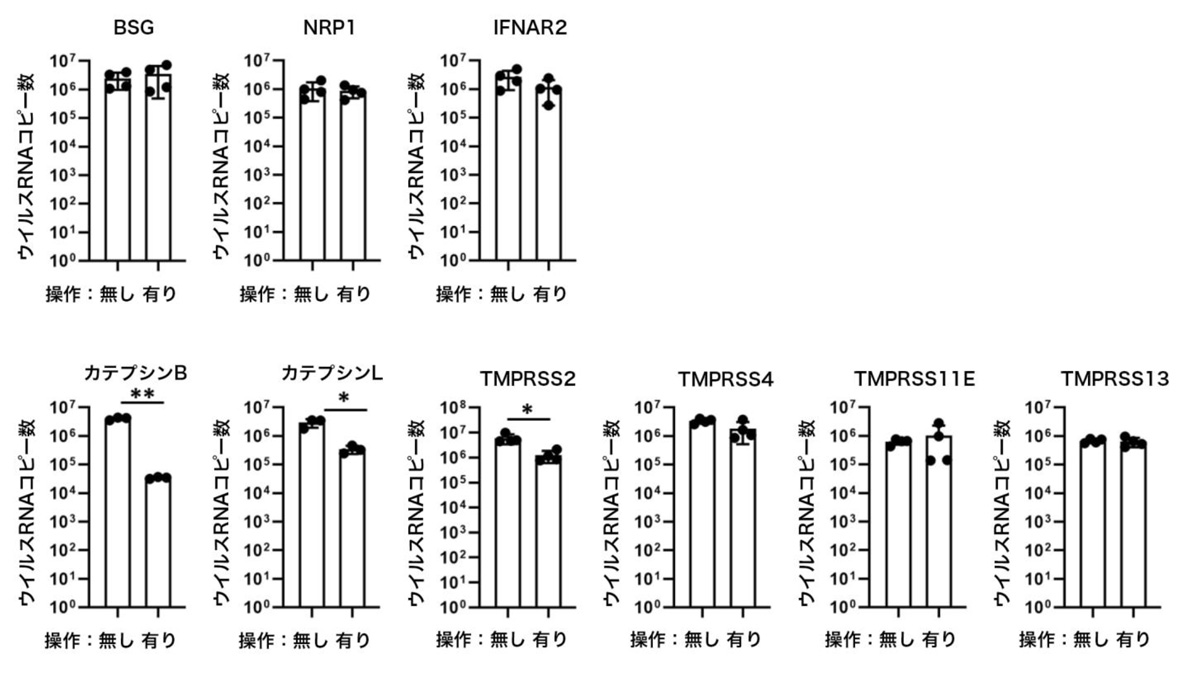
図1:3種の受容体(上段)と6種類のプロテアーゼ(下段)の遺伝子発現低下における
ACE2発現iPS細胞のウイルスRNAコピー数の変化
横軸は「操作有り」のとき標的遺伝子発現が低下されていることを示す。ウイルスRNAコピー数は培養上清中のものをqPCRにより測定。 カテプシンB、カテプシンL、TMPRSS2の発現量を低下させたときに有意差がみられた。*:p<0.05の有意差を示す。
2) カテプシンB、カテプシンL、TMPRSS2阻害剤を用いたSARS-CoV-2感染の阻害
次に、ACE2発現iPS細胞を用いて、カテプシンB、カテプシンL、TMPRSS2の阻害剤がSARS-CoV-2感染を阻害可能か調べました。TMPRSS2遺伝子発現量には性差があるため、男女由来の2種類のiPS細胞にそれぞれACE2を発現させた後、SARS-CoV-2を感染させました。そこへ、カテプシンB阻害剤であるCA-074 Me、カテプシンL阻害剤であるZ-Phe-Tyr(tBu)-diazomethylketone、TMPRSS2阻害剤であるカモスタット(Camostat)およびナファモスタット(Nafamostat)を作用させました(図2)。
その結果、女性由来のACE2発現iPS細胞において、CA-074 Meを作用させることによりウイルスRNAコピー数が0.62%にまで減少しました。一方で、男性由来のACE2発現iPS細胞においては、カモスタットおよびナファモスタットを作用させることによりウイルスRNAコピー数がそれぞれ0.48%、0.23%にまで減少しました。阻害剤作用後の細胞生存率を調べると、ナファモスタットを作用した細胞では極端に生存率が低く、ナファモスタットには強い細胞毒性があることが分かりました。以上のことから、CA-074 Meとカモスタットが、ACE2発現iPS細胞におけるSARS-CoV-2の感染を阻害できることが示唆されました。
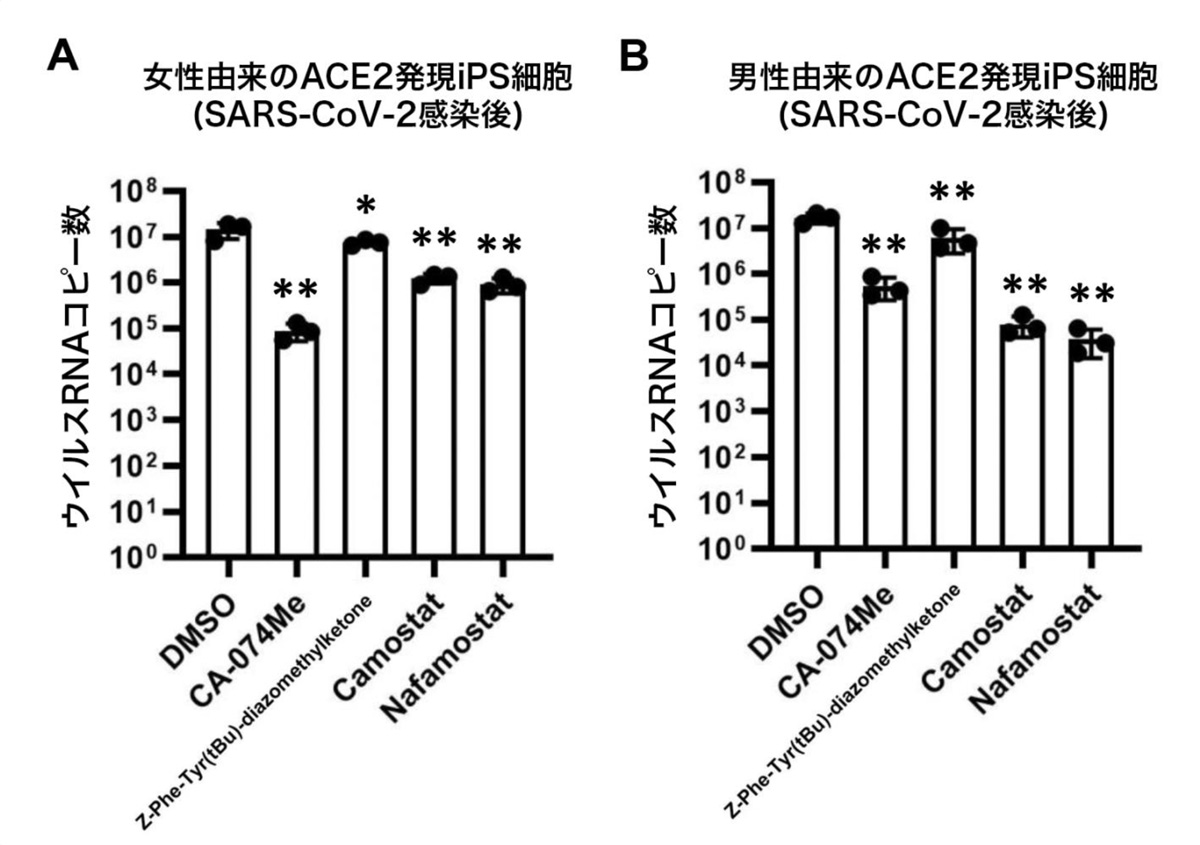
図2:SARS-CoV-2感染した男女のACE2発現iPS細胞における阻害剤の効果
4種類の阻害剤作用によるiPS細胞培養上清中のウイルスRNAコピー数の変化をqPCRにより測定。(A)は女性由来のサンプル、(B)は男性由来のサンプルを示す。DMSOは対照群を意味する。 女性由来のサンプルにおいては、CA-074 Me、男性由来のサンプルにおいては、カモスタットおよびナファモスタットが効果高いことを示す。*:p<0.05、**:p<0.01の有意差を示す。
3) カテプシンB、TMPRSS2の2重阻害によるSARS-CoV-2感染の阻害
最後に、カテプシンBとTMPRSS2の両方を阻害することにより、感染阻害効率が向上するか調べました。
まず、CRISPRi技術を用いてiPS細胞のカテプシンBおよびTMPRSS2両遺伝子の発現量を低下させたのち、SARS-CoV-2を感染させました。その結果、ウイルスRNAコピー数は0.036%にまで低下しました(図3A)。
次に、阻害剤による効果を確認するため、男女合わせて6種類のサンプルにおいてCA-074 Meとカモスタット(CA-074 Me+CAM)による作用を調べました。その結果、CA-074 Meとカモスタットを組合せることで、ウイルスRNAコピー数が約0.0078%にまで低下することを確認しました(図3B)。このとき、2種類の阻害剤の組合せによる細胞毒性はほとんど見られませんでした。また、2種類の阻害剤の組合せにより、SARS-CoV-2感染による細胞死の回避とSARS-CoV-2ヌクレオカプシド蛋白質注12)陽性細胞の減少も観察されました(図4)。
なお、本研究で用いた新型コロナウイルスはB.1.3株注13)を用いたものでしたが、他の3種類のSARS-CoV-2変異株(B.1.1.7注14)、B.1.351注15)、 B.1.1.248注16))においても同様の効果が観察されました。以上のことから、CA-074 Meとカモスタットが相乗的にウイルス感染を阻害できることが示唆されました。
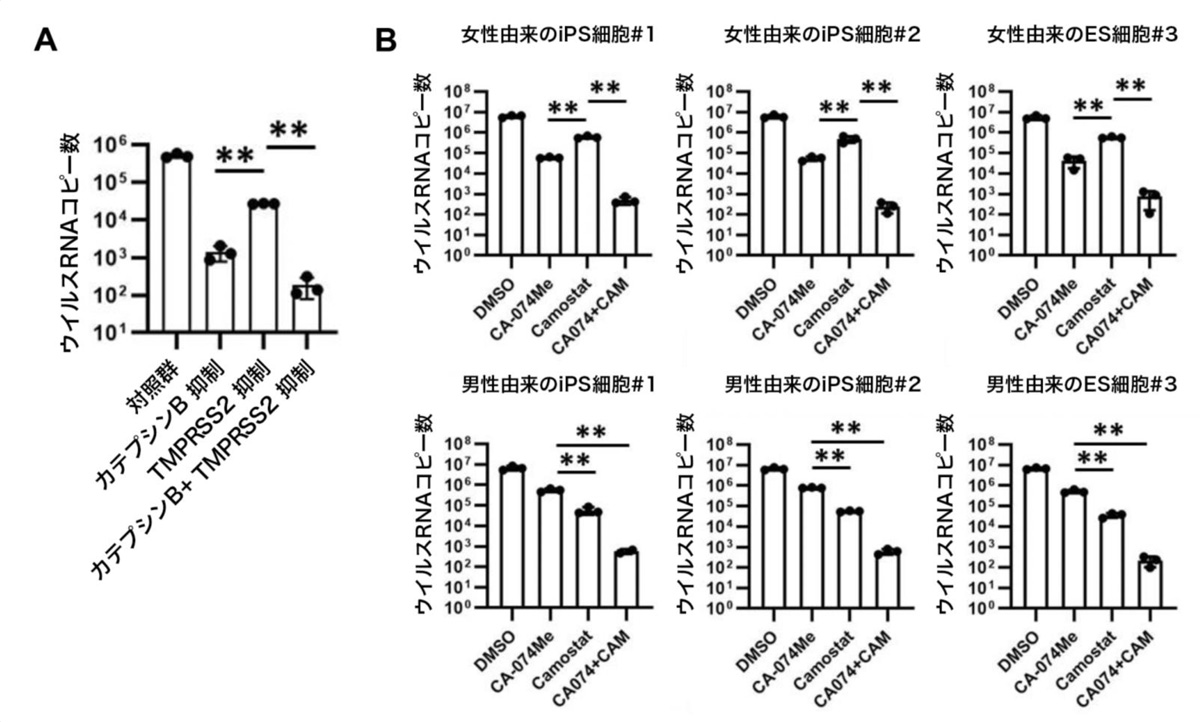
図3:カテプシンBとTMPRSS2の2重阻害によるSARS-CoV-2感染阻害効果
(A) CRISPR-Cas9ゲノム編集による効果。カテプシンBとTMPRSS2の両遺伝子の発現低下により培養上清中のウイルスRNAコピー数が低下した。**:p<0.01の有意差を示す。
(B) 女性由来のサンプル(上段)と男性由来のサンプル(下段)における、カテプシンB阻害剤およびTMPRSS2阻害剤、また2つの組合せによるSARS-CoV-2感染阻害効果。全てのサンプルにおいて、CA-074 Meとカモスタットを組合せた場合において培養上清中のウイルスRNAコピー数が低下した。**:p<0.01の有意差を示す。
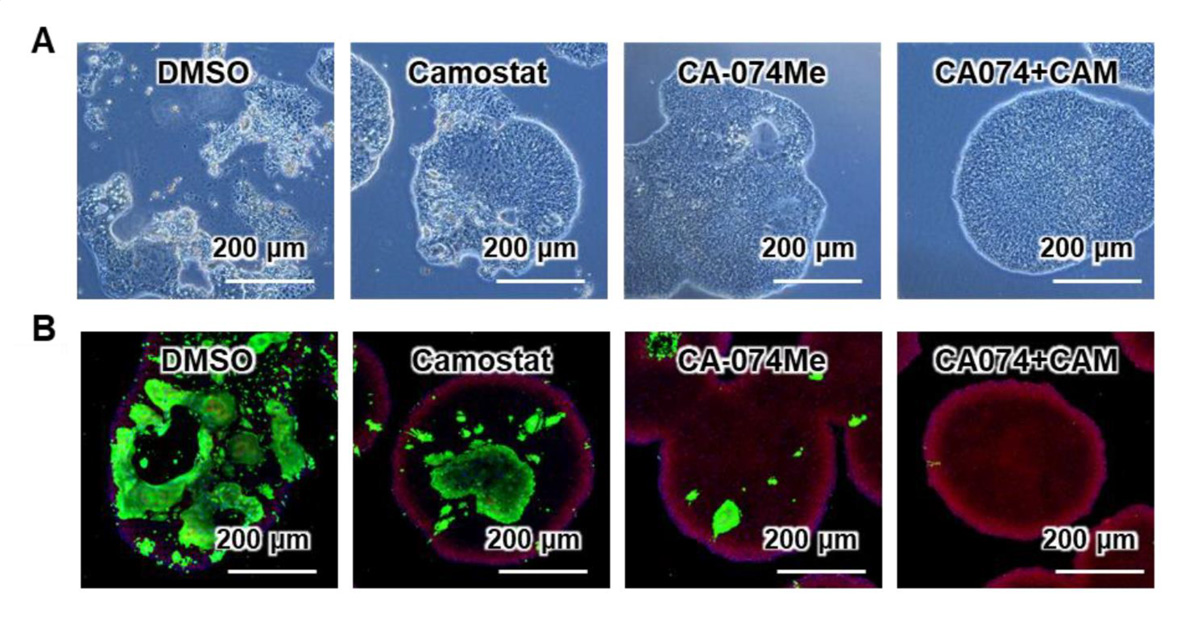
図4:SARS-CoV-2感染による細胞死とSARS-CoV-2ヌクレオカプシド蛋白質陽性細胞の観察
(A) 位相差顕微鏡画像。女性由来のACE2発現iPS細胞(SARS-CoV-2感染後)における阻害剤の効果を示す。対照群(DMSO)では細胞の形状が保たれず崩壊した細胞死が観察されたが、2種類の阻害剤の組合せにより細胞死が回避されることが観察できる。
(B) 免疫染色画像。緑色がSARS-CoV-2ヌクレオカプシド(N)蛋白質を示す。2種類の阻害剤の組合せによりSARS-CoV-2ヌクレオカプシド蛋白質の発現量が減少していることが観察できる。
本研究の結果から、SARS-CoV-2がACE2発現iPS細胞に感染するためには、カテプシンBとTMPRSS2が必要であることが明らかになりました。TMPRSS2は細胞膜に存在し、カテプシンBはエンドソーム注17)に存在しています。したがって、エンドサイトーシス注18)経路を通らないケースではTMPRSS2が、エンドサイトーシス経路ではカテプシンBが重要な役割を担うことが示唆されました。
本研究では、CA-074 Meとカモスタットの組合せにより、ウイルス感染効率の顕著な低下が見られましたが、完全な感染阻害効果を得ることはできませんでした。今回調べた受容体とプロテアーゼ以外にも重要な因子があると予想されます。今回用いたACE2発現iPS細胞およびCRISPRi技術は、新たなSARS-CoV-2関連因子の探索と評価にも使用できると考えられます。さらに、sgRNA発現ライブラリー注19)を用いることで、ウイルス感染に必須の新たな因子の同定が期待されます。
本研究ではACE2発現iPS細胞におけるSARS-CoV-2受容体とプロテアーゼの機能解明を行いましたが、肺胞上皮細胞や気道上皮細胞、心筋細胞、腸管上皮細胞などの体細胞でも同様に検証する必要があります。受容体とプロテアーゼの発現プロファイルは体細胞ごとに異なるため、各体細胞におけるこれらの遺伝子の寄与度は異なると予想されます。今後、本グループが樹立したACE2発現iPS細胞を各体細胞へ分化させることで、各体細胞における受容体とプロテアーゼの解析も期待できます。
- 論文名
Dual inhibition of TMPRSS2 and Cathepsin B prevents SARS-CoV-2 infection in iPS cells - ジャーナル名
Molecular Therapy - Nucleic Acids - 著者
Rina Hashimoto1*, Ayaka Sakamoto1, Sayaka Deguchi1, Renxing Yi1, Emi Sano1, Akitsu Hotta1, Kazutoshi Takahashi1, Shinya Yamanaka1, Kazuo Takayama1**
*:筆頭著者、**:責任著者 - 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業
- iPS細胞研究基金
- 京都大学iPS細胞研究所山中伸弥研究室への新型コロナウイルス特別研究助成
- 京都大学ウイルス・再生医科学研究所 ウイルス感染症・生命科学先端融合的共同研究拠点
注1)SARS-CoV-2
新型コロナウイルス感染症を引き起こすウイルスの名称。重症急性呼吸器症候群(SARS:severe acute respiratory syndrome)コロナウイルス(CoV)の関連株。SARS-CoV-2はS蛋白質と呼ばれる突起状の構造を持つ。
注2)TMPRSS2
Ⅱ型膜貫通型セリンプロテアーゼ(transmembrane protease, serine 2)の一種。SARS-CoV-2のS蛋白質を切断することで宿主細胞への侵入を促進する。
注3)カテプシンB、カテプシンL
主にエンドソーム内(細胞内の小胞)に存在するプロテアーゼ。エンドソーム経路から侵入したSARS-CoV-2のS蛋白質を切断することで宿主細胞への侵入を促進する。
注4)CRISPR干渉(CRISPRi)
CRISPRiとは、特異性の高い遺伝子発現抑制技術である。ヌクレアーゼ活性の無いdCas9と転写抑制ドメインKRABを融合蛋白質、sgRNAを用いることで、任意の遺伝子の発現を抑制することができる。ゲノム編集技術に使用されているCas9を応用した技術である。
注5)ACE2
アンジオテンシン変換酵素Ⅱ(Angiotensin-converting enzyme 2)。SARS-CoV-2の受容体。
注6)プロテアーゼ
蛋白質をさらに小さなポリペプチドや単一のアミノ酸へと分解させる酵素の総称。
注7)COVID-19
新型コロナウイルス感染症の正式名称。CO=「corona」、VI=「virus」、D=「disease」。
注8)NRP1
ニューロピリン1。神経細胞においてSARS-CoV-2の感染への関与が報告されている受容体。
注9)BSG
ベイシジン(別名:CD147)。T細胞などにおいてSARS-CoV-2の感染への関与が報告されている受容体。
注10)IFNAR2
インターフェロンアルファ/ベータ受容体。SARS-CoV-2の感染への関与が報告されている。
注11)TMPRSS4、TMPRSS11E、TMPRSS13
TMPRSS2以外の膜貫通型セリンプロテアーゼ(TTSP)。TMPRSS2と同様に、SARS-CoV-2の感染への関与が報告されている。
注12)SARS-CoV-2ヌクレオカプシド(N)蛋白質
SARS-CoV-2に最も多く存在する蛋白質であり、ウイルスの中身に存在する。
注13)B.1.3
SARS-CoV-2変異株の一種。
注14)B.1.1.7
英国で発見されたSARS-CoV-2変異株。α株。
注15)B.1.351
南アフリカで発見されたSARS-CoV-2変異株。β株。
注16)B.1.1.248
ブラジルで発見されたSARS-CoV-2変異株。γ株。
注17)エンドソーム
細胞内に取り込まれた袋状の構造体を持つ小胞のこと。細胞内への物質の運送や代謝に関与する。
注18)エンドサイトーシス
細胞が細胞外の物質を内部に取り込む機構の一つ。細胞膜由来のエンドソームを介した場合、エンドサイトーシス経路という。
注19)sgRNA発現ライブラリー
数百から数千種類のガイドRNAを発現するプラスミド(あるいはウイルスベクター)であり、KRAB-dCas9存在下で数々の標的遺伝子を同時にノックダウンすることができる。薬物標的同定、表現型変化などの様々なアプリケーションにおいて利用される。






















