
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2021年12月20日
iPS細胞作製過程における初期化因子MYCLのタンパク質ドメインの機能解析
秋藤千晶大学院生(CiRA未来生命科学開拓部門)、中川誠人講師(CiRA同部門)らの研究グループは、ヒトiPS細胞の作製過程における初期化因子MYCLの機能解析を行い、初期化に重要な領域(タンパク質ドメイン注1))を同定しそれらの機能を明らかにしました。
最初の初期化因子として報告されたc-MYCを用いた初期化過程では非iPS細胞様のコロニー注2)形成が数多く観察されたのに対し、MYCLの初期化過程では非iPS細胞様のコロニー形成は極めて少なく、より効率的にiPS細胞様のコロニーが形成されることを明らかにしました。さらに、MYCLのタンパク質ドメインMYC Box 0 (MB0)及びMB2が初期化に重要であることを明らかにし、
MYCLとc-MYCのMB0ドメインの機能が異なることも突き止めました。プロテオーム解析により、MYCLの初期化過程では、MB0ドメインの働きによって細胞接着関連因子の発現が増加すること、およびMB2ドメインがRNA結合タンパク質と相互作用する可能性を見いだしました。
この結果により、ヒトiPS細胞のより効率的な作製に向けた初期化過程の分子機構の解明および、MYCタンパク質ファミリー注3)の新たな機能の発見につながることが期待されます。
本研究成果は2021年12月20日(月)に「Scientific Reports」に掲載されました。
ヒトiPS細胞はOCT3/4、SOX2、KLF4(OSK)、及びc-MYCの4つの遺伝子を体細胞に導入することで作製されます。しかしながら、c-MYCはがん遺伝子として知られており、作製したiPS細胞の腫瘍化が懸念されることから臨床用のiPS細胞の作製には不向きと考えられていました。OSKの3因子のみでのiPS細胞の作製は非常に効率が悪く、そのiPS細胞は生殖系列の細胞への分化能が低いことから、MYCの初期化での重要性を明らかにしました。c-MYCと同じように初期化を誘導することができ、かつ、腫瘍化リスクの無い初期化因子を探索したところ、c-MYCのファミリータンパク質として知られるMYCL(別の呼び名:LMYC; L-Myc; MYCL1; bHLHe38)を発見しました。MYCLを用いた場合、樹立したiPS細胞の生殖系列の細胞への分化効率はc-MYCとほぼ等しく、iPS細胞の樹立効率の増加が認められました。さらに、樹立したiPS細胞を用いてキメラマウスを作出した場合、腫瘍形成が原因で死亡したマウスの割合がc-MYCでは50%以上であったのに対し、MYCLではほぼ0%でした。これらの結果から、MYCLはc-MYCよりも効率良く質の良いiPS細胞を作製することができると考えられました。 (2010年7月27日 CiRAニュース)
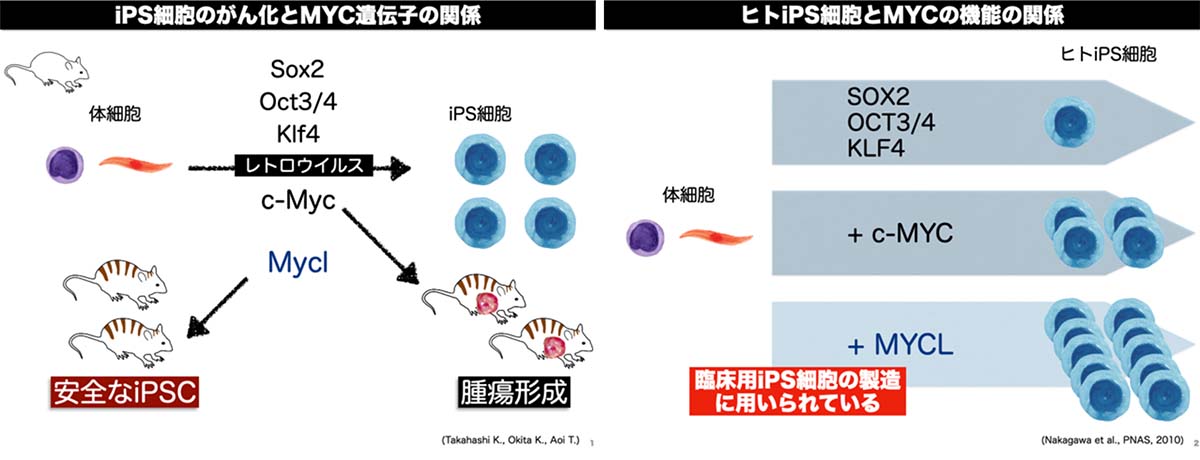
しかしながら、MYCLによる初期化過程の分子機構について及びc-MYCとの機能の違いについては明らかとなっていませんでした。そこで研究チームはMYCLの初期化過程での役割を明らかにすることを目的にMYCタンパク質の機能解析を行いました。
本研究では、センダイウイルス(SeV)およびエピソーマルベクター(EpiP)という2種類の遺伝子導入法を用いてc-MYC及びMYCLの初期化過程での表現型の違いをヒト線維芽細胞を使って検討しました。TRA-1-60注4)という未分化細胞の細胞表面で高発現する糖鎖を指標に初期化過程における経時的な発現の解析を行いました。その結果、MYCLの初期化過程で形成されるコロニーはほとんどがTRA-1-60陽性であるのに対し、c-MYCではTRA-1-60陰性を示すコロニーが数多く形成されることがわかりました。これらを、iPS細胞様(iPSC-like)コロニー、非iPS細胞様(Non-iPSC-like)コロニーと定義することで、MYCLとc-MYCの初期化過程における新たな表現型の違いを発見しました。(図1A、B)
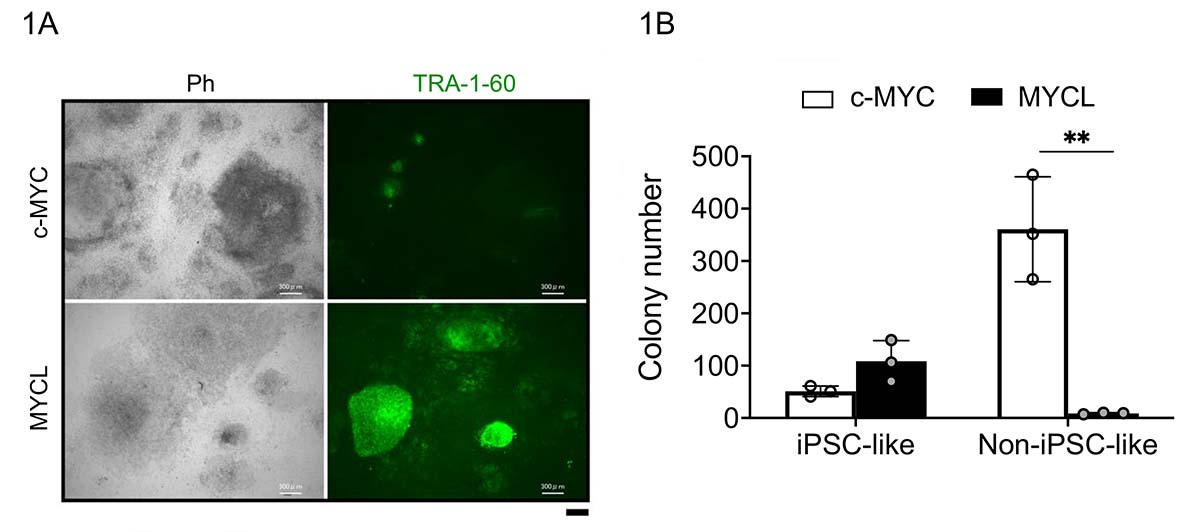
図1 c-MYCとMYCLの初期化過程で形成されるコロニーの違い
(A) ヒト線維芽細胞に初期化因子(OSK+c-MYCまたはOSK+MYCL)を導入して21日後に出現したコロニーをTRA-1-60で染色した。c-MYCの方ではTRA-1-60陰性のコロニーが多数確認された。
(B) iPS細胞様(iPSC-like)コロニーと非iPS細胞様(Non-iPSC-like)コロニーの数。
次に、研究チームはMYCLとc-MYCの初期化過程での表現型の違いが何に起因するのかを明らかにするため、タンパク質の機能ドメインに着目しました。MYCファミリーにはMYC Box domainと呼ばれる機能ドメインが保存されています(図2A)。MYCLとc-MYCはMYCのファミリータンパク質ですが、N末端注5)側がMYCLではc-MYCよりも短いという構造的な違いがあります。また、c-MYCでは高い形質転換注6)活性を示すのに対し、MYCLの形質転換活性は低いことが知られています。そこでN末端側の領域についてどの部位が重要であり、c-MYCとMYCLでどの様な機能的な違いが見られるのかを明らかにするため各ドメインの欠損型変異体を用いて初期化誘導を行い、表現型を確認しました。その結果、MB0及びMB2ドメインの欠損型変異体を用いた際にc-MYC及びMYCL両方で表現型が大きく変わることを明らかにしました。c-MYC-ΔMB0(c-MYCのMB0ドメイン欠損型変異体)では非iPS細胞様コロニーの形成が減少し、iPS細胞様コロニーの形成の増加が観察され、c-MYC-WTと真逆の表現型を示しました。一方、MYCLはΔMB0及びΔMB2両方でiPSC-likeコロニーの形成が減少しました(図2B)。これらの結果から、MYCによる初期化にはMB0及びMB2ドメインが重要であることを同定するとともに、c-MYCとMYCLの初期化での表現型の違いがMB0ドメインの機能的な違いによるものであるということを明らかにしました。
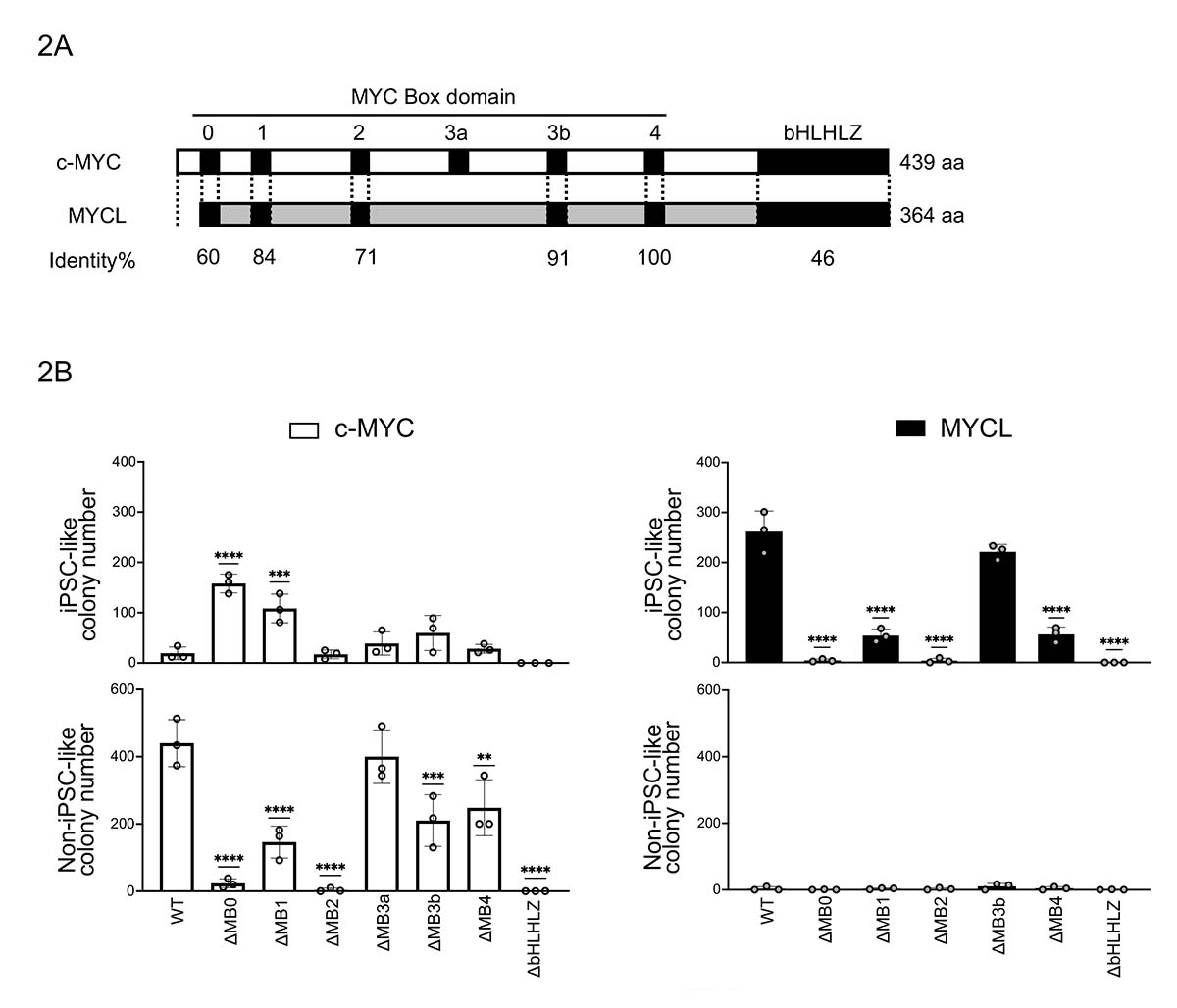
図2 c-MYCとMYCLのドメイン欠損型変異体及びその初期化でのコロニー形成の違い
(A) c-MYCとMYCLの構造の比較。MYC Box domainは高度に保存されている。
(B) c-MYC/MYCLのMYC Box domain欠損型変異体(ΔMB...)を使ってヒト線維芽細胞を初期化し、iPS細胞様(iPSC-like)コロニーと非iPS細胞様(Non-iPSC-like)コロニーの数をカウントした結果。
次に、研究チームはMB0ドメインの役割を示すために初期化過程におけるタンパク質の発現解析を行いました。初期化因子導入10日目の試料を用いた質量分析(MS)によるプロテオーム解析注7)を行いました。その結果、MYCL-WT及びc-MYC-ΔMB0のiPS細胞様コロニーが数多く形成される初期化過程ではc-MYC-WTと比べて細胞接着関連因子の発現が増加することが明らかとなりました。(図3A、B)初期化過程では間葉−上皮移行(MET)注8)と呼ばれる現象が起こることが知られており、初期化の促進に影響する現象として知られています。METではE-cadherin、Laminin-1、Collagen、N-cadherin、Vimentin、Fibronectinといった細胞接着因子としての働きを持つものが多く関わっていることが知られており、本研究によってMYCLは初期化過程でMETの促進に関与することが示唆されました。
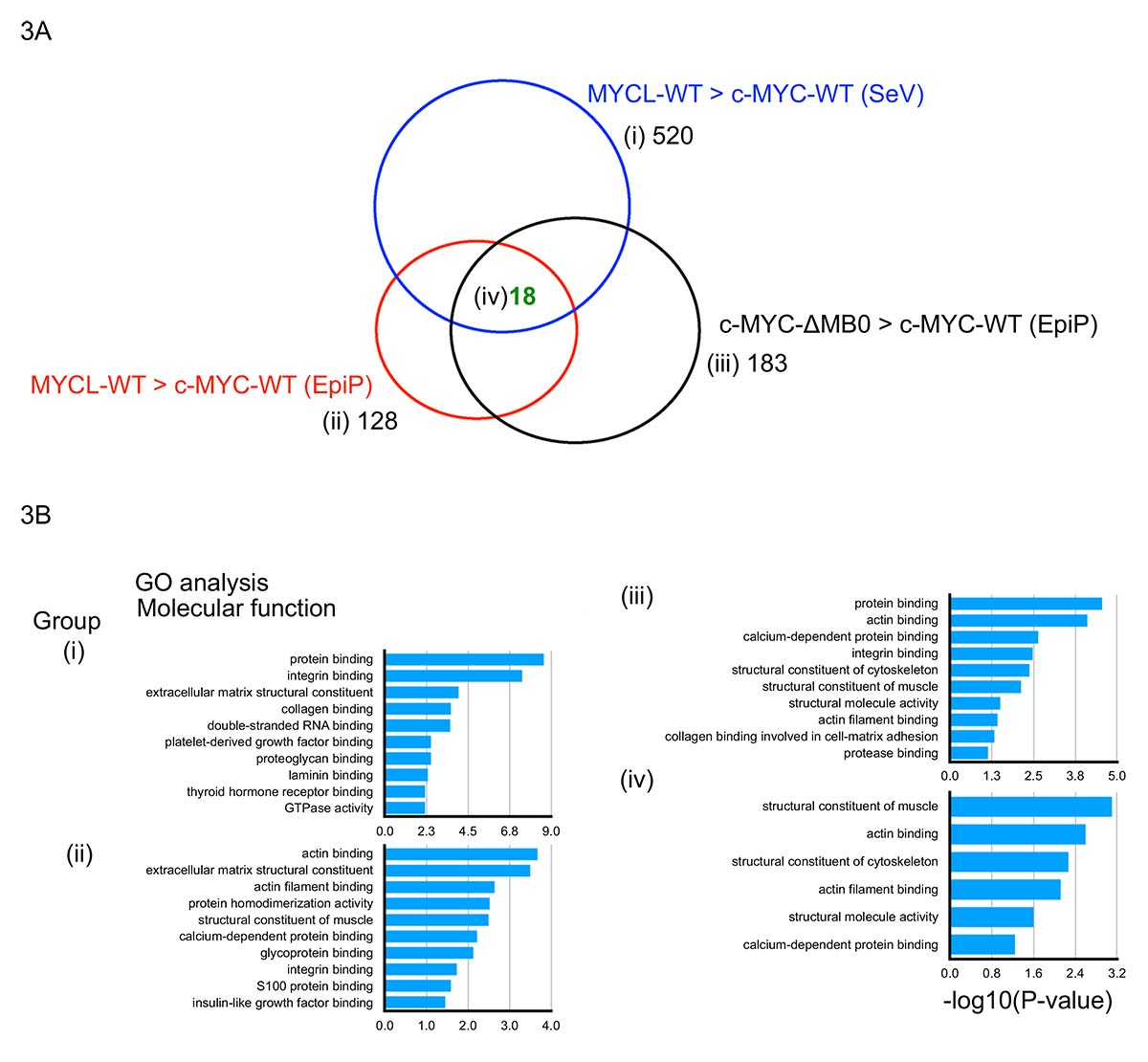
図3 MYCL及びc-MYC-ΔMB0の初期化過程のタンパク質発現の網羅解析
(A) MYCL-WT > c-MYC-WT (SeV): センダイウイルス(SeV)により初期化因子を導入し、MYCLを使った場合に発現が上昇したタンパク質を同定した((i) 520種)。エピソーマルベクター(EpiP)を使った場合にも同様の解析を行い(ii, iii)、3種類の条件で共通して見つかったタンパク質(iv)は18種あった。
(B) Aのi/ii/iii/ivで同定されたタンパク質がどのような機能に分類されるのかを解析した結果。
また、研究チームはMYCLのMB2ドメインについての役割を明らかにするため、MB2ドメインに結合するタンパク質の同定を行いました。過去の研究から、c-MYCのMB2ドメイン内にある135番目のトリプトファン(W、c-MYC-W135)をグルタミン酸(E)に変えた場合(c-MYC-W135E)、c-MYCの形質転換活性が消失することがわかっています。この知見を基に、MYCLで相当する96番目のトリプトファンをグルタミン酸に変えた変異体を作製しました(MYCL-W96E)(図4A)。その結果、MYCL-W96Eは初期化を誘導できないことを発見しました(図4B,C)。そこでMYCLのMB2ドメインについて、WT及びW96Eの部分的な組み換えタンパク質を作製し、アフィニティーカラム精製(AP)を行い、MSによって結合タンパク質を同定しました。その結果、RNA結合タンパク質が数多く同定され、MYCLのMB2ドメインは初期化過程でRNAのプロセッシングに関与する可能性が示唆されました(図4D)。
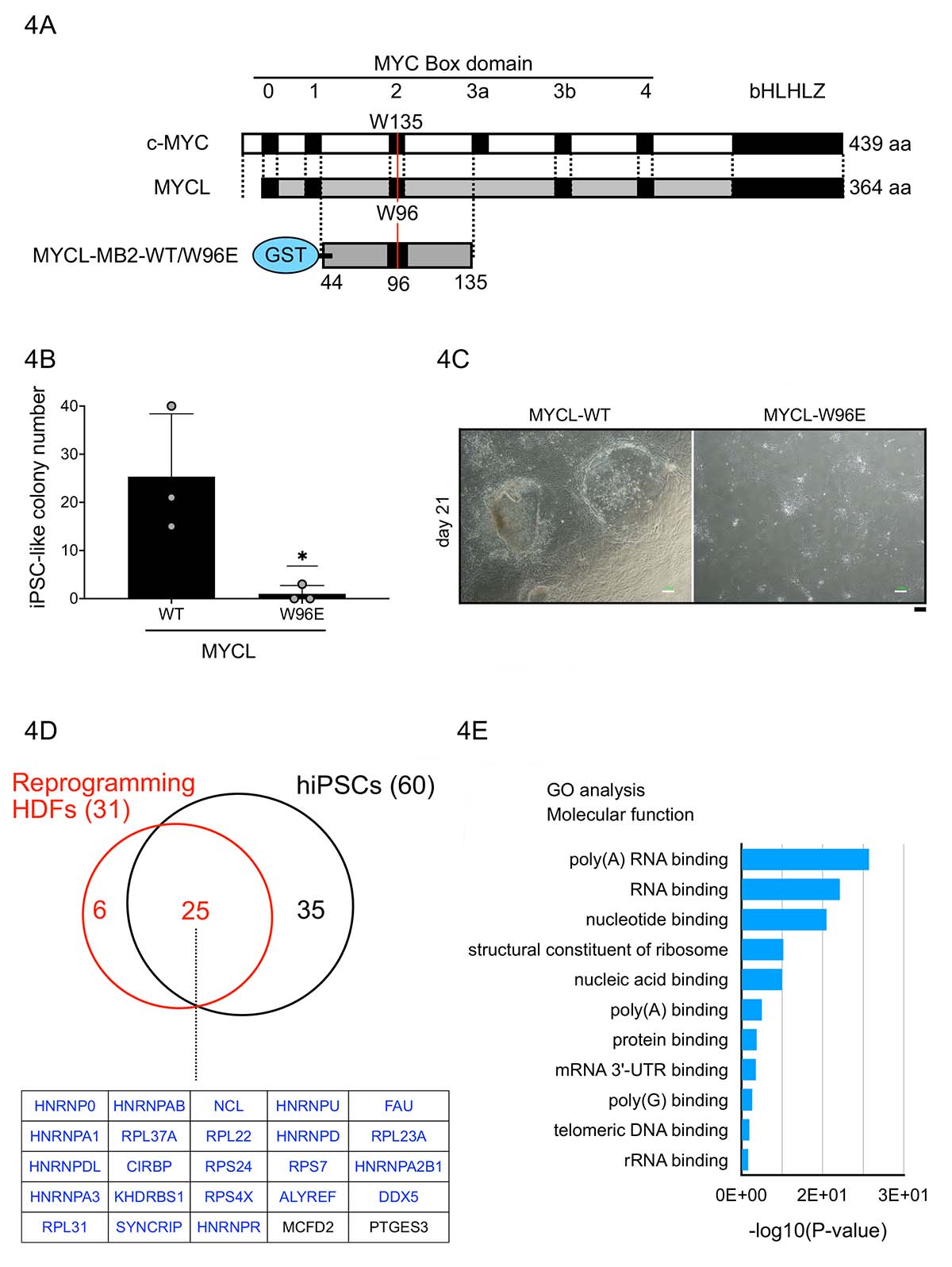
図4 MYCLのMB2ドメインの結合タンパク質の解析
(A) c-MYCの形質転換活性に重要な135番目のトリプトファンと対応するMYCLの96番目のトリプトファンの位置。結合タンパク質の同定のため行ったアフィニティーカラムに用いた組換えタンパク質:GSTタグを付加したMYCL-MB2-WT/W96E
(B, C) MYCL-W96E変異体を使ってヒト線維芽細胞を初期化した結果。
(D) 初期化中のヒト線維芽細胞(Reprogramming HDFs)とヒトiPS細胞を用いてMYCL MB2ドメインに結合するタンパク質を同定した結果。共通して見つかった25個の内、23個(青字)はRNA結合タンパク質であった。
(E) Dで同定したタンパク質がどのような機能に分類されるのかを解析した結果。
本研究により、MYCLがc-MYCよりも初期化効率が高い理由が、非iPS細胞様コロニーの形成が少ないからであるということを見いだし、その分子メカニズムはMB0ドメインを介した細胞接着関連因子の発現増加が関係している可能性を明らかにしました。この成果から、より効率良くiPS細胞を作製する手法の改善につながると期待されます。また、MYCLのMB0ドメイン内のアミノ酸が翻訳後修飾(Post-translational modification (PTM))を受ける可能性があるということ、及びこれまで未知であったMYCLのMB2ドメイン上の結合タンパク質について新たに同定し、RNA結合タンパク質(RNA binding protein (RBP))との相互作用があることを示唆しました。これによって、転写因子としてよく知られているMYCLの新たな遺伝子発現制御機構について、及び核外での新たな機能の同定が期待されます。
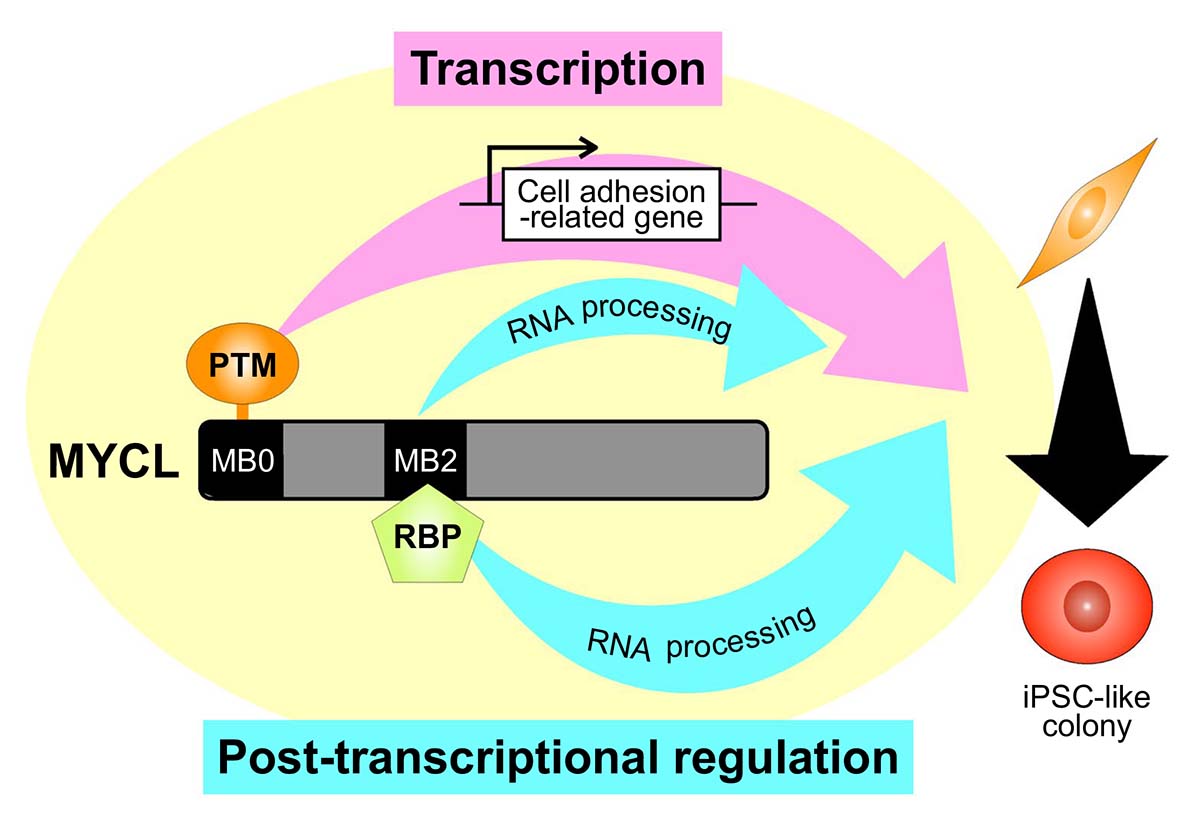
本研究の結果によって得られたMYCLによる初期化制御機構のモデル図
- 論文名
MYCL promotes iPSC-like colony formation via MYC Box 0 and 2 domains - ジャーナル名
Scientific Reports - 著者
Chiaki Akifuji1*, Mio Iwasaki1, Yuka Kawahara1, Chiho Sakurai1, Yu-Shen Cheng1, Takahiko Imai1, and Masato Nakagawa1**
*筆頭著者
**責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
本研究は、下記機関より支援を受けて実施されました。
- AMED (JP21bm0104001) 再生医療用iPS細胞ストック開発拠点
- 一般財団法人 藤原記念財団
注1) タンパク質ドメイン
タンパク質の構造の一部分。機能をもっており、コンパクトな三次元構造を作って安定している。タンパク質はこうしたドメインをいくつかもっている。
注2) コロニー
1つの細胞から増えた細胞集団のこと。時に異なる細胞が混ざることもあるが、それらから1つの細胞を取り出してさらにコロニー形成を繰り返すことで、同じ遺伝子をもつ細胞の集団を作製できる。
注3) ファミリー
構造も機能もよく似たタンパク質の一群。
注4) TRA-1-60
膜タンパク質を修飾する糖鎖、iPS細胞やES細胞での発現が高く、初期化過程でその発現が増加することが知られており細胞表面マーカーとして広く使われている。
注5) N末端
タンパク質はアミノ酸が連なって一本の鎖のようになっており、合成されるときにはN末端側からC末端側へと作られていく。
注6) 形質転換
遺伝的な変化などによって性質を変化させること。形質転換活性が高いc-MYCが過剰に発現した細胞は無制限に分裂を行うようになり、ガン化することが知られている。
注7) プロテオーム解析
個々の細胞内で発現しているタンパク質の網羅的な解析。この手法を活用してタンパク質間相互作用の理解を目指した研究が行われている。複雑なタンパク質間相互作用の理解は、より効率的な診断手法や治療法の開発が可能になると考えられている。
注8) 間葉-上皮移行
間葉系細胞の性質をもつ細胞が、細胞間の結合や極性など、上皮系細胞の性質をもつようになること。






















