
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2025年4月10日
翻訳開始因子EIF3Dはシグナル伝達経路のバランスを調整することで多能性幹細胞の自己複製を支える
ポイント
- 機能スクリーニングにより、分化多能性維持に必須な翻訳制御因子が特定された。
- EIF3Dはヒト多能性幹細胞の未分化維持と高い増殖能に不可欠である。
- EIF3Dは、翻訳制御を介して分化多能性維持に必要な複数の経路を制御する。
- EIF3Dは、複数のp53制御因子の翻訳を調節することで、未分化状態における低p53活性を維持し、強力な細胞増殖を促進する。
大久保 周子 助教(CiRA未来生命科学開拓部門)、高橋 和利 准教授(CiRA未来生命科学開拓部門)らの研究グループは、EIF3Dという翻訳開始因子注1)が、ヒト多能性幹細胞の維持に不可欠であることを示し、翻訳制御が分化多能性維持メカニズムの鍵となる新たな側面であることを明らかにしました。本研究成果は2025年4⽉10⽇に、国際学術誌『Science Advances』に掲載されました。
多能性幹細胞(Pluripotent Stem Cell: PSC)の特徴である分化多能性や自己複製能はこれまで転写因子ネットワーク注2)やエピゲノム注3)、シグナル伝達の観点から研究されてきましたが、その全体像は未だ不明瞭で断片的です。そこで、本研究グループはこれらのイベントをつなぐ"翻訳制御"に注目することで、未解明のメカニズムに新たな洞察を与えられると考えました。
CRISPRi 法注4)を用いた機能スクリーニングにより、翻訳開始因子EIF3Dが、ヒトPSCの自己複製に必須であることが明らかになりましたEIF3Dが失われると、分化多能性に関わるシグナル伝達経路のバランスが崩れ、分化多能性が損なわれました。
さらにEIF3Dは、複数のp53調節因子の翻訳を制御することで、ヒトPSCの自己複製を抑制するp53の発現を低く保っていました。このようにEIF3Dによる翻訳制御は、分化多能性ネットワークの恒常性を調整し、未分化かつ高い増殖能を持つ状態の維持に貢献していると示されました。本研究は、多能性幹細胞らしさを規定するメカニズムの一端を明らかにし、今後の翻訳研究の重要性を示しました。
PSCが分化多能性を保持したまま自己複製を維持するために、複数のシグナル伝達経路がバランスよく協調して働くことが重要です。このバランスが崩れると、PSCは自己複製のサイクルから逸脱し、分化細胞へと変化します。したがって、自己複製と分化誘導のバランスを最適に保つためには、これらのシグナル経路を精密に制御する必要がありますが、その恒常性を保つメカニズムは完全には解明されていません。
研究グループは、分化多能性のメカニズムを解明する鍵として、RNAをタンパク質に変換する「翻訳」過程が細胞の恒常性における重要な因子として着目してきました。これまで、PSCの特性は転写因子ネットワークやエピゲノム、シグナル伝達を通じて研究されてきましたが、全体像は明らかにされていません。これらの事象を橋渡しする翻訳制御に注目することで、未知のメカニズムが明らかになることが期待されます。
1)多能性維持に必須の翻訳因子EIF3Dの同定
研究グループは、まずCRISPRi法を用いて全遺伝子を対象とした機能スクリーニングを実施し、ヒトPSCの自己複製能に必須な約150の翻訳因子を同定しました(図1A)。翻訳因子の中でも特にEIF3Dに着目し、発現抑制株を作製しました(図1B)。EIF3Dの発現を抑制したヒトPSCは、特定の細胞系譜への分化を伴わない分化多能性の喪失と著しい増殖能の低下という表現型を示しました(図1B-D)。研究グループは、これら二つの顕著な表現型の仕組みに迫ることで、EIF3Dの役割を理解することを目指すことにしました。
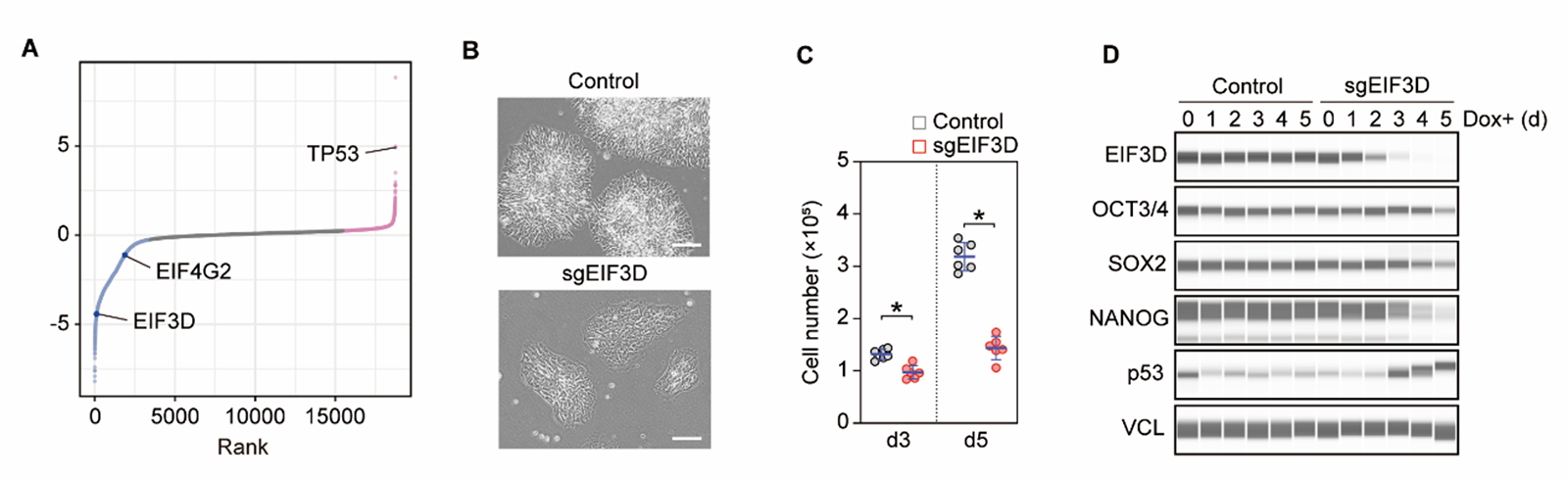
図1. A)CRISPRi法を用いた機能スクリーニング結果。青色が増殖を抑制した遺伝子、赤色が増殖を促進した遺伝子を示す。B)EIF3D発現抑制株、発現抑制3日目の顕微鏡像。C)EIF3D発現抑制下での細胞数の推移。D)EIF3D発現抑制0-5日目における多能性マーカー遺伝子(OCT3/4, SOX2, NANOG)とp53。VCLはコントロール
2)EIF3Dは分化多能性維持に関わるシグナル伝達経路の翻訳を選択的に制御する
翻訳制御因子であるEIF3Dがどのような仕組みでヒトPSCの性質維持に関わっているのかを調べるために、EIF3D発現抑制下における遺伝子発現および翻訳効率の変化を調べました(図2A)。その結果、EIF3Dは翻訳制御を介して、ヒトPSCの自己複製に関わることが知られている複数のシグナル伝達経路(MAPK, Insulin, WNT, TGFβなど)の活性を調節していることがわかりました(図2B,C)。EIF3Dによる翻訳制御は、主要なシグナル伝達経路のバランスを調整することで、分化多能性を維持していることが明らかになりました。
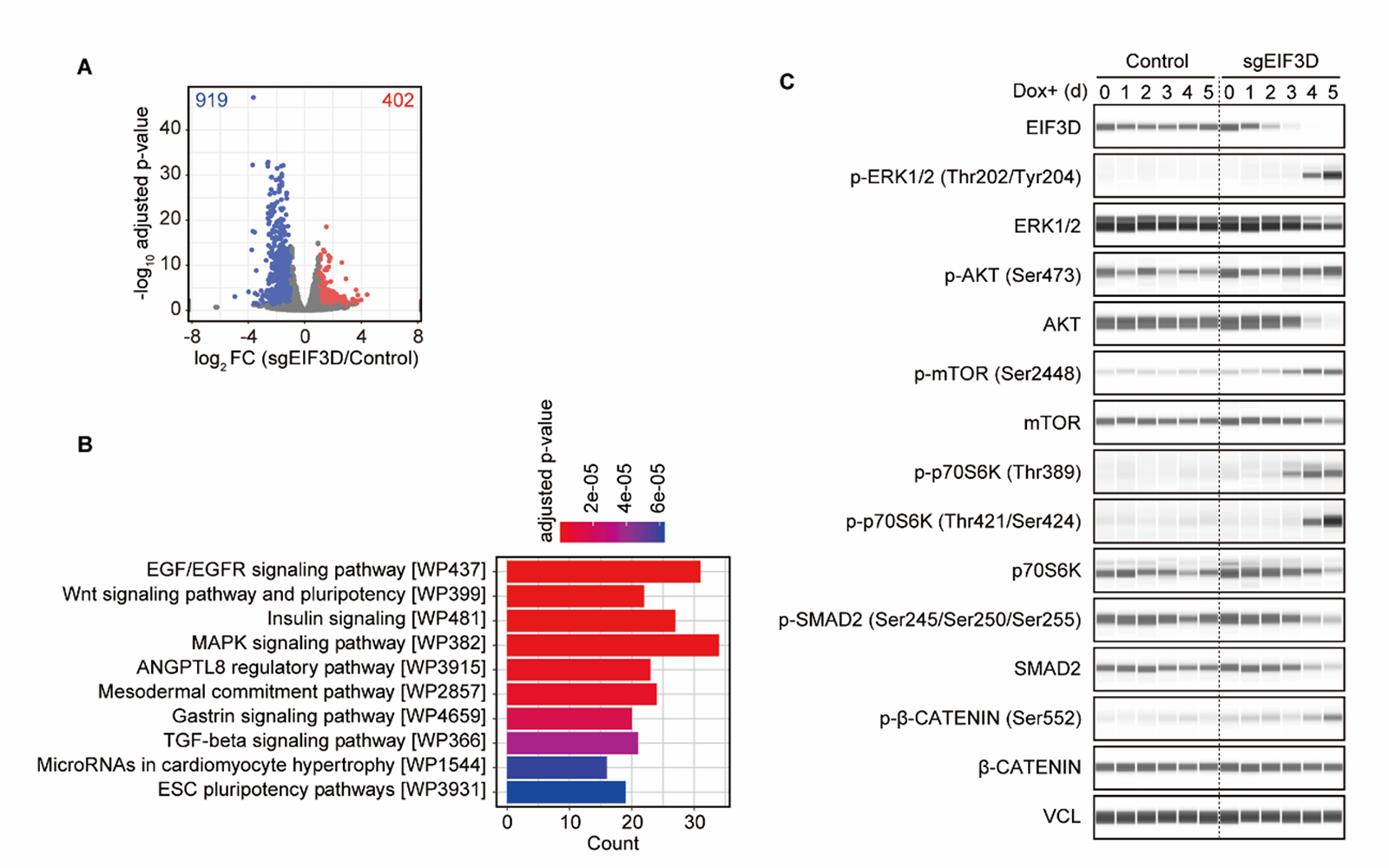
図2. A)翻訳効率の変化結果。青色と赤色がそれぞれFold change 2倍以上で翻訳効率が低下、もしくは上昇した遺伝子。B)EIF3D発現抑制下で翻訳効率が低下した遺伝子のGene Ontology 解析結果。C)EIF3D発現抑制下でのMAPK因子(ERK1/2、p- ERK1/2)、Insulin因子(AKT、p-AKT、mTOR, p-mTOR, p70S6K, p-70S6K)、WNTシグナル因子(β-CATENIN、p-β-CATENIN)、TGFβ因子(SMAD2, p-SMAD2)の変化。VCLはコントロール
3)EIF3Dはp53の活性を抑制しヒトPSCの高い増殖能を維持する
研究グループは、ヒトPSCにおいてEIF3Dの発現を抑制するとp53タンパク質の発現が上昇することに気づきました(図1C)。研究グループが実施した機能スクリーニングにおいて、p53はヒトPSCの自己複製を強力に阻害することがわかっています。そこで、EIF3Dがp53の発現を制御する仕組みを調べました。その結果、EIF3Dはp53タンパク質の発現や安定性を制御する因子群の翻訳を調節することで、p53タンパク質の発現を低く抑えていることがわかりました(図1A, B)。このように、EIF3Dは翻訳制御を介してp53の活性を抑制し、ヒトPSCの高い増殖能を支えていることが明らかになりました。
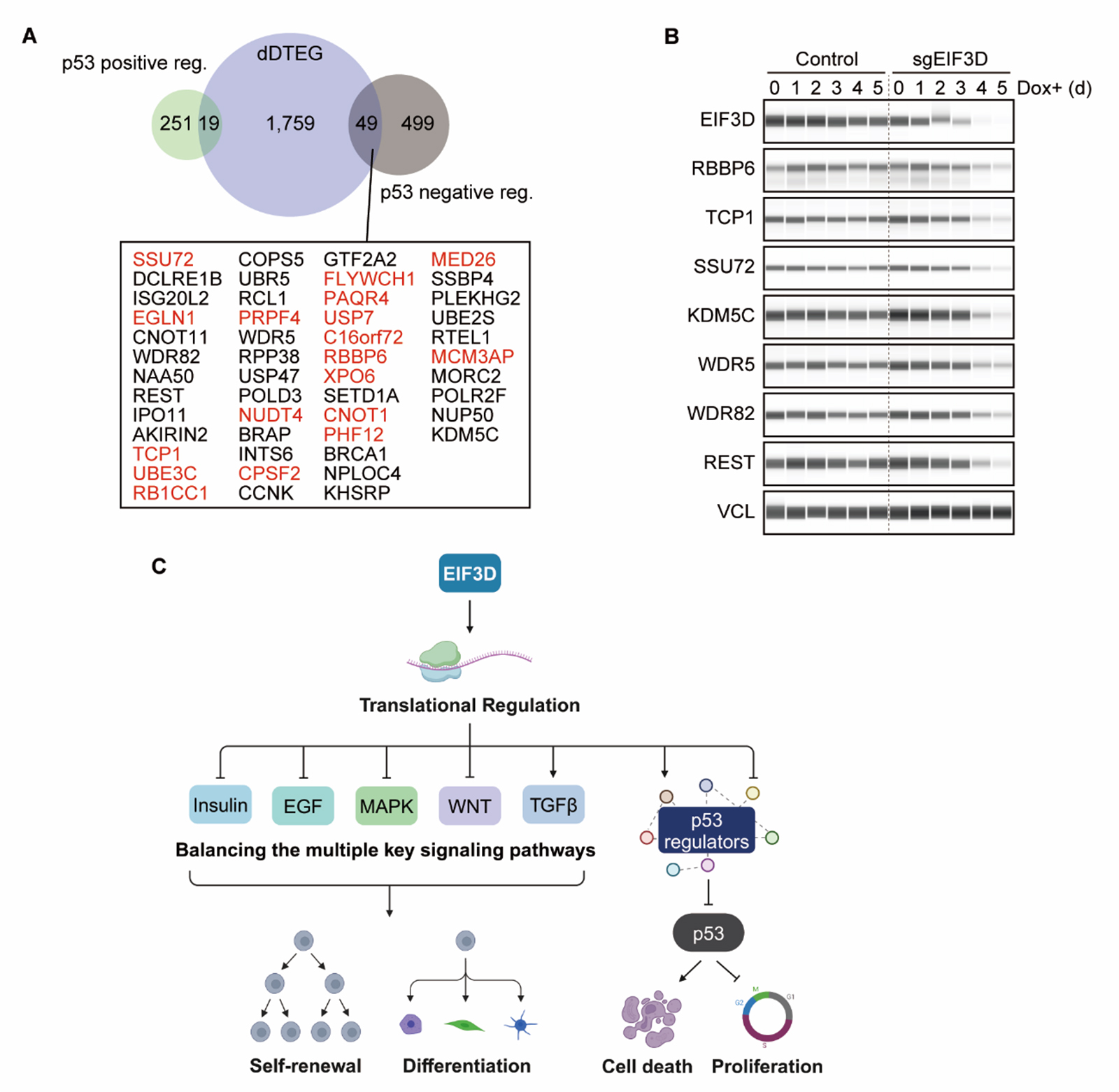
図3. A)EIF3D発現抑制で翻訳効率が低下した遺伝子とp53タンパク質の制御因子の弁図。B)Aで重複した遺伝子の一部遺伝子の発現変化。C)本研究のスキーマ(Created in BioRender. Takahashi, K. (2025) https://BioRender.com/e03i977)
本研究は、EIF3Dの翻訳制御によって複数のシグナル伝達経路の恒常性を維持していることを示しました(図3C)。EIF3Dの機能は、多能性幹細胞にとって重要な2つの特徴、すなわち自己複製・分化、そして強力な増殖能を解明する手がかりとなります。
- 論文名
EIF3D safeguards the homeostasis of key signaling pathways in human primed pluripotency - ジャーナル名
Science Advances - 著者
Chikako Okubo1*, Michiko Nakamura1, Masae Sato1, Yuichi Shichino2, Mari Mito2, Yasuhiro Takashima1, Shintaro Iwasaki2,3, Kazutoshi Takahashi1* - 著者の所属機関
- 京都大学iPS細胞研究所
- 理化学研究所開拓研究本部
- 東京大学大学院 新領域創成科学研究科
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会 科研費(20K20585、21H02155、22K14829)
- 科学技術振興機構 ACT-X(JPMJAX2222)
-
日本医療研究開発機構(AMED)
- 再生・細胞医療・遺伝子治療実現加速化プログラム「再生・細胞医療・遺伝子治療研究中核拠点」
- 武田科学振興財団
- 上原記念財団
- 持田記念財団
- iPS細胞研究基金
注1)翻訳開始因子
mRNA配列に基づいてタンパク質が合成されることを翻訳という。mRNA上の正しい場所を認識しタンパク質の合成を開始させる役割がある。
注2)転写因子
細胞内でDNAの配列に基づいてmRNAを合成することを転写という。転写因子は特定の転写を活性化したり、抑制したりする役割がある。細胞内では様々な転写因子がお互いに複雑に関係しあって、遺伝子の働きを調節している。
注3)エピゲノム
DNAの配列そのものは変化させずに、遺伝子のはたらきを決めるしくみの集まり。化学的修飾によって遺伝子の発現パターンに影響を与えることができる。
注4)CRISPRi 法 (CRISPR interference)
ゲノム編集技術としてよく知られるCRISPR-Cas9の技術を使って、遺伝子の発現を抑制する方法。本来は遺伝子を切断する能力をもつCas9を変化させ、標的遺伝子からmRNAの合成(転写)を抑制する。






















