
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2025年7月2日
ヒトiPS細胞からあごの骨を再現したオルガノイドを作製
ポイント
- ヒトiPS細胞から神経堤細胞を介して顎骨オルガノイドを作製した。
- マウスへ移植した顎骨オルガノイドには血管が侵入し、成熟した骨組織として機能した。
- 骨形成不全症の患者さんのiPS細胞を用いて、生体外の疾患モデルを構築した。
本池総太特命助教、池谷真准教授(CiRA臨床応用研究部門)らのグループは、iPS細胞から3次元的に誘導した神経堤細胞注1)を用いて、あごの骨(顎骨)の発生を再現したオルガノイド注2)を構築しました。さらに、顎骨オルガノイドの移植による顎骨再生治療への応用可能性や、骨形成不全症の疾患モデルとして治療法開発などに役立つ可能性を示しました。
あごは、歯や舌などの口腔の器官とともに呼吸や咀嚼、発声に関わる重要な部位です。全身の主な骨が中胚葉から分化するのに対して、顎骨を含む顔面の骨は、外胚葉から派生した神経堤細胞に由来することが知られています。
本研究では、ヒトiPS細胞由来の神経堤細胞から外胚葉性間葉細胞(mdEM)を経て、顎骨の構造を立体的に再現した顎骨オルガノイドを作製することに成功しました。さらに、顎骨オルガノイドをマウスに移植することで、移植したオルガノイドに血管が侵入し、成熟した骨組織が形成されることを確認しました。この顎骨オルガノイドの作製方法は動物由来成分を使用しないため、将来的に再生医療への応用にも使いやすいと考えられます。
また、全身の骨が脆く、軽い外傷などで骨折をしてしまう希少疾患である骨形成不全症のある患者さん由来のiPS細胞を用いて、顎骨オルガノイドを誘導したところ、未成熟で脆い骨組織が形成されました。この患者さん由来のiPS細胞に対して、骨形成不全症の原因となる遺伝子の変異を修復し、顎骨オルガノイドを誘導したところ、正常な顎骨オルガノイドになることも確認されました。これらの顎骨オルガノイドを用いることで、生体外での疾患研究が容易になり、治療法の開発などに役立つと考えられます
この研究成果は2025年7月2日(英国時間)に、国際科学誌「Nature Biomedical Engineering」でオンライン公開されました。
顎骨は口腔内細菌感染による顎骨骨髄炎や歯周炎・咬合力の過負荷・腫瘍といった多様な病的リスクに常にさらされており、全身的に見ても失われやすい器官であるといえます。さらに、破壊された顎骨は元の状態に戻りにくく、広範囲に及ぶものは致命的な摂食障害に直結します。そのため、再生治療のための移植体や顎骨疾患の病態解析に応用できる"ヒト顎骨そのもの"を作製することが求められます。
顎骨は、ヒトの発生過程に一時的にみられる第1咽頭弓注3)という部位に存在する間葉系細胞(外胚葉性間葉細胞;ectomesenchyme, EM)から形成されます(図1A)。この外胚葉性間葉細胞は、もともと、胚の背側に存在した神経堤細胞が第1咽頭弓へ遊走してできたものです。第1咽頭弓は、その後、さらに付け根側が上顎隆起、先端側が下顎隆起という構造へと分かれて、それぞれ上あごと下あごを形成します(図2A)。このように顎骨は、発生過程が特殊であり、iPS細胞などの多能性幹細胞で分化誘導を再現することが困難でした。
また、全身の主な骨は初めに軟骨が作られ、徐々に硬い骨に置き換わる軟骨内性骨化という骨形成の過程を辿ります。一方で、顎骨の大部分は、軟骨の形成を介さずに直接、骨芽細胞が分化して骨組織になる膜内骨化という方法で形成されることが知られています。
本研究では、この顎骨の発生をより実際に近い三次元培養によって再現できないかと考えました。その結果、神経堤細胞から第1咽頭弓の下顎隆起の外胚葉性間葉細胞をへて、顎骨オルガノイドを構築することに成功しました。さらに、マウスへの移植実験を行い、顎骨オルガノイドが顎骨の再生能力を持つことを確認し、移植治療への応用可能性を示しました。また、骨形成不全症のある患者さんから作製したiPS細胞を用いて、病気の仕組みの詳細な解析や治療法の開発に有用な細胞培養モデルを開発しました。
1)ヒトiPS細胞からHOX遺伝子発現のない神経堤細胞を3次元培養で作製
第1咽頭弓に移動する神経堤細胞はHOX遺伝子群を発現しないという特徴があります(図1A)。研究グループは、これまでに一般的な平面培養でHOX遺伝子群を発現しない神経堤細胞を誘導する方法を開発しています。
この方法を参考に、今回は培養皿上で顎骨の3次元構造の再現を目指すため、ヒトiPS細胞を立体的な凝集体にしたのちに、HOX遺伝子群を発現しない神経堤細胞を非常に効率よく誘導する方法を開発しました(図1B)。
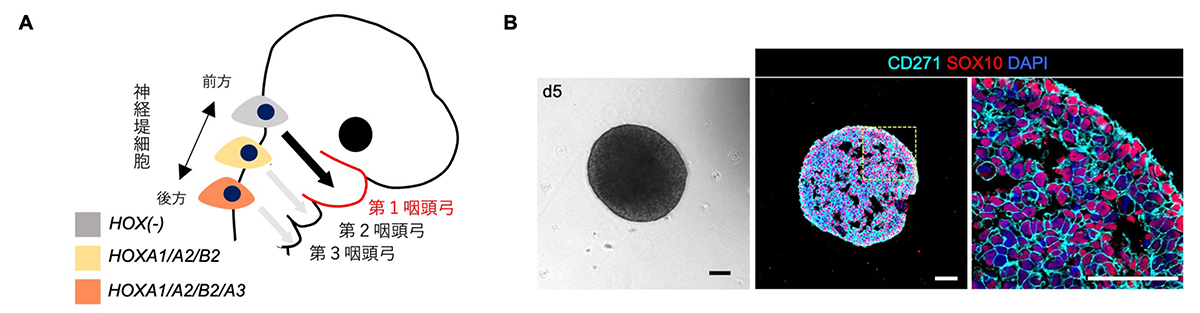
図1. ヒトiPS細胞からHOX遺伝子発現のない神経堤細胞を3次元培養で作製
A:神経堤細胞は背側に存在し、その一部は咽頭弓まで遊走する。胚の前後方向の位置により遺伝子発現が異なり、第1咽頭弓へ遊走する神経堤細胞はHOX遺伝子群の発現がない。
B:ヒトiPS細胞から3次元培養で誘導した神経堤細胞の凝集体(左:明視野、中央・右:免疫染色)。iPS細胞から分化5日目の様子。CD271およびSOX10はいずれも神経堤細胞に特徴的に発現する遺伝子。遺伝子の発現量を調べるRT-qPCR法によりHOX遺伝子群が発現していないことを確認した。
スケールバーは100μm(0.1ミリメートル)。
2)下顎隆起の外胚葉性間葉細胞(mdEM)の誘導
次に、1)で作製したHOX遺伝子を発現していない神経堤細胞の凝集体から、第1咽頭弓の先端(遠位)側から生じる下顎隆起(Mandibular Prominence;md)にみられる外胚葉性間葉細胞(mdEM)(図2A)を誘導する方法を検討しました。
その結果、中心部分から辺縁に向かって下顎隆起と同様の遺伝子発現パターンを示す凝集体を誘導することに成功しました(図2B)。また、さらに培養を行い、後期の発生段階で下顎隆起に生じるより細かな2種類の領域(一番遠位の領域と、将来、歯が形成される近位の領域)の特性を持った細胞集団への分化をそれぞれ誘導することにも成功しました。
これらの実験結果から、ヒトiPS細胞由来神経堤細胞の凝集体から誘導した凝集体が、下顎隆起周辺の領域特性も再現した発生に近い形で分化誘導することに成功したと考えられます。

図2. 下顎隆起の外胚葉性間葉細胞(mdEM)の誘導
A:第1咽頭弓の近位側が上顎隆起に、遠位側が下顎隆起に分かれる。領域によって遺伝子発現パターンが異なる。
B:結果1)で作製した神経堤細胞からさらに誘導した凝集体の免疫染色画像。iPS細胞から分化9日目の様子。スケールバーは100μm(0.1ミリメートル)。
3)ヒトiPS細胞から顎骨オルガノイドの誘導
続けて、2)(図2B)のmdEMを含む凝集体を用いて、顎骨の形成を誘導できるか検証しました。その結果、直径1.0〜1.5ミリメートルの白色の塊が形成され(図3A)、骨組織にみられる石灰化が起きていることが確認されました。さらに組織学的な解析により、骨組織に特有の染色像や細胞外マトリクスが確認されました。
また、免疫染色により、凝集体の表面には骨芽細胞、内部にはアクチン線維で形成される突起構造によりネットワークを形成する成熟した骨細胞が局在する構造が確認されました(図3B)。これらの結果から顎骨の構造を再現した顎骨オルガノイドが形成されたことが示されました。
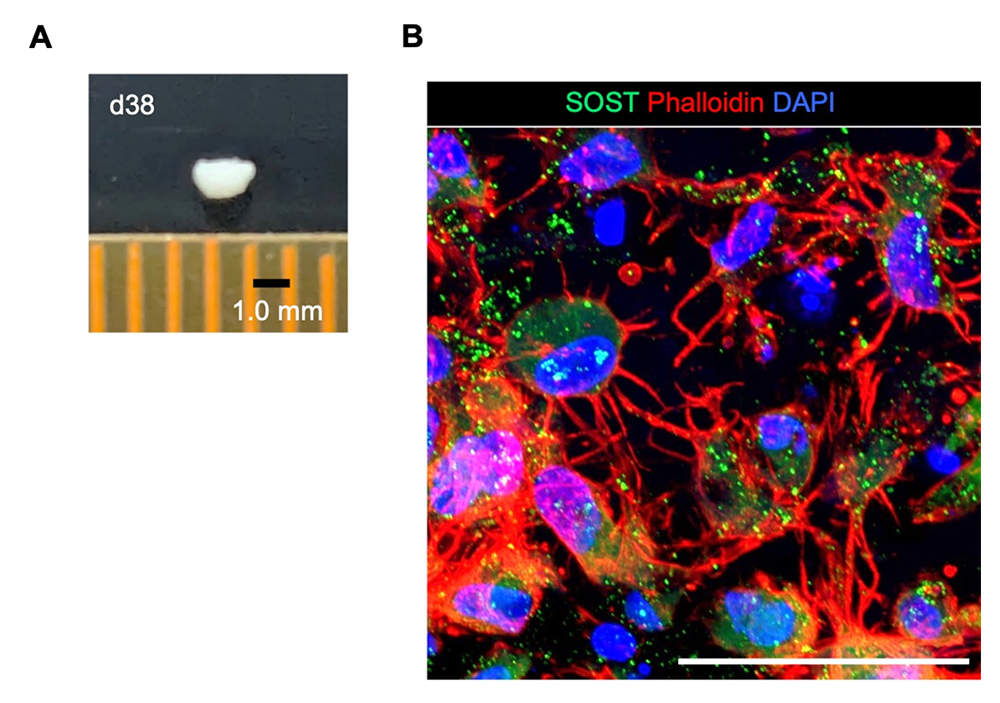
図3. ヒトiPS細胞から顎骨オルガノイドの誘導
A:iPS細胞から分化38日目の凝集体の様子。
B:顎骨オルガノイドの免疫染色像。成熟した骨細胞(SOST)とアクチン線維(Phalloidin)の様子。スケールバーは100μm(0.1ミリメートル)。
4)顎骨オルガノイドの移植による骨再生
研究グループは、顎骨オルガノイドが、血管が侵入する前の顎骨の発生段階を反映していると予想して、血管が多く存在するマウスの腎臓に移植することで、さらに成熟化するのではないかと考えました。マウスへの移植の結果、血管が入り込み、成熟した骨組織が形成されました。腎臓は、本来骨をつくる器官ではないことから、顎骨オルガノイドは骨を形成する環境でなくても自身の能力によって成熟した骨組織を誘導できることが示されました。
さらに、マウス下顎骨に作製した顎骨欠損に対して、複数の顎骨オルガノイドを移植する実験を行いました。その結果、移植4週間後、比較対象として実施した通常の骨移植と同等の骨組織の形成が確認されました(図4A,B)。
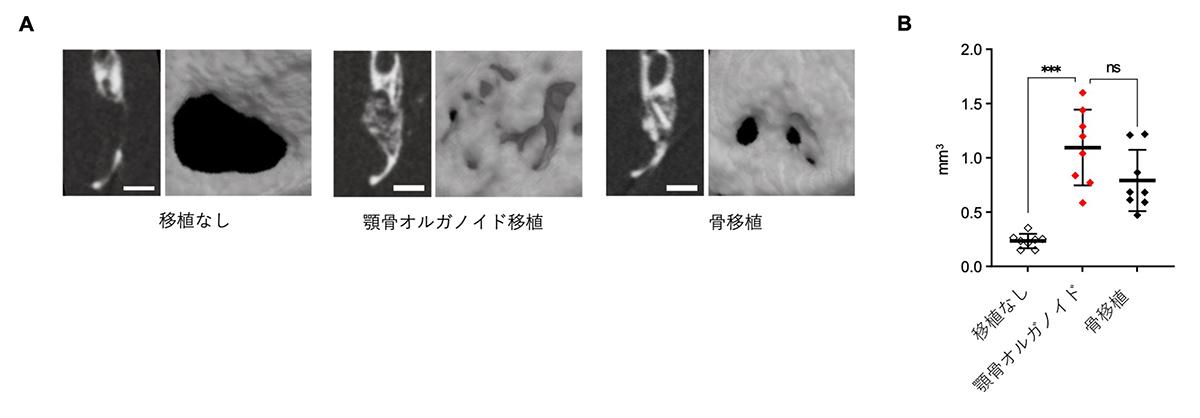
図4. 顎骨オルガノイドの移植による骨再生
A:移植4週間後、各条件によるCT画像(左)と3次元構成したマイクロCT画像(右)。
B:石灰化した組織の容積の比較。
5)骨形成不全症の疾患モデルの構築
さらに、顎骨オルガノイドの生体模倣システムとしての有用性を検証するため、骨形成不全症(Osteogenesis imperfecta; OI)の患者さんから作製したiPS細胞(OI-iPS細胞)を用いて疾患モデルの構築を試みました。研究グループは、疾患モデルと比較するために、OI-iPS細胞から骨形成不全症の原因となる1型コラーゲン遺伝子COL I A1の変異を修復したiPS細胞(resOI-iPS細胞)も作製し、それぞれから顎骨オルガノイドを作製しました。
その結果、骨形成を誘導してから3日目に主要な骨基質タンパクである1型コラーゲンの合成が確認されましたが、OI-iPS細胞由来の凝集体に対して、変性したコラーゲン線維に結合するペプチド(CHP)がよく染色されました(図5A)。また、iPS細胞から分化誘導して38日目のOI-iPS細胞由来オルガノイドの骨細胞は、resOI-iPS細胞と比べて、細胞外マトリクスが未成熟であり、骨細胞の突起によるネットワーク形成が不十分でした(図5B)。これに加えて、マウスへのオルガノイド移植実験などの結果も総合して、OI-iPS細胞と今回の三次元培養による顎骨オルガノイド作製法の組み合わせにより骨形成不全症をよく再現した疾患モデルが構築できたことを確認しました。
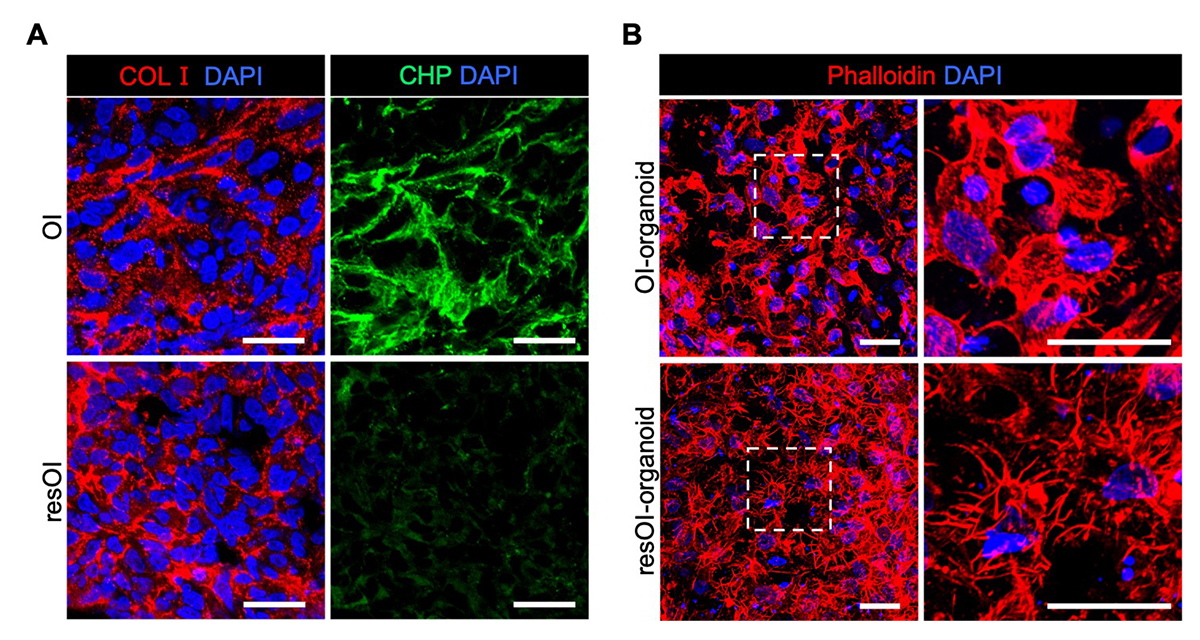
図5. 骨形成不全症の疾患モデルの構築
A:骨形成の誘導3日目の1型コラーゲン(COL1)と変異したコラーゲン線維の指標となるペプチド(CHP)の免疫染色像。スケールバーは25μm
B:2種類のiPS細胞から誘導して38日目の顎骨オルガノイドのアクチン線維の免疫染色像。OI-iPS細胞から誘導したオルガノイド(OI-organoid)では、細胞から伸びる突起が少なく短い。スケールバーは100μm。
本研究では、ヒトiPS細胞からこれまで難しかった顎骨の構造を再現したオルガノイドを動物由来成分を使わず、三次元培養で構築することに成功しました。さらに、顎骨オルガノイドの再生治療のための移植や骨形成不全症の病態解析に応用できる疾患モデルとしての可能性を示しました。
- 論文名
Jawbone-like organoids generated from human pluripotent stem cells - ジャーナル名
Nature Biomedical Engineering - 著者
Souta Motoike1, Yoshiko Inada1, Junya Toguchida1, Mikihito Kajiya2, Makoto Ikeya1*
*:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 広島大学病院
本研究は、下記機関より支援を受けて実施されました。
-
日本医療研究開発機構(AMED)
- 再生医療実現拠点ネットワークプログラム
「再生医療用iPS細胞ストック開発拠点」- 再生・細胞医療・遺伝子治療実現加速化プログラム
「次世代医療を目指した再生・細胞医療・遺伝子治療研究開発拠点」 -
日本学術振興会(JSPS)
- 科研費(JP22H03275, JP23H03028, JP21K16993, JP23K15998)
- 特別研究員奨励費(JP21J01564)
- 公益財団法人 コーセーコスメトロジー研究財団
- 日本歯周病学会シーズ育成若手奨励研究助成制度
- iPS細胞研究基金
- 京都大学研究連携基盤 - 次世代研究者支援(国際学術論文助成)
注1)神経堤細胞
外胚葉の一部から分化し発生の途中で一時的に現れる細胞で、色素細胞、末梢神経、グリア細胞など、さまざまな細胞へと分化する。外胚葉、内胚葉、中胚葉の三胚葉に次ぐ、第四の胚葉とも呼ばれる。骨は通常、中胚葉から分化するが、顔面の骨は神経堤細胞から分化することが知られる。
注2)オルガノイド
多能性幹細胞や組織幹細胞から分化誘導された3次元組織で、生体でみられるような構造や機能を保持しているもののこと。将来的な疾患モデリングや創薬スクリーニングなどへの応用が期待されている。
注3)第1咽頭弓
発生過程で胚の咽頭部に一時的に形成される分節状の構造を咽頭弓という。そのうち、頭部に一番近い咽頭弓を第1咽頭弓という。上顎弓と下顎弓に分かれ、それぞれ上あごと下あごになる。






















