
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2025年9月8日
ヒト末梢血細胞からの高効率なiPS細胞作製法を開発 ―p53経路の調節により初期化効率を10倍以上に向上―
ポイント
-
RNAによるPBMCの初期化に成功
従来困難とされていた末梢血単核球(PBMC)からの合成RNAを用いたiPS細胞の作製に初めて成功しました。 -
p53経路の抑制により初期化効率が劇的に向上
p53の働きを抑制するMDM4を導入することで、PBMCのRNA初期化効率が顕著に向上することを示しました。特に、ユビキチン化分解を受けにくい変異を加えたMDM4が最も高い効果を示しました。 -
作製したPBMC由来iPS細胞は角膜細胞へ分化可能
合成RNAを用いて初期化したPBMC由来iPS細胞は、三胚葉すべてへの分化能をもち、特に角膜上皮様細胞への分化誘導にも成功し、その多能性を実証しました。
中川誠人講師(京都大学iPS細胞研究所(CiRA)、大阪大学ヒューマン・メタバース疾患研究拠点(WPI-PRIMe)特任准教授(常勤))らの研究グループは、ヒト末梢血由来単核球(PBMC)注1)から合成RNA注2)を用いて高効率にiPS細胞(人工多能性幹細胞)注3)を作製する方法を確立しました。本研究は、これまで困難とされていたヒト血液細胞からの非ウイルス的なiPS細胞作製を実現するための解決策を提示するものであり、今後の再生医療や個別化医療への応用が期待されます。
この研究成果は2025年9月8日(英国時間)に、Springer Nature社のオープンアクセス科学雑誌『Scientific Reports』にオンライン公開されました。また、論文公開後、本研究で開発した合成RNAを使った体細胞(ヒト線維芽細胞(HDF)およびPBMC)初期化プロトコール(日本語版および英語版)をCiRAホームページに掲載しました。

概要図
(Biorender.comを利用して作成)
iPS細胞は、さまざまな体細胞を初期化(リプログラミング)注4)して作製することができ、再生医療注5)や創薬、疾患モデル注6)に広く活用されています。なかでも、末梢血単核球(PBMC)は、採取が低侵襲かつ容易であり、患者さんからiPS細胞を樹立するためのもととなる細胞として非常に有望です。しかし、PBMCは外部からの遺伝子導入に伴うストレスに弱く、多くの細胞が死んでしまうという課題があり、非ウイルス・非遺伝子組換えの安全な手法として注目されているRNA導入法注7)による初期化(RNA初期化)は、技術的に困難とされてきました。しかし、RNA初期化はゲノムに変異を残さず、臨床応用を見据えた安全性の高い技術として今後の標準化が期待されています。
そこで本研究では、PBMCにおけるRNA初期化の障壁を明らかにし、その克服法を開発することを目的としました。特に、ストレス応答経路であるp53注8)経路の過剰活性化に注目し、その調節によってRNA初期化の効率が改善できるかどうかを検討しました。
本研究では、合成RNAを用いてヒト末梢血単核球(PBMC)からiPS細胞を作製する新たな方法を開発しました。従来、PBMCは初期化効率が低く、特に合成RNAを用いてiPS細胞を作製することは困難とされていました。本研究では、以下の成果が得られました。
1)p53の負の調節因子であるMDM4の導入により、初期化効率が劇的に改善
特に、ユビキチン化分解を回避するS367A変異を導入したMDM4注9)(MDM4-S367A)が最も高い効果を示し、初期化効率が約10倍以上に増加しました。
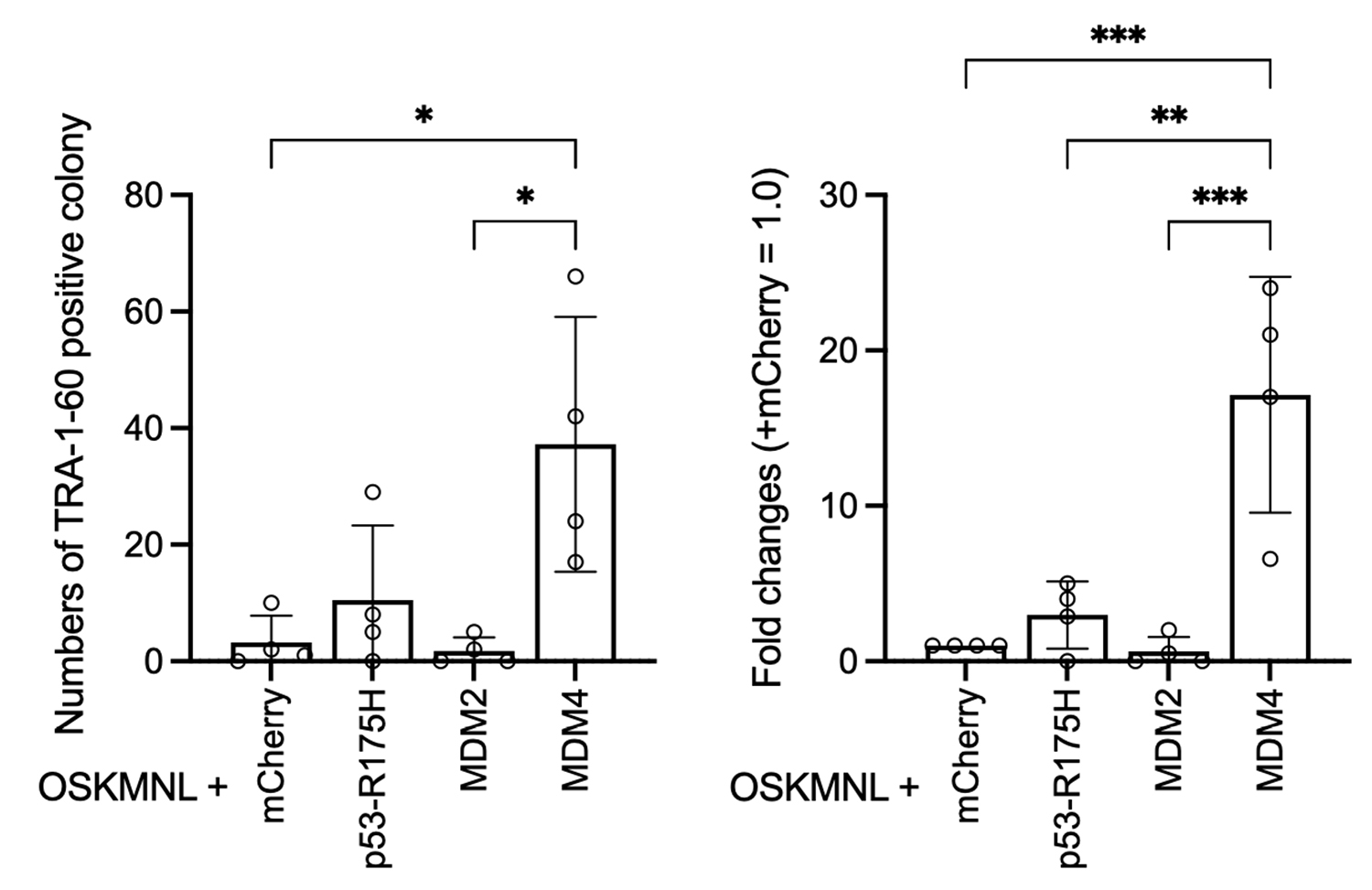
初期化因子(OSKMNL)に加えてmCherry、p53-R175H、MDM2、またはMDM4の合成mRNAをPBMCに導入して初期化を行い、出現したiPS細胞様コロニーを多能性マーカー(未分化マーカー)注10)のTRA-1-60抗体で染色し、コロニー数をカウントした結果(左のグラフ)。その値を元にmCherryを加えた場合を1としたときの倍加量を計算した(右のグラフ)。MDM4を加えた場合に10倍以上の倍加量が確認された。
2)複数ドナー由来のPBMCでの再現性を確認
8名の健常人ドナーのPBMCを用いた初期化でも、MDM4-S367Aの効果が一貫して認められました。
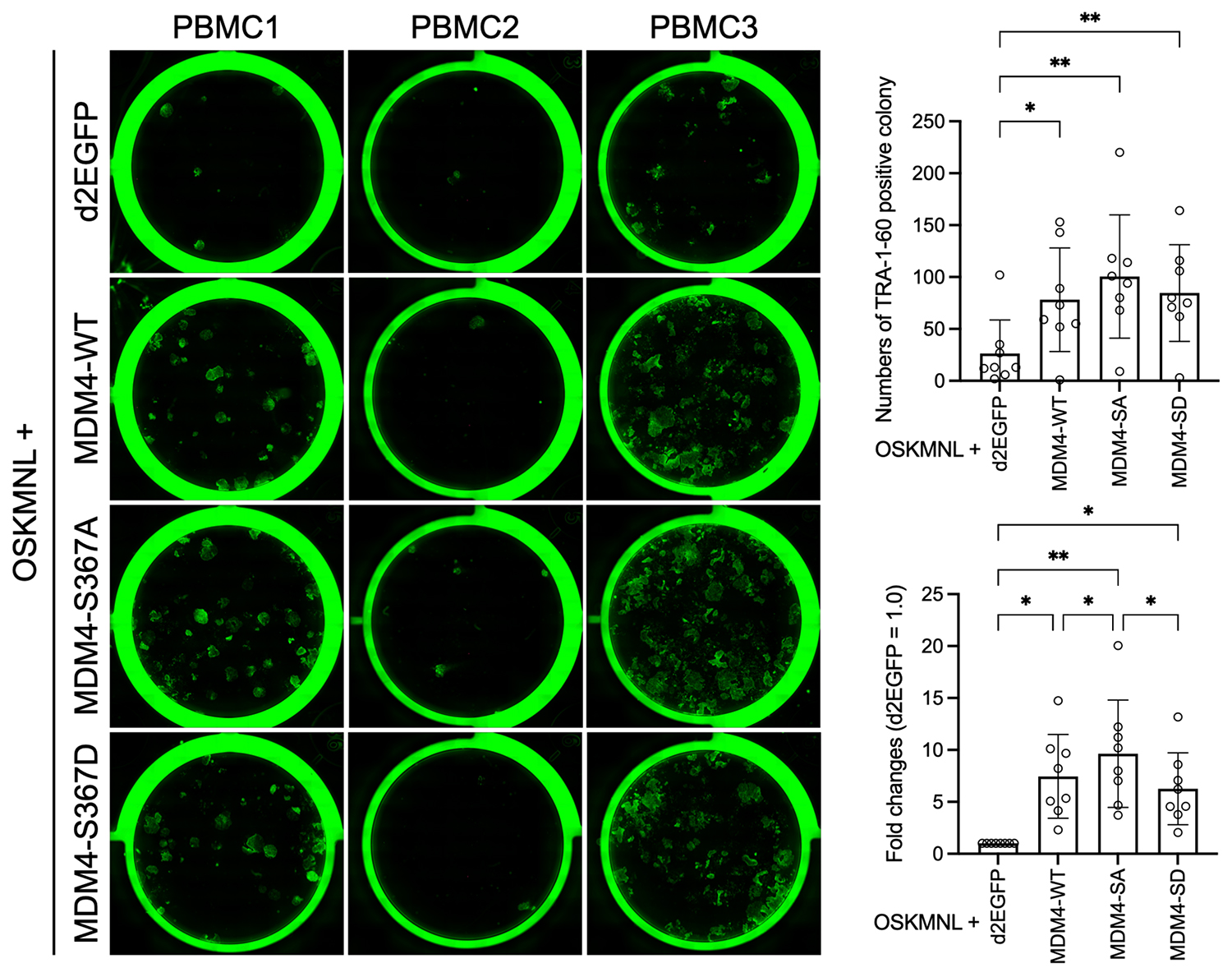
初期化因子(OSKMNL)に加えてd2EGFP、MDM4-WT(野生型)、MDM4-S367A(非リン酸化型)、MDM4-S367D(リン酸化模倣型)の合成RNAをPBMCに導入して初期化を行い、出現したiPS細胞様コロニーをTRA-1-60抗体で染色し(左の写真、緑色に見えるのがiPS細胞様コロニー)、コロニー数をカウントした結果(右上のグラフ)。その値を元にd2EGFPを加えた場合を1としたときの倍加量を計算した(右下のグラフ)。免疫染色は3人分のドナー由来の結果を示した。コロニーカウントの実験は8人分のドナー由来のデータを用いた。
3)樹立したiPS細胞の品質を多面的に検証
RNA初期化により樹立したPBMC由来iPS細胞は、未分化マーカーの発現、三胚葉注11)への分化能、正常な核型注12)を示し、多能性幹細胞としての性質を備えていることが確認されました。

PBMCから合成RNAを使って樹立したiPS細胞の写真(左上2枚)とそれらの核型解析結果(左下2枚)。ともに正常な核型であることを確認した。それらのiPS細胞と以前に樹立済みで多数の論文で使用されているiPS細胞(201B7、1383D2)を未分化維持条件で培養した場合(右グラフのbFGF(+))と自発的に三胚葉系の細胞に分化する条件で培養した場合(右グラフのbFGF(-))における遺伝子発現をRT-qPCRによって検証した結果(右のグラフ4つ)。bFGF(-)の条件で三胚葉マーカーの発現が確認できた。
4)角膜上皮細胞への分化誘導を実施し、臨床応用の可能性を実証
樹立したPBMC由来iPS細胞を角膜上皮細胞注13)へと分化誘導し、KRT12やPAX6などのマーカー発現を確認。視覚再生医療への応用可能性を示唆しました。
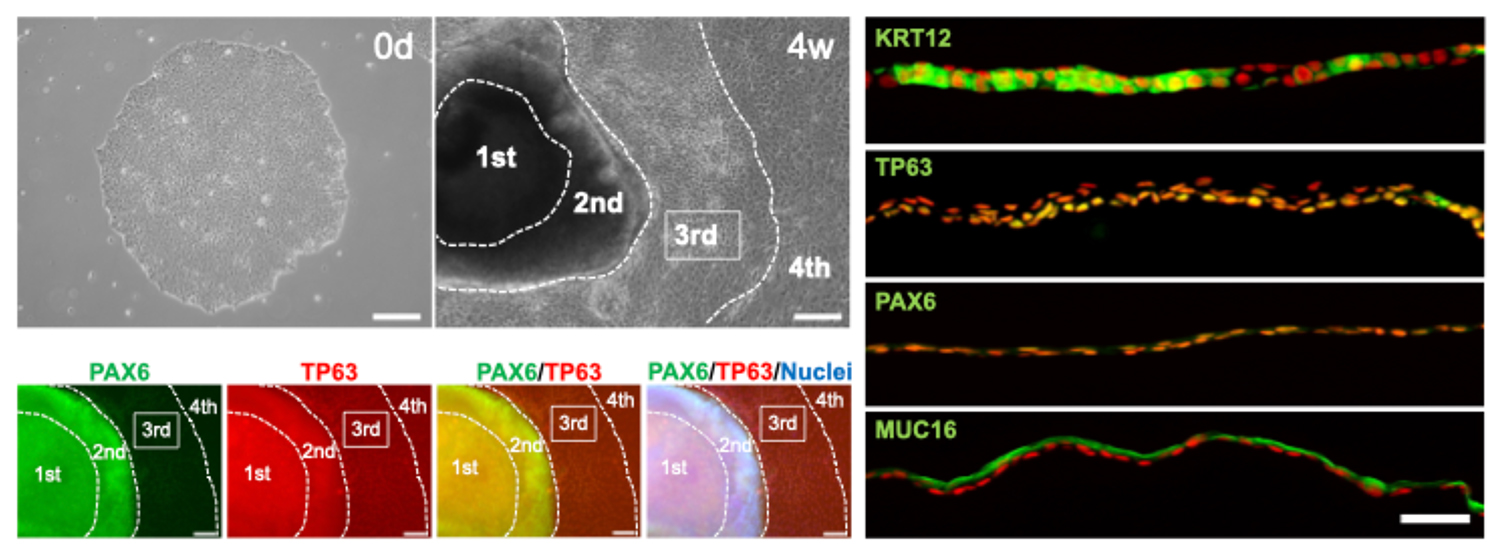
PBMCから合成RNAを使って樹立したiPS細胞を使って角膜上皮組織を作製。未分化状態のiPS細胞(左上の写真、MN328)と分化誘導された角膜の2次元組織体(SEAM)(上・左から2枚目の写真、MN328)。SEAMの第3領域(3rd)にPAX6陽性かつTP63陽性の角膜上皮前駆細胞が誘導されているのが確認できた(左下の4枚の写真、免疫染色データ)。その前駆細胞を単離し、KRT12陽性かつPAX6陽性の角膜上皮組織を作製した(右の4枚の写真、免疫染色データ)。
- PBMCにおけるRNA初期化効率は、p53経路の過剰活性化によるアポトーシスの誘導によって大きく制限されている可能性が示唆された。
- MDM4の変異体(S367A)を併用することで、PBMCに特有な初期化バリアを乗り越えることができ、初期化効率が大幅に向上した。
- 本手法は再現性が高く、実用性のある技術である(他ラボ・施設にて確認済み)。
- RNA初期化法の臨床適合性とMDM4併用による安全性向上が確認されたことから、今後の再生医療応用にも適した手法であると考えられる。
今後は、PBMCから得られるiPS細胞を用いた疾患モデルの構築や、個別化医療への応用を進めていきます。また、今回のプロトコールが、より安全で実用的なiPS細胞作製法として臨床現場でも活用されることが期待されます。
- 論文名
MDM4 enables efficient human iPS cell generation from PBMCs using synthetic RNAs - ジャーナル名
Scientific Reports - 著者
Masato Nakagawa1,2,#,*, Mizuho Nogi1,#, Hatsuki Doi1, Ryuhei Hayashi3,4, Tomohiko Katayama2,3,
Hirohisa Ohno1, Megumi Mochizuki1, Karin Hayashi1, Hirohide Saito1,5
#:共同筆頭著者
*:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 大阪大学ヒューマン・メタバース疾患研究拠点(WPI-PRIMe)
- 大阪大学大学院医学系研究科眼科学
- 大阪大学大学院医学系研究科幹細胞応用医学
- 東京大学定量生命科学研究所
「PBMCからRNAだけでiPS細胞を作製することは近々の課題でした。今回、p53経路を制御するMDM4の効果により、その壁を乗り越えることができました。このプロトコールは、研究用途だけでなく、今後の臨床応用にも大きく貢献すると考えています。」— 中川誠人
本研究は、下記機関より支援を受けて実施されました。
-
日本医療研究開発機構(AMED)
- 再生医療実現拠点ネットワークプログラム「再生医療用iPS細胞ストック開発拠点」
- 再生・細胞医療・遺伝子治療実現加速化プログラム「次世代医療を目指した再生・細胞医療・遺伝子治療研究開発拠点」
- iPS細胞研究基金
-
科学技術振興機構(JST)
- 創発的研究支援事業(JPMJFR210W)
-
日本学術振興会(JSPS)
- 科研費(23H03060、23K27751)
本論文で用いた多能性幹細胞の製造法については日本出願が特許査定になっています。
注1)末梢血単核球(PBMC)
Peripheral Blood Mononuclear Cellの略で、血液中に含まれる白血球の一部です。主にT細胞やB細胞、単球などからなり、免疫に関わる重要な働きをします。採血だけで手に入るため、患者ごとのiPS細胞作製に利用しやすい細胞です。
注2)合成RNA
人工的に設計・合成されたRNA分子で、必要な遺伝子情報だけを一時的に細胞に届けることができます。合成RNAは分解されやすく、体に長く残らないため、安全性の高い遺伝子導入法とされています。
注3)iPS細胞(人工多能性幹細胞)
皮膚や血液などの体細胞に特定の遺伝子を導入してつくられる細胞で、体内のさまざまな細胞(神経、心筋、肝臓など)に変化する能力をもっています。再生医療や病気の研究、薬の開発などに広く応用が期待されています。
注4)初期化(リプログラミング)
皮膚や血液などの分化した細胞に遺伝子を導入して、受精卵のような「未分化」で万能な状態に戻す操作です。iPS細胞の作製にはこの初期化技術が不可欠です。
注5)再生医療
失われた組織や臓器の機能を回復させる治療法で、iPS細胞を使って体内の細胞を補ったり、修復したりすることが期待されています。将来的には神経疾患、心臓病、糖尿病などの治療に応用が見込まれています。
注6)疾患モデル
ある病気の原因や進行メカニズムを詳しく調べるために作られた、病気を模した細胞や動物などのことです。患者さんの細胞からiPS細胞を作り、それを病気の影響を受ける細胞(たとえば神経細胞や心筋細胞)に分化させることで、試験管の中で「病気の進行」を再現することができ、新しい薬の開発や治療法の発見に活用されています。
注7)RNA導入法
合成したRNA(リボ核酸)を細胞に一時的に導入して、目的の遺伝子を働かせる方法です。ウイルスを使わないため、安全性が高く、ゲノムに傷をつけないのが特徴です。
注8)p53
がん抑制遺伝子の一つ。細胞に異常があると自動的に増えて細胞死を引き起こし、がん化を防ぐ重要なタンパク質です。しかしiPS細胞をつくるときには、p53が働きすぎると細胞が死んでしまうため、適度に抑える必要があります。
注9)MDM4
p53の働きを制御するタンパク質の一つで、過剰なp53の活動を抑える役割を果たします(負の調節因子)。本研究では、MDM4の一部を改変したRNAを導入することで、p53を安全に抑え、iPS細胞の作製効率を高めました。
注10)多能性マーカー(未分化マーカー)
iPS細胞が「多能性(多くの細胞に分化できる能力)」を獲得したかどうかを判断するための目印となるタンパク質です。TRA-1-60やOCT3/4、NANOGなどがあり、免疫染色やPCRという方法などで確認します。
注11)三胚葉
ヒトの体は発生の初期段階で、「外胚葉(がいはいよう)」「中胚葉(ちゅうはいよう)」「内胚葉(ないはいよう)」の3つの層(=三胚葉)に分かれ、それぞれから神経、筋肉、内臓などさまざまな組織が作られます。iPS細胞がこの三胚葉すべてに分化できるかどうかは、多能性(さまざまな細胞に変化できる能力)を確認するための重要な指標です。
注12)核型
細胞の核の中にある染色体の数や構造のことです。ヒトの場合、正常な核型は46本(23対)の染色体からなり、iPS細胞でもこれが保たれていることが、安全性や品質管理のうえで非常に重要です。核型に異常があると、がん化のリスクや分化異常の可能性があります。
注13)角膜上皮細胞
目の最も外側にある透明な膜「角膜」を構成する細胞で、視力を保つうえで重要な役割を果たしています。iPS細胞から角膜上皮細胞をつくる研究は、失明した患者への治療にもつながる最先端医療の一つです。






















