
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2013年9月27日
パーキンソン病のiPS細胞治療において自家移植では免疫反応がおこらない可能性が大きい 霊長類にて初めて実証
森実飛鳥助教(京都大学CiRA臨床応用研究部門)、髙橋淳教授(京都大学CiRA臨床応用研究部門)らの研究グループは、霊長類(カニクイザル)を用いて、iPS細胞から作製した神経細胞を脳に移植し、自家移植(自分自身の細胞を移植すること)と他家移植(同じ種の別個体の細胞を移植すること)における免疫応答の影響を調べ、自家移植では免疫応答がおこらない事を霊長類にて初めて実証しました。
本研究成果は2013年9月26日正午(米国東海岸時間)に米国科学雑誌「Stem Cell Reports」で公開されました。
ポイント
- 健常な霊長類(カニクイザル)を用い、自家移植と他家移植での、iPS細胞由来ドパミン産生神経細胞移植後の免疫反応と細胞生着を比較検討した。
- 他家移植では免疫反応がみられたが、自家移植ではほとんど免疫反応がなかった。
- パーキンソン病のiPS細胞による細胞移植治療の臨床応用に向けて、免疫学的観点からは、自家移植が有望であることの科学的根拠を初めて示した。
森実飛鳥助教らの研究グループは、健常なカニクイザルを用いて、iPS細胞から作製した神経細胞を脳に移植し、自家移植と他家移植における免疫応答の影響を調べました。自家移植の場合はほとんど免疫反応を起こすことなく神経細胞が生着することを明らかにしました。一方、他家移植の場合、ミクログリア注1)やリンパ球による免疫反応が起きていました。iPS細胞の利点の一つは自家移植が可能になったことですが、これまでのマウス等の研究では、iPS細胞を用いた自家移植でも免疫反応がみられるという報告とみられないという報告があり、議論が続いています。またこれらの実験は、いずれも臨床応用を想定した実験系ではありませんでした。今回、健常な霊長類を用いてパーキンソン病におけるiPS細胞移植の臨床応用を想定した直接比較実験系により、iPS細胞由来神経細胞の自家移植では免疫反応がほとんどみられず、他家移植に比べ免疫反応や細胞生着の観点から優れていることをデータとして示すことができました。
パーキンソン病は、進行性の神経難病で、脳の中でドパミン産生神経細胞注2)が減ることでドパミン量が減り、手足が震える、体がこわばって動きにくくなるなどの症状がでます。これまでの、薬物や電極を用いた治療法では、症状の改善はできてもドパミン産生神経細胞の減少を食い止める事はできませんでした。そこで、細胞移植によって神経細胞を補い、新たな神経回路の形成を促して脳の機能を再生させるという、より積極的な治療法に期待が寄せられています。ヒトiPS細胞もその移植細胞の供給源のひとつと考えられています。
iPS細胞は、患者さん自身から作製した細胞を用いた自家移植につながると期待されています。自家移植で免疫反応が起こらなければ免疫抑制剤を使う必要がなく、免疫抑制による副作用を回避できますが、これまでのマウスを用いた研究では、iPS細胞を用いた自家移植で免疫反応がみられるという報告とみられないという報告があり、議論に決着がついていません。また、これらは臨床応用を想定したような、iPS細胞から誘導した分化細胞の移植ではありませんでした。その上、霊長類で自家移植と他家移植の影響を直接調べた論文は発表されておらず、実際の臨床応用に際してiPS細胞を用いた自家移植の有用性は分からない状況でした。そこで、本研究ではカニクイザルの脳にiPS細胞から作製したドパミン産生神経細胞を移植し、自家移植と他家移植における免疫反応を比較しました。
1) 健常な霊長類のiPS細胞からドパミン産生神経細胞を作製し、細胞移植を行った。
まず、2頭(No.1とNo.4)のカニクイザルの皮膚線維芽細胞から、レトロウイルスベクター注3)を用いて初期化因子を導入しiPS細胞を作製しました。加えて、2頭(No.6とNo.8)のカニクイザルの末梢血からエピソーマルベクター注4)を用いてiPS細胞を作製しました。免疫反応を直接比較するため、同じ細胞株を用いて自家移植と他家移植を行い、4ペアで実験を繰り返しました(Fig. 1)。その後、これまでに報告されている方法に改良を加え、28日間かけてドパミン産生神経細胞へと分化させ(Fig. 2)、脳内に移植したのち約3ヶ月間免疫抑制剤を使用することなく観察しました。

Fig. 1 移植細胞と移植を受けるサルの組み合わせ
No.は個体識別番号
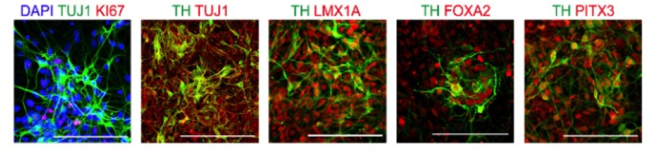
Fig. 2 カニクイザルから作製した神経細胞の免疫染色
ドパミン産生神経細胞に特徴的なマーカーを検出できた。
DAPI:細胞核、TUJI:神経細胞、K167:細胞分裂マーカー、
TH, LMX1A, FOXA2, PITX3:ドパミン産生神経細胞マーカー
2) 自家移植ではほとんど免疫反応なしにドパミン産生神経細胞が生着
PET注5)や免疫組織化学染色から、他家移植の場合、免疫反応を担うミクログリアやリンパ球が移植部位に集まっていることが明らかになりました。一方、自家移植ではそのような免疫反応を検出することができませんでした。さらに、MRI注6)や免疫組織学的な実験により、移植された細胞は自家、他家共に、3〜4ヶ月後も免疫抑制剤を使用することなく生着していることがわかりました。ただし、自家移植においてより多くのドパミン産生神経細胞が生着していました。
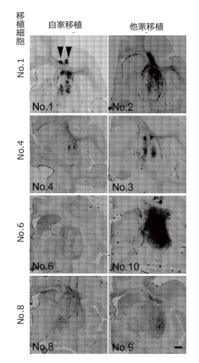
Fig. 3 移植後の脳におけるミクログリアの様子(抗MHC-II抗体による染色)
黒く染まっている部分がミクログリア。それぞれのペアにおいて他家移植
のほうが、より多くのミクログリアが移植された細胞近辺に集まっている
ことが分かる。矢頭:移植部位
iPS細胞の出現によって自家移植が可能になりましたが、霊長類において本当に免疫反応が起こらないのか、他家移植と比べてどれくらい違いがあるのかについては明らかにされていませんでした。本研究では、健常な霊長類を用いて、自家移植と他家移植における免疫反応や細胞生着数を直接比較することによって、パーキンソン病の臨床応用に向けては、自家移植のほうが望ましいことをデータとして初めて示したことに意義があります。免疫抑制剤を用いなくても免疫反応がなくiPS細胞から作製したドパミン産生神経細胞がよく生着していたという結果は、iPS細胞を用いた脳への神経細胞自家移植では免疫抑制の必要がないという方針を立てる上で重要な意味をもちます。一方、他家移植でも免疫抑制剤を用いずとも細胞がすべて拒絶されるわけではなく、多くのドパミン神経細胞が生着することが明らかになりました。もともと脳は免疫反応が弱い臓器として知られているのである程度予想できたことですが、自家移植との直接比較で違いを示すことができたことに意義があります。また今回の実験で、PETを用いて経時的に免疫反応を監視できることが確認できたので、患者さんに免疫抑制剤を投与するさいに、投与量の検討に用いることが期待されます。
今回の研究では、免疫反応と細胞生着の点で自家移植の有用性が証明されましたが、自家移植ではコストや時間がかかるという問題点があります。また、パーキンソン病の患者さんから作製したドパミン神経細胞が正常に機能するのかどうかという点も検証する必要があります。今回の研究で自家移植と他家移植の違いが明らかになったので、HLA型を合わせたiPS細胞による他家移植で免疫反応がどの程度軽減されるのかが今後の課題です。
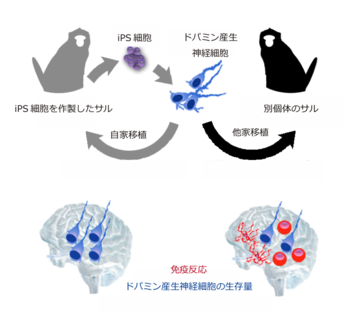
Fig. 4 本研究の成果
ドパミン産生神経細胞に特徴的なマーカーを検出できた。
iPS細胞から作製したドパミン産生神経細胞の自家移植と他家移植を比較し、自家移植では免疫反応がほとんどおきずにドパミン産生神経細胞が生着していることを明らかにした。また、他家移植では免疫反応がわずかに起こっていたものの、ドパミン産生神経細胞の生着が認められた。
- 論文名
Direct Comparison of Autologous and Allogeneic Transplantation of iPSC-Derived Neural Cells in the Brain of a Nonhuman Primate - ジャーナル名
Stem Cell Reports - 著者
Asuka Morizane1, Daisuke Doi1, Tetsuhiro Kikuchi1, Keisuke Okita1, Akitsu Hotta1,2,3, Toshiyuki Kawasaki4, Takuya Hayashi4, Hirotaka Onoe4, Takashi Shiina5, Shinya Yamanaka1,6, Jun Takahashi1,7,8* - 著者の所属機関
- 京都大学iPS細胞研究所
- 科学技術振興機構 さきがけ
- 京都大学物質--細胞統合システム拠点
- 理化学研究所ライフサイエンス技術基盤研究センター
- 東海大学医学部
- グラッドストーン研究所
- 京都大学再生医科学研究所
- 京都大学大学院医学研究科
本研究は、下記機関より資金的支援を受けて実施されました。
- 文部科学省「再生医療の実現化ハイウェイ」
- 内閣府「最先端研究開発支援プログラム(FIRST)」
- 清水免疫学・神経科学振興財団
注1) ミクログリア
脳や脊髄に存在するグリア細胞の一種。脳内をパトロールし、神経細胞の異常を感知したら修復を助け、細菌などの異物を攻撃するなど、免疫防御反応を担う。
注2) ドパミン産生神経細胞
神経細胞の一種で、神経伝達物質としてドパミンを放出する。多くのパーキンソン病では、中脳黒質にあるドパミン産生神経細胞の変性が主な病理として知られている。
注3) レトロウイルスベクター
ベクターとは、細胞外から内部へ遺伝子を導入する際の「運び屋」を指す。ウイルス由来のベクターは、遺伝子導入効率の高さから盛んに開発されてきた。目的遺伝子をウイルスに組み込み、細胞に感染させることにより遺伝子を導入する。レトロウイルスベクターは、このウイルスベクターの1種類として確立されたもので、宿主の細胞に感染したあと、宿主のDNAのなかに入り込み、自らのウイルスを増殖させる性質を利用するものである。
注4) エピソーマルプラスミドベクター
目的の遺伝子を細胞内部へと導入するためのベクター(運び屋)の一種の環状DNA。宿主DNA(染色体)の中に遺伝子を入り込ませずに細胞内で自律的に増殖する。
注5) PET
プラスの電気を帯びた電子を放出する同位元素(アイソトープ)で標識された薬剤を注射し、体内分布を特殊なカメラで断層撮影する装置。生体の機能を画像化でき、がんの性質などの検査に有用な診断機器。
注6) MRI
核磁気共鳴という原理を利用して生体内の断面画像を解析できる方法。CT検査に比べより高解像度の3次元情報を得ることができる。






















