
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2014年8月19日
標的細胞を認識・制御する機能性RNA-タンパク質ナノ構造体の構築とその一分子観察に成功
長田江里子研究員(京都大学CiRA初期化機構研究部門)、遠藤政幸准教授(京都大学iCeMS)、齊藤博英准教授(京都大学CiRA初期化機構研究部門、白眉センター)らの研究グループは、RNA-Protein (RNP) 注1相互作用を基盤とする機能性RNPナノ構造体を創製する技術の拡張と、高速原子間力顕微鏡(高速AFM)注2を用いたナノ構造体の構造変換過程の一分子観察に成功しました。さらに、標的乳がん細胞選択的に結合し、目的遺伝子の発現を抑制できる機能性RNPナノ構造体を開発することに成功しました。本研究成果は2014年7月24日に米国化学会雑誌「ACS Nano」のオンライン版で公開されました。
ポイント
・高速AFMを用いて、タンパク質との相互作用によりRNAナノ構造体が1辺 約20 nmの三角形状構造へと構造変換する様子を高解像度で直接観察することに成功しました。
・標的とする乳がん細胞を選択的に認識・検出できる機能性RNPナノ構造体を創製しました。
・機能性RNPナノ構造体を創製する技術は、薬物送達システム、ナノデバイス、生体イメージング分野などへの応用が期待されます。
1.要旨
近年、DNAやRNAなどの生体高分子を活用してナノサイズの構造体を創製する研究が注目されています。最近、齊藤准教授らのグループでは、RNP相互作用を基盤とするナノ構造体の設計と構築に成功しました(Ohno H. et al, Nat. Nanotech. 2011)。しかしながら従来の観察法では、溶液中におけるRNPナノ構造体の微細な構造や、RNP相互作用のダイナミクスを捉えることは困難でした。また、医療応用を見据えた、RNPナノ構造体による哺乳類細胞の機能制御も実現できていませんでした。本研究では高速AFMを用いて、高解像度でRNPナノ正三角形を観察することに成功し、RNAナノ構造体がタンパク質との相互作用により構造変換する様子を直接観察することに成功しました。興味深いことに、フレキシブルな二本鎖RNA上の特定の3箇所に挿入したキンクターンRNA注3にリボソーム注4タンパク質L7Aeが結合すると、ドーナツ状の柔らかなRNA構造体からリジッドな三角形構造体へと構造がダイナミックに変換しました。さらに我々は、標的乳がん細胞を選択的に認識・検出する機能性RNPナノ構造体を創製しました。特定の乳がん細胞表面上で発現しているHER2レセプターを特異的に認識するRNPナノ構造体を作製し、そのHER2発現量の異なる乳がん細胞へ投与したところ、このRNPナノ構造体は標的乳がん細胞を選択的に認識しました。今回創製したRNPナノ構造体は、細胞表面上で発現しているレセプターを選択的に認識することができるため、標的細胞へのデリバリーを可能とします。さらに、標的遺伝子の働きを抑制する(ノックダウンする)低分子二本鎖RNA (siRNA)をRNPナノ構造体に装着することで、細胞内で効率よく遺伝子制御を実現できることも見出しました。機能性RNPナノ構造体を創製する本技術を応用することで、未分化細胞や標的がん細胞を選別し、選択的に細胞死を誘導する方法などへの応用が期待されます。
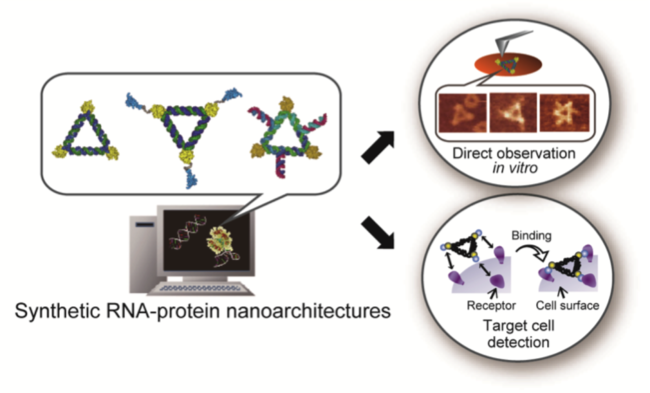
図1 人工RNA−タンパク質ナノ構造体を活用した一分子観察、及び標的細胞の検出
2.研究の背景
齊藤准教授らのグループでは、RNA-タンパク質 (RNP) 複合体を天然から抽出し、それらをモデュラー・ユニットとして組み合わせることで、RNPナノ構造体の設計と構築を行う新技術を開発しました(Ohno H. et al, Nat. Nanotech. 2011)。天然に存在する「キンクターンRNA」にリボソームタンパク質L7Aeが結合するとRNAモチーフが60°に折り曲げられます。このキンクターンRNA を3つの頂点の位置に来るように挿入したRNAナノ構造体にL7Aeが相互作用すると、RNAが三角形状の構造体へと変換します。このRNPナノ構造体は強固な構造を形成しているため、RNAやタンパク質を精密な距離と配向性をもって配置するための足場として活用できます。
今回の研究では、このRNP相互作用を活用した基盤技術を拡張し、細胞機能を制御する人工RNPナノ構造体を創製するとともに、高速AFMによりその構造体を高解像度かつ直接観察することを試みました。
3.研究結果
1. RNPナノ構造体を活用したRNA動的構造変換過程の直接観察
まず、RNPナノ構造体を構築する基盤技術を応用し、サイズの異なるRNPナノ構造体の直接観察を行いました。高速AFMによる一分子観察を行ったところ、デザイン通りのサイズの異なる5種類のRNPナノ構造体が観察され、RNA構造のサイズをデザインすることができました。次に、RNAナノ構造体がL7Aeタンパク質との相互作用により構造変換する過程の直接観察を行いました。従来の大気中でのAFM観察では、RNP相互作用による構造変換過程を捉えることは難しいため、本研究では、液中でAFM観察を行うことで、RNAナノ構造体がタンパク質との相互作用により正三角形構造体へと段階的に構造変換していく過程を捉えることができました。興味深いことに、フレキシブルな二本鎖RNA上の特定の3箇所に挿入したキンクターンRNAにL7Aeタンパク質が結合すると、ドーナツ状の柔らかなRNA構造体からリジッドな三角形構造体へと構造が変化しました。このように、タンパク質結合によるRNA構造の動的変換過程を直接かつリアルタイムで捉えることに初めて成功しました。

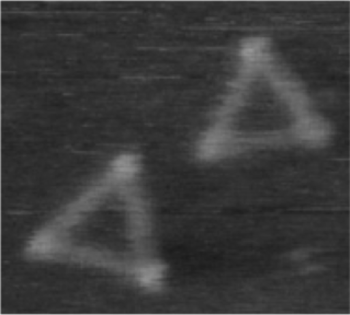
図2 特定の乳がん細胞選択的に結合するRNPナノ構造体の設計と高速AFMによる観察
2. 機能性RNPナノ構造体の創出
次に、RNA構造を足場に、機能性モジュールを付加したRNPナノ構造体を作製する技術を開発することで、この構造体が標的細胞を見分け、その細胞の機能を制御できるか検討しました。はじめに、RNA三角形構造体の3辺にL7AeとAffibody(AFB)注5との融合タンパク質であるL7Ae-AFBを装着した機能性RNPナノ構造体を作製し、高速AFMでその構造体を観測することに成功しました (図2)。AffibodyとはHER2と特異的に結合するペプチドの一種です。実際、HER2発現量の異なる3種類の乳がん細胞へL7Ae-AFBを装着した機能性RNPナノ構造体を投与したところ、この構造体はHER2発現量の最も高いSKBR3細胞へ特異的に結合しました。対照的に、HER2ネガティブ細胞株であるMDA-MB-231細胞には結合しませんでした。この結果から、機能性RNPナノ構造体は細胞表面上で標的レセプターを発現している特定の細胞を選択的に認識・検出できることが確認できました (図3)。さらに、RNPナノ構造体は血清中に含まれるヌクレアーゼによる分解にも耐性を示すことから、in vivoでの標的細胞へのデリバリーも可能であると期待できます。
最後に、RNA三角形構造体の3辺にsiRNA配列を組み込んだ機能性RNPナノ構造体を作製しました。GFP遺伝子をノックダウンするsiRNA配列を組み込んだこの構造体をGFP安定発現株であるHeLa-GFP細胞へ取り込ませたところ、GFP遺伝子のノックダウンが観察されました。
以上の結果から、RNPナノ構造体に標的がん細胞の特異的な認識や標的遺伝子のノックダウンなどの機能を持たせる基盤技術を開発しました。これら技術を活用することで、標的レセプターを発現する細胞を特異的に見分け、その細胞の機能を制御する多機能性RNPナノ構造体の作製が期待されます。
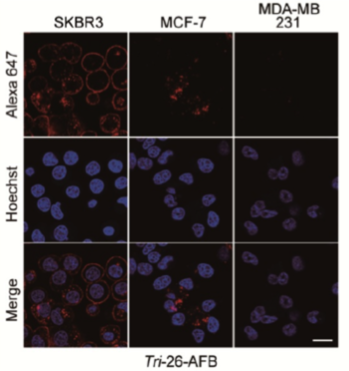
図3 機能性RNPナノ構造体はHER2高発現細胞であるSKBR3を特異的に認識する.
RNAはAlexa647で蛍光標識されている。Hoechstは核を染める色素。・SKBR3 : HER2高発現細胞・MCF-7 : HER2低発現細胞・MDA-MB-231 : HER2ネガティブ細胞
4.まとめ
本研究で開発されたRNPナノ構造体を作製する基盤技術により、RNAナノ構造体に機能性ペプチドやRNAモジュールを組み込むことが可能となりました。複数の機能性モジュールを併せ持つ多機能性RNPナノ構造体の作製ができる技術となります。この技術を活用することで、標的レセプターを発現する細胞を特異的に認識し、その細胞の運命を制御する多機能性RNPナノ構造体の創出などが可能となり、薬物送達システムやナノデバイス、生体イメージング分野などへの応用が期待されます。
5.論文名と著者
・論文名
"Engineering RNA-protein complexes with different shapes for imaging and therapeutic applications"
・ジャーナル名
ACS Nano
・著者
Eriko Osada1, Yuki Suzuki2, 3, Kumi Hidaka5, Hirohisa Ohno4, Hiroshi Sugiyama2, 3, 5, Masayuki Endo3, 5, and Hirohide Saito1, 6*
・著者の所属機関
1. 京都大学CiRA
2. 京都大学大学院理学研究科
3. JST CREST
4. 京都大学大学院生命科学研究科
5. 京都大学iCeMS
6. 京都大学白眉センター
6.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
・NEDO 産業技術研究助成事業 「若手研究グラント」
・文部科学省 科学研究費補助金
「新学術領域(分子ロボティクス)」「若手研究A」「若手研究B」
・科学技術振興機構 再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点
7.用語説明
注1)RNPナノ構造体
RNAとタンパク質(RNA-Protein)から成るナノ構造体のこと。今回の研究では、3つのキンクターンモチーフを含むRNAへ好熱菌由来のリボソームタンパク質L7Aeが結合すると、RNPナノ正三角形構造体が形成される。このナノ構造体は血清中に含まれるヌクレアーゼによるRNAの分解に抵抗性を示す。さらに、このRNAナノ構造体には、目的に応じ、RNA構造やタンパク質に機能性モジュールを組み込むことができるため、機能性モジュールを組み込んだ多機能性RNPナノ構造体を創出する技術は、薬物送達システムやナノデバイス、生体イメージング技術などへの活用が期待される。
注2) 高速原子間力顕微鏡(高速AFM)
分子を数ナノメートルの高解像度で直接観察ができる走査型顕微鏡のこと。高速原子間力顕微鏡では、溶液中で1秒間に10画像以上の像を取得でき、生体分子の動きを活性な状態で直接観察することが可能である。
注3) キンクターンRNA
リボソームを構成するRNAで見つかったRNPの構造形成に重要なRNAモチーフの一つ。例えば、本論文で使っているキンクターンRNAは、タンパク質L7Aeが結合することでRNAの構造変化(キンク)が誘導され、60°に折れ曲がる。
注4) リボソーム
あらゆる生物に存在する、細胞内でのタンパク質生合成の場。主にRNA(リボソームRNA)とタンパク質(リボソームタンパク質)から構成されている。
注5) Affibody (AffibodyZHER2:342)
Protein AのIgG結合ドメインを改変したライブラリーからファージディスプレイ法により選択されたペプチドのこと。このペプチドは細胞表面上で発現しているHER2と特異的に結合する。本研究では、SKBR2(HER2高発現細胞)、MCF7(HER2低発現細胞)、MDA-MB-231(HER2ネガティブ細胞)の3種の乳がん細胞へTri-26-AFBを投与すると、HER2発現量に応じ、RNPナノ構造体が細胞表面へ選択的に結合することが観察された。






















