研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2015年3月13日
KLF4の長さの違いが細胞の初期化の程度を変化させる
キム・シンイル研究員、クヌート・ウォルツエン准教授(CiRA初期化機構研究部門)らの研究グループは、複数の因子を1つの発現ベクターでマウスiPS細胞を作製する際には、KLF4の長さの違いによって、初期化の程度に影響を与えることを明らかにしました。本研究により、初期化方法を直接比較する際には、各因子の相対発現量に留意することの重要性が示され、今後、初期化メカニズムのさらなる解明により高品質なiPS細胞作製の効率化につながると期待できます。
この研究成果は2015年3月12日 (木) 正午(米国東部時間) に米国科学誌「Stem Cell Reports」のオンライン版に掲載されました。
ポイント
・初期化注1因子の1つであるKLF4には、長さの異なる2つのタイプが存在し、研究グループごとに使っているタイプが異なっていた。
・長いタイプのKLF4は、短いタイプのKLF4よりもタンパク質発現が多く、完全に初期化された細胞が高効率に得られた。
・様々な初期化方法によるデータを直接比較する際には、KLF4の長さの違いによる相対発現量を考慮する必要がある。
1. 研究の背景
4つの初期化因子 (OCT3/4、SOX2、KLF4、c-MYC) を過剰発現させることで、体細胞を初期化し、iPS細胞を作製することができます。当初の初期化メカニズムの研究には、1つの因子だけを産生する(モノシストロニック注2)ベクターが用いられましたが、各遺伝子を細胞の染色体中へランダムに挿入するため、そのコピー数を制御できず細胞間で各因子の発現量にはかなりのばらつきがありました。これを解消する方法として、複数の因子を1つのベクターで産生するポリシストロニック注2・カセット注3が開発されました。ポリシストロニック・カセットによって、初期化因子の相対的な割合が初期化の質に影響することは示されていましたが、各因子の最適な量は分かっていません。また、様々なカセットが様々なベクターで使用されており、細胞の初期化効率や初期化の程度が異なることも報告されていましたが、厳密にカセットの違いによる比較した成果はありませんでした。そこで、ウォルツェン准教授らのグループは、ドキシサイクリン(Dox)で誘導できるピギーバック・トランスポゾン注4・システムを用いて、様々なポリシストロニック・カセットを同じシステムで比較しました。
2. 研究成果
1) ポリシストロニック・カセットによる初期化の評価
マウスにおける初期化の研究には、様々なポリシストロニック発現カセットが開発されてきた。これらの因子の順序による影響を調べるため、ドキシサイクリン(Dox)応答型のカセットをもつピギーバック(PB)・トランスポゾンベクターを用いて統一的に検証を行った。初期化は、開始・成熟・安定化の3段階に分けて考えられているが、このシステムでは、初期化の開始・成熟は、AP染色陽性コロニー数で、多能性の安定化は導入遺伝子の活性化で表れるmCherry注5のサイレンシング注6およびNanog遺伝子の活性化によるGFP注5の発現で示される。
まず初めに、10日目のコロニーのAP染色注7により、既に公表されているポリシストロニック・カセットであるOSKM (Carey et al., 2009) と今回作製したOKMSを比較した。すると、遺伝子の導入効率は同じであるにも関わらず、OKMSでは明らかにAP染色されたコロニーが多く見られ、OKMSはOSKMより体細胞の初期化の開始がより多く起こっていることが分かった。さらに、多能性の安定化を調べるため、誘導18日目のマーカーの発現を調べると、OKMSではmCherryの発現が続くのに対して、OSKMではmCherryの発現は抑えられ、Nonog-GFPの発現が確認された。この結果は、OKMSの多くが部分的に初期化された状態であるのに対し、OSKMは初期化が安定化された状態に達することを示した。
2) ポリシストロニック・カセット中のKLF4アイソフォームによる初期化の違い
OSKMとOKMSによって、表現型が異なった原因を見つけるため、各初期化因子のDNA塩基配列を検証した。すると面白いことに、KLF4にはN末端注8長さが9アミノ酸異なる2つのアイソフォーム注9(短いタイプをKLF4S、長いタイプをKLF4Lとする)があり、OKSMにはKLF4S、OSKMにはKLF4Lが使用されていることが判明した。
そこで、KLF4アイソフォームの初期化における影響を調べるため、KLF4S が使われているOKMSのKLF4配列に9アミノ酸加え(OK+9MSとする)初期化を誘導した。すると、OK+9MSによる初期化はOKMSとは表現型が異なり、KLF4Lが使われているOSKMと同様に、mCherryの発現を抑え、Nanog-GFPの活性化が見られた(Fig. 1)。この結果より、KLF4SをKLF4Lに伸長したOK+9MSでは、初期化の開始段階は抑えられるものの、多能性の安定化を促進することが分かった。
また、OMSにKLF4SとKLF4Lをそれぞれ単体で発現するよう(モノシストロニック)に加えてもマーカーの発現に差が見られなかったことから、KLF4SとKLF4Lによる違いはポリシストロニック・カセットでのみ起こる現象であることが分かった。
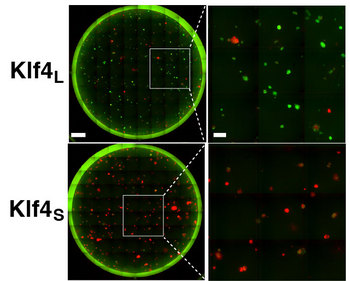
Fig. 1 ポリシストロニック・カセット中のKLF4アイソフォームによる細胞の初期化状態の比較
(上)短いタイプのKLF4(KLF4S)が使用されているOKMSカセットのKLF4のN末端に9アミノ酸を付加し、長いタイプのKLF4(KLF4L)と同じ長さにした。
(下)KLF4Sを含むカセットで誘導すると初期化の開始段階にある細胞が多く見られたのに対し、KLF4Lを含むカセットでは、完全に初期化された細胞が見られた。
赤:mCherry(部分的に初期化された状態) 緑:Nanog-GFP(完全に初期された状態)
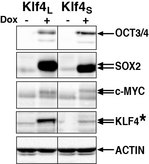
次に、ポリシストロニック・カセット中の導入遺伝子の発現を転写・翻訳レベルで評価した。mRNAの定量ではOSKMとOKMSで同様の発現レベルを示したが、ウエスタンブロッティングでタンパク質発現を解析すると、誘導2日目において、OCT3/4、SOX2、およびc-MYCの発現は同等であったのに対して、驚くことに、KLF4の発現がOKMSと比較してOSKMで高かった(Fig. 2)。この結果は、KLF4タンパク質のN末端アミノ酸配列が、ポリシストロニック・カセットのKLF4タンパク質相対発現量に影響することを示唆している。
また、KLF4Sを含むOKMSに、KLF4SとKLF4Lをそれぞれモノシストロニックで加えると、OSKMやOK+9MSで見られたのと同様に、コロニー数が減少し、また、mCherryの発現が抑えられ、Nanog-GFPが活性化された。OKMSに他の因子(OCT3/4、SOX2、またはc-MYC)を加えても、これらのマーカーの発現はOKMSと変化が無かった。この結果は、初期化の程度を左右する、KLF4タンパク質発現量の閾値があることを示している。
Fig. 2 ポリシストロニック・カセット中のKLF4アイソフォームによる初期化因子のタンパク質発現の比較KLF4Lを含むカセットで誘導するとKLF4の発現が高い。
3) KLF4アイソフォームによるポリシストロニック・カセットの分類
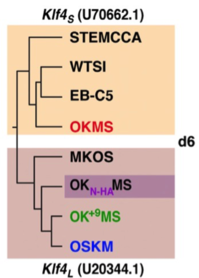
誘導6日目のmCherryを発現している細胞を用いて、初期化開始時の遺伝子発現をマイクロアレイ 注10により網羅的に解析した。OKMSとOSKM(またはOK+9MS)で比較すると、OKMSでは、初期化の途中段階を示すマーカーが多く、OSKM(またはOK+9MS)では上皮に関するマーカーが多く見られた。また、8つのポリシストロニック・カセット(PB-TAC-OSKM, -OKMS, -OK+9MS, -OKN-HAMS, -MKOS, -STEMCCA, -EB-C5, -WTSI) について、同様に誘導6日目の遺伝子発現を調べ、系統樹を作成した(Fig. 3)。上記のポリシストロニック・カセットについてDNA塩基配列を調べると、KLF4SとKLF4Lが様々に使われていたが、作成された系統樹を見ると、KLF4の長短によって、発現パターンの近いものとして分類されていた。面白いことに、N末端にHAタグ注11を付加したOKN-HAMSもKLF4Lと同じクラスターに分類された。このように、ポリシストロニック・カセットの統一的な比較によって、KLF4のアイソフォームがKLF4の相対的な発現に変化をもたらし、初期化過程に影響を及ぼすことが判明した。
Fig. 3 初期化開始段階での発現パターンにより作成したポリシストロニック・カセットの系統樹用いられたKLF4アイソフォームによって明確に分類されている。
4. まとめ
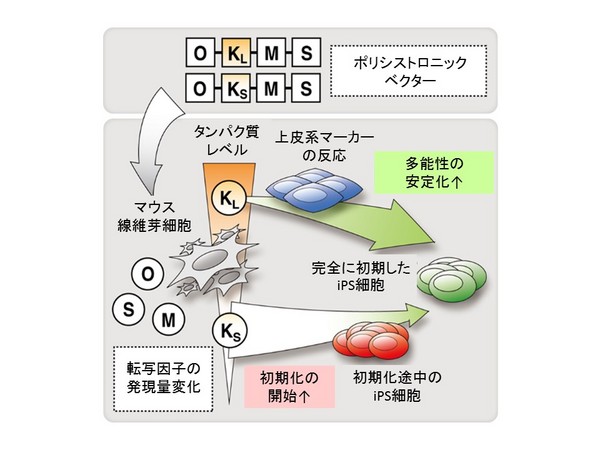
今回の研究では、ポリシストロニック・カセットに使用されているKLF4遺伝子の長さの違いによって、KLF4の相対的な発現量が変化し、初期化過程が変化するということが分かりました。
多能性誘導メカニズムの研究では、初期化が適切に進行しているかを判断する際に遺伝子発現のパターンを指標として、公開されている発現プロファイルを比較分析することが一般的ですが、各因子の相対的な発現レベルが異なると、正しく判定できない可能性を示しています。本研究の成果は、ポリシストロニック・ベクターでのみ起こる現象であり、モノシストロニック・ベクター等によって完全に初期化したiPS細胞株を選択して使用する際にはほぼ影響はありません。しかしながら、初期化メカニズムの研究においては、どのような初期化方法を比較する際にも、各因子の相対発現量に留意することが必要であると考えられます。
Fig. 4 本研究のまとめ (KLF4相対発現量の初期化への影響)マウス体細胞のポリシストロニック・ベクターによる初期化において、KLF4Lを含むカセットを用いると、KLF4の相対発現量が高く、完全な初期化が促進される。
5. 論文名と著者
○ 論文名
"KLF4 N-Terminal Variance Modulates Induced Reprogramming to Pluripotency"
○ ジャーナル名
Stem Cell Reports
○ 著者
Shin-Il Kim1, 2, Fabian Oceguera-Yanez1, Ryoko Hirohata1, Sara Linker1, 3, Keisuke Okita1, Yasuhiro Yamada1, 2, Takuya Yamamoto1, 2, Shinya Yamanaka1, 2, 4, and Knut Woltjen1, 2, 5*
○ 著者の所属機関
1. 京都大学 iPS細胞研究所
2. 京都大学 物質-細胞統合システム拠点
3. マイアミ大学 ヒトゲノム学ハスマン研究所
4. グラッドストーン研究所
5. 京都大学 白眉センター
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
・内閣府 最先端研究開発支援プログラム(FIRST)
・JST 再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点
・JST 国際科学技術共同研究推進事業(戦略的国際共同研究プログラム)
7. 用語説明
注1) 初期化
分化した体細胞の核がリセットされ受精卵のような発生初期の細胞核の状態に戻り、多能性幹細胞などに変化すること。
注2) ポリシストロニック、モノシストロニック
ポリシストロニック:1つのmRNAから複数のタンパク質を産生すること。
モノシストロニック:1つのmRNAから1つのタンパク質を産生すること。
注3) カセット
ベクターに組み込まれる遺伝子の配列。
注4) ピギーバック・トランスポゾン
トランスポゾンとは、転移酵素の働きによってゲノム上の位置をランダムに移動する配列で、動く遺伝子と呼ばれる。ピギーバックは蛾由来のトランスポゾンであるが、蛾の細胞だけなく、マウスやヒトを含むほ乳類の細胞でも高い転移活性をもつ。ピギーバック・ベクターを利用して、特定の遺伝子を目的の細胞に導入することができる。
注5) mCherry、GFP
遺伝子の発現を検出する蛍光タンパク質。mCherryは赤色、GFPは緑色を発する。
注6) 導入遺伝子のサイレンシング
細胞の初期化過程において、導入した遺伝子の発現が消失することが、完全な初期化に必要であることが知られている。そのメカニズムは解明されていない。
注7) AP(Alkaline Phosphatase)染色
APはすべての多能性幹細胞で高発現しており、AP染色により細胞が未分化状態であることを確認できる。
注8) N末端
タンパク質は、アミノ酸のアミノ基(-NH2)カルボキシル基(-COOH)が結合し、鎖状に連なって合成される。
タンパク質全体として、アミノ基側の端をN末端、カルボキシル基側をC末端という。
タンパク質全体として、アミノ基側の端をN末端、カルボキシル基側をC末端という。
注9) アイソフォーム
構造は異なるが同じ機能をもつタンパク質。
注10) マイクロアレイ
一度に膨大な数のDNAやRNA、タンパク質を網羅的に検査することができる解析技術。
注11) HAタグ
特定のタンパク質の目印とするために用いられるペプチド(タグ)のうち、インフルエンザウイルスのペプチド配列を利用したもの。タグを付加しても、タンパク質の性質は影響されない。



















-thumb-350x95-1739.jpg)