研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2017年8月9日
ヒトiPS細胞から膵臓細胞への分化を制御するメカニズムの一端を解明
ポイント
- 細胞骨格注1)の維持に関わるROCK注2)や非筋ミオシン注3)IIに対する阻害剤はヒトiPS細胞から膵芽注4)細胞への分化を促進した。
- 膵芽細胞への分化に有効な培養条件では、ROCKやその下流にある非筋ミオシンIIのシグナルが低下していた。
- 細胞骨格の変化という物理的な要因が膵臓細胞の分化を制御することを明らかにした。
- 細胞骨格を調節する薬剤を用いることによってiPS細胞から再生医療に使用する膵臓細胞を効率よく作製することができる。
豊田太郎講師(京都大学CiRA)、長船健二教授(京都大学CiRA)らの研究グループは、ヒト多能性幹細胞(ES細胞およびiPS細胞)から膵臓細胞への分化過程を解析し、膵臓の元となる胎生期の膵芽(すいが)細胞への分化を制御するメカニズムに細胞骨格に関連する分子が関与することを明らかにしました。
培養皿上でヒトiPS細胞から膵芽細胞への分化には細胞密度が高い状態での培養や、細胞の塊を作ることが有効であることが分かっていますが、そのメカニズムについては不明でした。そこで、豊田講師らは細胞構造の変化に着目し、細胞骨格の調節に関わる試薬の中から、ROCK阻害剤や非筋ミオシンII阻害剤が膵芽細胞への分化を促進することを見出しました。ROCK阻害剤や非筋ミオシンII阻害剤の処理で作られた膵芽細胞は、マウスの生体内へ移植すると胎生期の膵臓様組織を形成し、数カ月後には血中グルコース濃度に応答してインスリンを分泌することから、生体内の膵芽細胞と同様の性質があると考えられました。また、細胞密度が高い状態や細胞塊では、ROCK活性やその下流にある非筋ミオシンIIの量が低下していることを見出しました。これらの結果から、ROCK-非筋ミオシンIIというシグナル伝達の活性化は培養皿上での実験において膵臓への分化を阻害すると考えられます。本研究は、糖尿病などの膵臓疾患に対するiPS細胞を用いた再生医療開発研究の基盤として貢献すると期待されます。
この研究成果は2017年8月8日正午(米国東部時間:日本時間 8月9日午前1時)に国際幹細胞学会(ISSCR)が発行する科学誌「Stem Cell Reports」にオンライン公開されました。
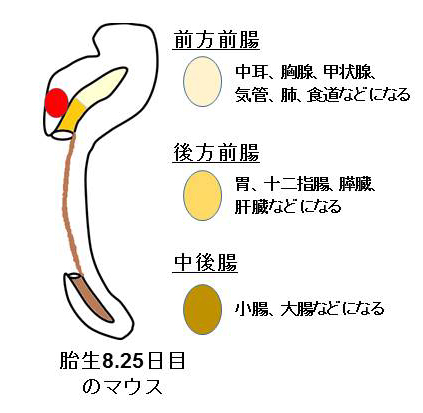
膵臓は、胎生期の後方前腸注5)に存在する膵前駆細胞と呼ばれる一層の細胞シートから膵芽と呼ばれる細胞の塊をつくることで初めて形として認識することができます。つまり、膵芽は膵臓の最初の組織であると考えられます。このため、膵芽細胞は糖尿病に対する細胞移植療法をはじめとした膵臓再生医療の基盤となる細胞源として期待されています。これまでにヒト多能性幹細胞から、発生過程を模倣した分化誘導法によって膵臓細胞を作製できることが複数の研究グループから報告されていますが、途中の段階である膵芽細胞への分化の仕組みは完全には分かっておらず、安定性、効率などの点について改良の余地がありました。膵芽細胞への分化には細胞密度が高い状態での培養や、細胞の塊を作ることが有効であることが分かっていたため、豊田講師らは細胞構造の変化に着目した解析を行いました。
1) ROCK阻害剤や非筋ミオシンII阻害剤は膵芽細胞への分化を促進した。
細胞骨格の維持に関わるタンパク質の働きを阻害する低分子化合物を複数種類ヒトiPS細胞由来の膵前駆細胞に作用させたところ、ミオシン阻害剤の1種類(Blebbistatin:非筋ミオシンIIの阻害剤)や、ROCKに対するすべての阻害剤(Y-27632、Fasudil、GSK269962、H-1152)で処理した場合に膵芽細胞(NKX6.1陽性細胞)への分化を観察することができました(図1)。また、ROCK阻害剤や非筋ミオシンII阻害剤(ROCK-NM II阻害剤)の効果は、他のiPS細胞株やヒトES細胞でも認められました。
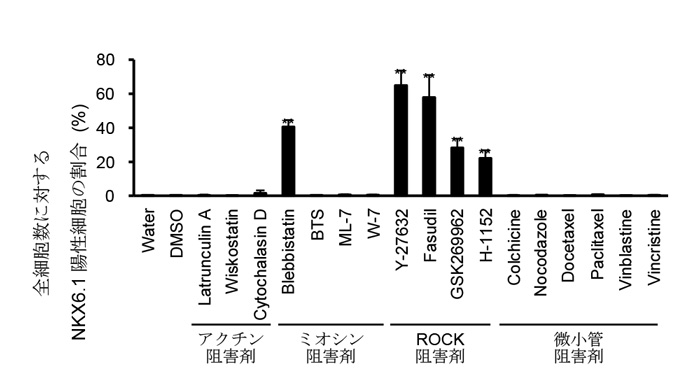
図1 ミオシン阻害剤やROCK阻害剤は膵芽細胞(NKX6.1陽性細胞)への分化を促進する
膵前駆細胞から膵芽細胞への分化誘導を様々な細胞骨格を調節する試薬で刺激した。
2) ROCK-NM II阻害剤で処理して作った細胞は膵β細胞へ分化する能力があった。
ROCK-NM II阻害剤処理で作られた細胞をマウスに移植すると、胎生期の膵臓に似た組織構造が形成され(図2)、最終的には血糖値に応じてインスリンを分泌する成熟した膵β細胞へと分化しました。このため、ROCK-NM II阻害剤で分化誘導された膵芽細胞には成体の膵臓細胞へと分化する能力があると考えられました。
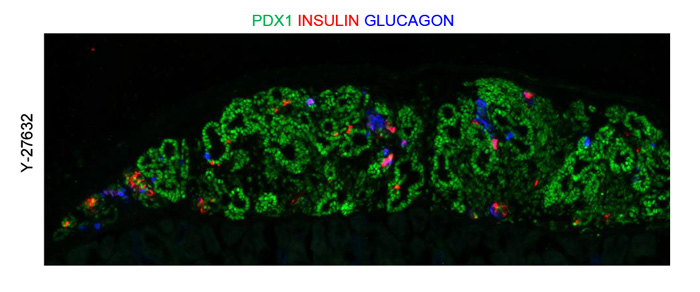
図2 ヒトiPS細胞由来の胎生期の膵組織
ROCK阻害剤を用いて作製した膵芽細胞を移植して30日後の移植片を免疫染色した。
赤色:インスリン産生細胞、青色:グルカゴン産生細胞、緑色:膵前駆細胞。
Scale bar, 100 μm
3) 膵芽細胞への分化に有利な培養条件では、ROCK活性やその下流にある非筋ミオシンIIの量が低下していた。
次に、細胞密度が高い状態での培養や細胞の塊を作った際の、ROCK活性やその下流にある非筋ミオシンIIの量を調べたところ、いずれも低下していることが分かりました(図3)。つまり、ROCK-NM II阻害剤は、膵芽細胞への分化に有利な培養条件と同じ細胞内状態を作り出していると考えられました。
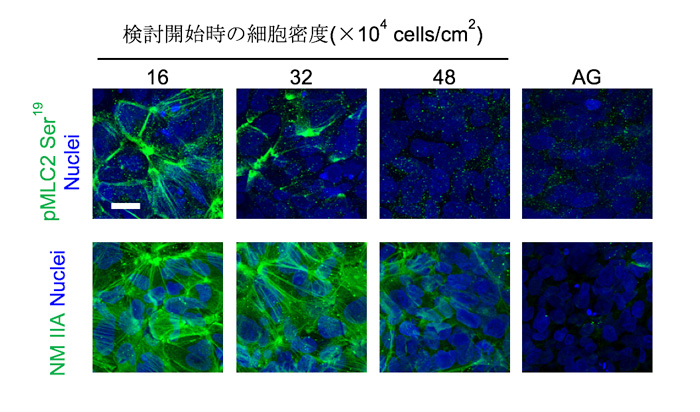
図3 細胞密度が高い状態での培養や細胞の塊では、ROCK活性やその下流にある非筋ミオシンIIの発現量が低下する
後方前腸細胞から膵芽細胞への分化誘導を様々な細胞密度で実施した。
AG: 細胞塊の浮遊培養
pMLC2 Ser19:ミオシン軽鎖2のリン酸化状態で、リン酸化されているとROCK活性が高いことを示す。
NM IIA: 非筋ミオシンII A
Scale bar, 20 μm
本研究では、ヒトES細胞やiPS細胞から膵臓の元となる膵芽への分化を促進する低分子化合物を同定しました。また、同定した化合物が阻害するROCKや非筋ミオシンIIの活性が低下する状態を作り出すと膵芽への分化が進行するという、分化の制御機構が分かりました(図4)。本研究は、糖尿病などの膵臓疾患に対するiPS細胞を用いた再生医療開発研究の基盤として貢献すると期待されます。
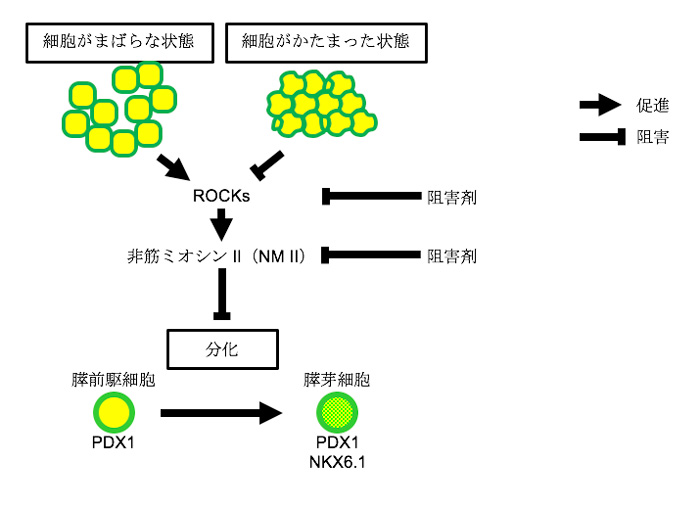
図4 細胞骨格を調節するROCK-非筋ミオシンIIシグナルと膵芽細胞への分化の関係
- 論文名
"Rho-associated kinases and non-muscle myosin IIs inhibit the differentiation of human iPSCs to pancreatic endoderm" - ジャーナル名
Stem Cell Reports - 著者
Taro Toyoda1, Azuma Kimura1, Hiromi Tanaka1, Tomonaga Ameku1, Atsushi Mima1, Yurie Hirose1, Masahiro Nakamura2, Akira Watanabe2, and Kenji Osafune1 - 著者の所属機関
- 京都大学 iPS細胞研究所 (CiRA) 増殖分化機構研究部門
- 京都大学 iPS細胞研究所 (CiRA) 未来生命科学開拓部門
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム「iPS細胞研究中核拠点」
- 日本学術振興会 (JSPS) 最先端研究開発支援プログラム(FIRST)
- 日本学術振興会 (JSPS)・文部科学省 科学研究費補助金 基盤研究 (C)
- 武田科学振興財団
- 鈴木謙三記念医科学応用研究財団
- ライフサイエンス振興財団
- 三井生命厚生財団
注1)細胞骨格
細胞質内に存在する繊維状の構造物。細胞の形態や運動、細胞質内の物質輸送などに関わる。主なものとしてアクチンフィラメント、中間径フィラメント、微小管がある。
注2)ROCK(Rho-associated kinase)
細胞の形などの制御を行う酵素。細胞骨格を構成するアクチンやミオシンの活性を制御する役割が知られている。
注3)非筋ミオシン
筋肉細胞以外でみられるミオシン。細胞骨格を構成するタンパク質の一つ。
注4)膵芽
胚発生過程における消化管の元となる管の中央付近(後方前腸)から隆起してくる組織。膵芽を構成する細胞は転写因子NKX6.1を発現しているため、これを目印とすることができる。膵芽細胞は膵臓へのみ分化する細胞と考えられている。
注5)後方前腸
発生期の内胚葉由来の組織の1つ。将来、胃、十二指腸、膵臓、肝臓などになる。
(マウス発生期の腸管の図参照)