研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2019年12月17日
タンパク質を検出する合成mRNAスイッチの拡張:より複雑な細胞操作に向けて
ポイント
- 合成mRNA注1)スイッチを改良・新規開発し、細胞内のタンパク質を高感度で検出することに成功しました。
- 5種類のmRNAスイッチを準備し、適切なタンパク質とスイッチの組合せでのみ、遺伝子発現が抑制される (直交性が高い) ことを見出しました。
小野紘貴大学院生 (京都大学CiRA未来生命科学開拓部門/京都大学大学院医学研究科)、川﨑俊輔特定研究員 (京都大学CiRA同部門)、齊藤博英教授(京都大学CiRA同部門)の研究グループは、標的タンパク質を検知して、mRNAからの翻訳をコントロールできる「タンパク質応答型mRNAスイッチ」の感度改善と新規開発に成功しました。また、本研究で新たに作成したスイッチと既存のスイッチ合計5種類が、互いに干渉しあわない (直交性が高い) ことを見出しました。このような特徴は、スイッチを組合せて人工的な遺伝子回路注2)を開発する際に極めて重要です。これまで人工RNA回路の構築に汎用的に用いられるスイッチの数が、たった2つであったことを考えると、今回5種類にまでスイッチが拡張できたことは、より複雑な細胞操作の実現に一層近づいたと言えるでしょう。
この研究成果は2019年12月13日に「ACS Synthetic Biology」で公開されました。
合成生物学注3)分野では、創薬やワクチン開発、細胞移植などといった医療において、細胞の挙動を「プログラム」することで、治療効果の向上や副作用の低減を目指す研究がなされています。このようにしてプログラムされた細胞は、環境中のシグナルを検知し、それに応じて適切な治療分子の選択や、それを発揮するタイミング、持続時間、強度などを自律的に判断し出力することが期待されています。しかし、このような精密な制御機構を実現するためには、コンピュータのように情報処理を行う複雑な論理演算回路を構築する必要があります。これまで、こうした人工回路は DNA を合成して作製されていましたが、細胞内に導入すると、ランダムに細胞内のゲノムDNAを傷つけてしまうリスクがあり、医療応用が難しいという課題がありました。そのため、研究グループは、安全性の高い人工RNAを利用した人工回路の作成に取り組んできました。同グループは2種類のタンパク質応答型mRNAスイッチを使って、標的となる細胞の状態を識別し、その運命を制御できる回路を構築してきました (参考:CiRA HP 研究成果 2015年8月4日「細胞の機能を精密に制御する人工回路をRNAで構築:ヒトの細胞で成功」、2018年11月20日「人工RNA論理回路で細胞の運命を制御する」)。しかしながら、より複雑な挙動を細胞にプログラムするためには、より多くの合成mRNAスイッチが必要です。それにも関わらず、人工回路に利用可能な実用的な合成mRNAスイッチは、これまで2種類しか報告されていませんでした。そこで、本研究ではタンパク質を検出できる合成mRNAスイッチの改良方法を確立し、その数の拡張を試みました。
1) 合成mRNAスイッチを改良し、タンパク質を高感度で検出する新しいスイッチを開発しました。
まず、既報のmRNAスイッチに対して、RNA結合タンパク質 (RBP) およびそれらが結合するRNA配列やRNA構造のエンジニアリングを行いました。その結果、強力な翻訳抑制を実現し得る改良手法を見出し、既存のスイッチの翻訳抑制能を大きく改善することに成功しました。
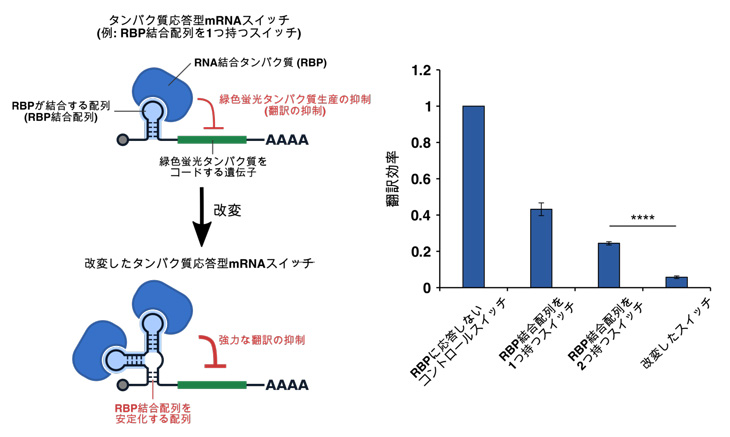
図1 改変の概要(左)と翻訳効率(右)
タンパク質あるいはスイッチ中のRNA配列を改変することで、高感度なタンパク質応答型mRNAスイッチの開発に成功しました。mRNAスイッチを発現するプラスミドを作製し、RBPを発現するプラスミドと共に細胞内へ導入させました (リファレンスとして蛍光タンパク質(iRFP670)を産生するプラスミドも導入)。24時間後、本研究で開発したmRNAスイッチは、タンパク質が発現している状態では翻訳が抑制されることが分かりました。さらに、改良した合成mRNAスイッチがより高感度で機能していることが分かりました。
2) 5種類のスイッチ間で高い直交性が確認されました。
次に、新しい合成mRNAスイッチと既報のものを5種類で、適切なタンパク質とスイッチの組合せでのみ、遺伝子発現が抑制される (直交性が高い) かどうかを検証しました。この結果、これらのスイッチの特異性は高く、スイッチ間の干渉が少ないため大規模な遺伝子回路の構築に適していることが明らかになりました。
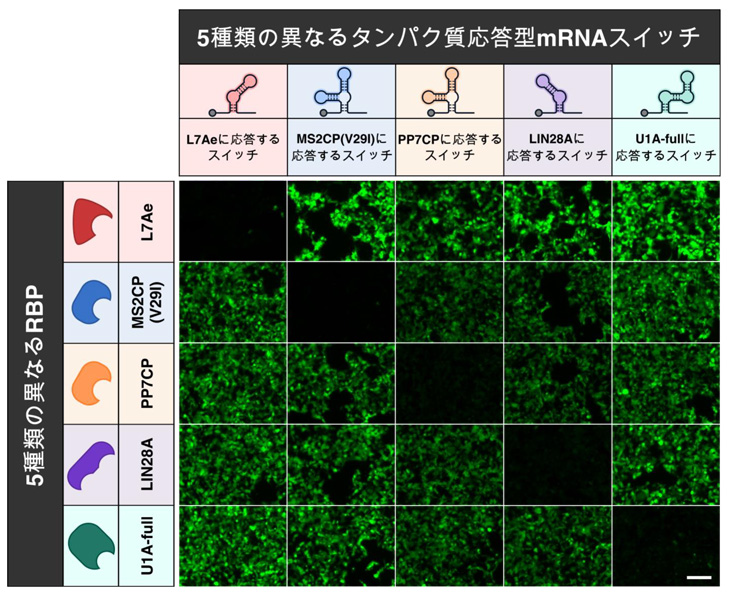
図2 5種類のタンパク質応答型mRNAスイッチの直交性
各mRNAスイッチが、想定されているタンパク質以外に反応しないかどうか検証しました。5種類のmRNAスイッチとタンパク質について、すべての組合せを検討し、意図した条件でのみ翻訳が抑制されていることを確認しました。ここでは、緑色蛍光タンパク質の発現が適切な組合せのときのみ抑制されます。スケールバーは200μmを示す。
本研究では、タンパク質応答型mRNAスイッチを改良および新規開発し、高感度で働くスイッチの実現に成功しました。 さらに、5種類のmRNAスイッチを試験し、直交性が高いことを見出しました。また、今回新たに作成したスイッチの一部は、人工RNAの形態で細胞に導入し、機能することが確認できました。今後、これらのスイッチを組合せることで、任意の遺伝子発現パターンを再構成できる人工回路の構築が期待できます。特に、タンパク質応答型mRNAスイッチを使って、遺伝子発現の振動パターンを首尾よく再現するためには、最低5つのスイッチが必要だと言われています。今回の成果は、これまで実現困難だった人工回路の構築を可能にします。将来的には、こうした回路を応用することで、再生医療や創薬といった幅広い医療分野に大きく貢献できると期待されます。
- 論文名
Orthogonal protein-responsive mRNA switches for mammalian synthetic biology - ジャーナル名
ACS Synthetic Biology - 著者
Hiroki Ono1,2,*, Shunsuke Kawasaki1,* and Hirohide Saito1
*:共同第一著者 - 著者の所属機関
- 京都大学iPS細胞研究所 未来生命科学開拓部門
- 京都大学大学院 医学研究科
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会・文部科学省 科学研究費補助金「基盤研究S」
- 日本学術振興会・文部科学省 科学研究費補助金「若手研究」
- 日本学術振興会・文部科学省 特別研究員制度
注1)mRNA
メッセンジャー (伝令) RNAのこと。DNA上の遺伝情報はmRNAに転写された後、mRNAからタンパク質となり (翻訳され)、細胞内で機能する。mRNAとタンパク質の相互作用を利用して、細胞内の目的のタンパク質が発現しているときのみ反応する合成mRNAを使って、mRNAの翻訳をコントロールする概念を「タンパク質応答型mRNAスイッチ」と呼ぶ。
注2)遺伝子回路
複数の遺伝子スイッチを組合せることで、遺伝子の機能が発揮されるタイミング、強さに加えて、どの遺伝子を働かせるかも正確にコントロールできる。このような仕組みをコンピュータの回路に見立てて遺伝子回路と呼ぶ。人工遺伝子回路を搭載した細胞は、人が望んだような機能を発揮し、人が命令した通りの振る舞いをする。
注3)合成生物学
生物が自然に持っている仕組みを人の手で再設計することで、生命の機能を拡張・制御したり、その仕組について理解を深めたりすることを目指している学問分野。