
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2015年8月4日
細胞の機能を精密に制御する人工回路をRNAで構築: ヒトの細胞で成功
遠藤慧研究員(元京都大学CiRA研究員、現東京大学大学院新領域創成科学研究科助教)、齊藤博英教授(京都大学CiRA)らの研究グループはロン・ワイス教授ら(マサチューセッツ工科大学)との共同研究で、RNAを細胞に導入することで機能するさまざまな人工回路を開発しました。
この研究成果は2015年8月3日16時(グリニッジ標準時間:ロンドン)に「Nature Biotechnology」で公開されました。
ポイント
- ゲノムDNAを傷つける恐れのないRNAをヒト細胞に導入することで、細胞の機能をさまざまに制御できる「人工回路」を構築することに成功した。
- 安全性が高く、すみやかに分解される人工RNAを用いた回路や、自己複製できるRNAによる長時間機能する回路を構築した。
- 2種類の人工RNAを培養中の細胞に加えることで、正常細胞には影響せず、がん細胞のみに細胞死を起こすことに成功した。
1. 要旨
これまで、「DNA」と「DNAに結合するタンパク質(転写因子)」を用いた人工回路は作製されてきましたが、細胞にDNAを導入することでゲノムDNAを傷つける可能性があり、医療応用が難しいという課題がありました。そこで研究グループは、安全性の高い人工RNAをヒト細胞に導入し、「RNA」と「RNA結合タンパク質」を利用した、転写後の調節を基本とした人工回路の作製に取り組みました (図1)。その結果、標的となる細胞(がん細胞など)の状態を識別し、その状態に応じて細胞運命を制御できる回路(a)、情報の増幅やタイミングの調節が可能となる多段階のシグナル伝達回路(b)、タンパク質の発現をスイッチできる回路(c)などの開発に成功しました。たとえばこの人工RNAからなる回路(a)をシャーレ上で培養中の細胞内に導入することで、がん細胞のみ細胞死に導くことに成功しました。これらの人工回路を組み合わせることで、がん化した細胞や未分化細胞などを細胞内の状態に応じて除去しつつ、安全かつ精密にヒト細胞の運命を操作できることが期待されます。
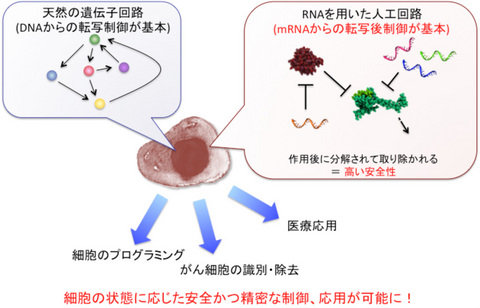
図1 RNAを用いた人工回路のヒト細胞内での構築
RNAをヒト細胞に直接導入することで、細胞内で人工回路が形成される。この回路はDNAからの転写制御を基盤とする天然の回路(左)とは異なり、RNAとRNA結合タンパク質の相互作用による転写後制御を基盤とする(右)。RNAは遺伝子を傷つける可能性が低く安全性が高い上に、精密に細胞内の状態を検知し、その運命をコントロールできる。応用例としては、細胞内状態に応じたがん細胞の識別・除去、個々の細胞に応じたプログラミング、分化制御などが想定される。
2. 研究の背景
DNA上の遺伝子情報はRNAへ伝わり(転写)、最終的にはタンパク質となって(翻訳)細胞内で機能します。さまざまなタンパク質に対して、適切なタイミングや量を調節するような回路が細胞には元来備わっています。このような回路を制御するために薬や低分子化合物が一般的に用いられてきましたが、予想外の副作用をもたらす場合もあり、常に安全性に対するリスクと向き合う必要がありました。これらの懸念を払拭するための一つの方法として、細胞の状態に応じてタンパク質の発現をコントロールできる人工回路の構築が期待されています。しかしながら、現在数多く用いられている回路は、主にDNAを細胞に導入する必要があり、導入されたDNAがゲノムを傷つける可能性を無視できず、医療応用に適しているとは言い難い状況です。
本研究グループは、従来の方法とは異なる、安全性の高いRNAやRNAと結合するタンパク質を利用した人工回路をヒト細胞内で作ることを目指して共同研究を始めました。人工RNAはゲノムを傷つけるリスクが低く、安全性の高い遺伝子操作技術として期待されていますが、RNAのみを用いた人工回路の作製はこれまで実現できていませんでした。DNAを利用した人工回路を構成する要素としては、これまでの研究の蓄積により、転写の抑制や活性化に関わる分子が数多く知られていますが、RNAを利用した人工回路を構築するためには、翻訳やRNAの安定性など、転写後の制御によりタンパク質の発現量をコントロールできるようなRNA結合タンパク質を用意する必要があります。そこで、齊藤教授のグループが既に開発していた翻訳を制御できるRNA結合タンパク質L7Ae注1)と、今回新たに利用した、mRNA注2)の分解を制御できるRNA結合タンパク質MS2-CNOT7注3)を組み合わせて、さまざまな人工回路(図2)をつくることにしました。
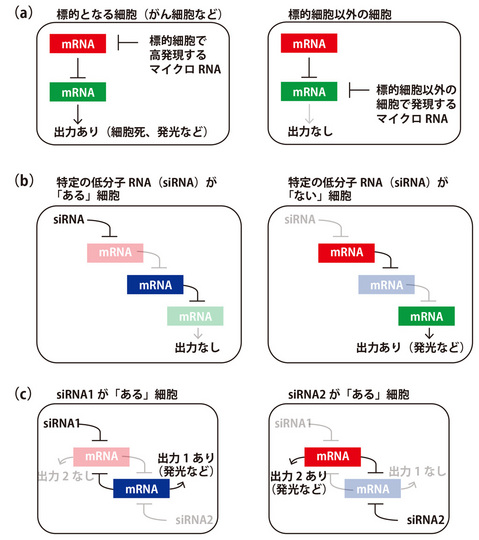
図2 RNAを用いた人工回路の模式図
(a) 複数の人工RNAを用いて細胞内の状態を検知し、細胞運命をコントロールする回路
(b) 多段階接続の回路(シグナルを増幅したり、タイミングを調節することを想定)
(c) 2段階状態スイッチ回路(細胞内の状態に応じて、2種タンパク質の発現をスイッチ)
□赤、緑、青で描かれているのが、外部から導入した人工RNA
3. 研究結果
1) 細胞内の状態を検知し、細胞運命をコントロールする回路
まず、細胞内の複数のマイクロRNA(miRNA)注4)を検知し、かつ標的がん細胞にのみ細胞死(アポトーシス)を誘導できるRNAからなる人工回路を作製しました(図2a、図3)。この人工回路は、miRNAに応答する2種類の人工mRNA (L7Aeを発現するmRNA(1)とL7Aeにより翻訳が抑制されるmRNA(2)) を細胞に導入するだけの単純な仕組みで構築できます。L7Aeは細胞内でmRNA(1)から翻訳されるとキンクターン注5)というRNA配列に結合する性質があり、出力タンパク質をコードするmRNA(2)の先頭側にキンクターン配列を挿入することでmRNA(2)からタンパク質が合成される(出力)ことを抑制するしくみを利用しました。具体的には、ヒト子宮頸がん由来HeLa細胞注6)中で特徴的なmiRNAプロファイル[miR21の発現量が多い、miR141とmiR142(3p)とmiR146aの発現量が少ない]を認識し、HEK293(ヒト胎児腎)細胞[miR21の発現量が少ない、miR141とmiR142(3p)とmiR146aの発現量が多い]と識別する回路を作製することに成功しました。さらに、出力として細胞死を誘導するタンパク質(hBax)を用いることで、シャーレ上で培養中のHeLa細胞とHEK293細胞の中から、HeLa細胞のみに細胞死を誘導することに成功しました。このように、目的のがん細胞で発現するmiRNAプロファイルに基づいた人工回路を作製することで、正常細胞には影響を与えることなく、目的のがん細胞を検知しかつ選択的に除去できる技術の開発が期待されます。
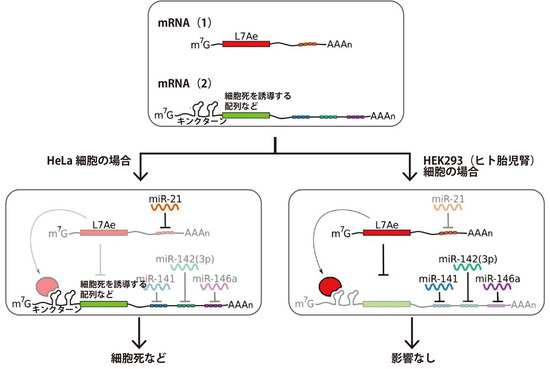
図3 HeLa細胞の細胞状態を検知して細胞死に導くしくみ
HeLa細胞(左)では、miR-21により、L7Aeの発現が抑制され、細胞死を誘導するタンパク質が発現し、細胞死を起こします。一方、HKE293(ヒト胎児腎)細胞では(右)、L7Aeが発現し、細胞死に導くタンパク質が抑制され、細胞状態に影響をあたえません。
2) 多段接続(カスケード)回路
次に、3つの抑制段階をもつ多段階のシグナル伝達回路を作製しました(図2b、図4)。入力分子としては低分子二本鎖RNA(siRNA)を用いました。L7Ae配列のmRNAの後ろ側にこのsiRNAが結合できる配列を挿入し、このsiRNA存在下では、L7Aeの合成が抑制されるしくみを利用しました。さらに、L7Aeが抑制されることで、2番目のRNA結合タンパク質であるMS2-CNOT7が発現し、最終的な出力となるEGFP(緑色蛍光タンパク質)のmRNAが分解される、つまり細胞が光らなくなる回路の作製に成功しました。すなわち、人工mRNAとL7AeやMS2-CNOT7などのRNA結合タンパク質の相互作用を他段階につなぎ合わせることで、細胞の状態に応じて出力タンパク質の発現量やタイミングを制御できます。
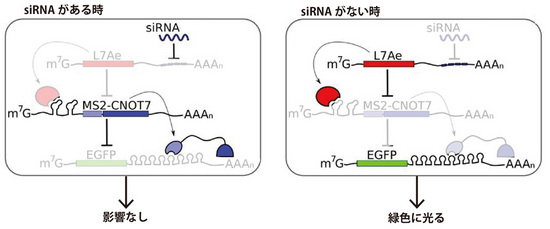
図4 多段階接続回路のしくみ
HeLa細胞(左)では、miR-21により、L7Aeの発現が抑制され、細胞死を誘導するタンパク質が発現し、細胞死を起こします。一方、HKE293(ヒト胎児腎)細胞では(右)、L7Aeが発現し、細胞死に導くタンパク質が抑制され、細胞状態に影響をあたえません。
3)スイッチ回路
最後に、細胞の状態に応じて2種類のタンパク質の発現を切り替えるスイッチ回路を構築しました(図2c、図5)。回路構築のため、ふたつのmRNAから発現するタンパク質(L7AeとMS2-CNOT7)がお互いのmRNAに結合し、抑制しあう回路を作製しました。具体的には、L7AeとEYFP(黄色蛍光タンパク質)、MS2-CNOT7とEBFP(青色蛍光タンパク質)がそれぞれ一緒に翻訳されるような2つのmRNAを作製し、それぞれのmRNAに対応する二つのsiRNAが結合する部位を挿入することで、お互いのタンパク質合成を抑制することで、どちらか1種類のタンパク質合成が維持されるスイッチ回路を作製しました。また、スイッチ回路が長期間働くことが必要な場合を念頭におき、自己増殖が可能なRNAレプリコン注7)を利用した回路の構築にも成功しました。
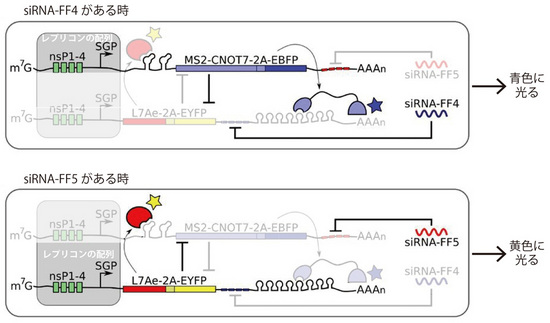
図5 2段階スイッチのしくみ
siRNA-FF4があるときには、MS2-CNOT7と融合したEBFPが発現し、L7Aeと融合したEYFPの発現が抑制されることにより、青色の蛍光を確認できる。siRNA-FF5があるときMS2-CNOT7と融合したEBFPの発現が抑制されて、L7Aeと融合したEYFPが発現することにより、黄色の蛍光を確認できる。L7AeとMS-CNOT7がお互いを抑制しあうことにより、どちらか一方の発現が維持される状態が続く。
4. まとめ
今回の研究では、人工RNAを細胞に導入することでさまざまな機能を発揮する人工回路を、ヒト細胞内で構築することに成功しました。人工mRNAは一時的な応答に、RNAレプリコンを利用した場合はより長く回路を働かせることができました。したがって、一時的に回路を細胞に作用させたい場合は、人工mRNA、長期間作用させたい場合はレプリコンといったように、目的に応じて利用する人工RNAを選択することができます。また、安全性が重要となる医療応用を考えた場合に、人工RNAを用いた回路は決められた期間のみ機能させることができ、ゲノムDNAを傷つけるリスクが低いという利点があります。さらに、人工mRNAやレプリコンの発現量や機能させる時間を変化させることで、より多層的な回路デザインが可能となります。特に、人工mRNAにより特定の細胞を識別して細胞死を起こす回路は、設計が簡単な上に、RNAが一時的に細胞内にとどまった後に分解され、ゲノムDNAを傷つけることないという安全性の面からも、将来の医療応用が期待されます。
5. 論文名と著者
Mammalian synthetic circuits with RNA binding proteins for RNA-only delivery
Liliana Wroblewska1,4, Tasuku Kitada1*, Kei Endo2,4*, Velia Siciliano1, Breanna Stillo1, Hirohide Saito2,3**, Ron Weiss1**
* これらの著者は同等にこの論文に貢献しました。** 責任著者
1. マサチューセッツ工科大学合成生物学センター
2. 京都大学iPS細胞研究所
3. 京都大学白眉センター
4. 現所属:ファイザー(L.W.)、東京大学大学院新領域創成科学研究科(K.E.)
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
7. 用語説明
注1) L7Ae
古細菌リボソーム大サブユニットに存在するたんぱく質の一つであり、リボソーム構築に必須の因子であるとともに、RNA塩基の修飾や、mRNAへの結合など、複数の機能を担う。本研究で用いたキンクターン配列をもつmRNAと相互作用し、mRNAからの翻訳を抑制することができる。
注2) mRNA
メッセンジャー(伝令)RNAのこと。DNA上の遺伝子情報はmRNAに転写された後、mRNAからタンパク質となり(翻訳され)、細胞内で機能する。
注3) MS2-CNOT7
バクテリオファージMS2由来のコートたんぱく質とmRNA分解を促進するCNOT7を融合したたんぱく質。本研究では、MS2に結合するRNA配列を挿入したmRNAと相互作用し、その分解を促進することができる。
注4) マイクロRNA(miRNA)
20〜30塩基程度の長さの短いノンコーディング(タンパク質をコードしていない)RNA。相補的な配列を持つmRNA(メッセンジャーRNA)と結合して翻訳を抑制したり、mRNAを分解したりすることで、そのmRNAからのタンパク質の合成を抑制する働きをもつと考えられている。
注5) キンクターン
RNAーたんぱく質の相互作用に重要な役割を果たすRNA配列の1つ。L7Ae(注1)と強固に結合することができる。
注6) HeLa細胞
ヒト由来の最初の細胞株。ヒト子宮頸がんから分離され、株化された。
注7) RNAレプリコン
自律的な複製を行うRNA単位のこと。本研究では、シンドビスウイルスのRNA配列からmRNAを作り出すRNAポリメラーゼ配列を用いている。細胞内で自己複製することでmRNAを作り出し続けることができ、最終的には出力となるタンパク質が長期間安定に生じる。






















