
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2020年8月4日
ヒトiPS細胞由来間葉系幹細胞で作製した神経導管による末梢神経の再生に成功
ポイント
- ヒトiPS細胞から動物由来成分注1)を含まない培養条件下で誘導した間葉系幹細胞(Mesenchymal stem cell, MSC)注2)を細胞材料として、バイオ3Dプリンター注3)を使って神経導管注4)を作製した。
- 作製した神経導管に末梢神経を再生する能力があることを、ラットの坐骨神経切断モデルで示した。
- この末梢神経の再生メカニズムの一端として、神経成長因子および血管新生因子の関与が示唆された。
末梢神経切断の際の治療法として広く受け入れられているのが、自家神経移植です。しかし、人体にかかる負担が大きく、また採集部位の機能が喪失するなどの課題が存在します。本研究は、ヒト人工多能性幹細胞(iPS細胞)由来間葉系幹細胞(iMSC)で作製されたバイオ3D神経導管の、末梢神経再生に対する有効性とメカニズムの検証を目的として実施されました。
免疫不全ラットの坐骨神経を5mm切断し、バイオ3D神経導管移植の対照群として使用したシリコンチューブ移植でも切断神経は手術後8週間で再生しましたが、形態、運動性、電気生理学、および筋重量に基づいた評価により、バイオ3D神経導管移植群の再生神経の方が有意に優れていることが分かりました。また、移植されたバイオ3D神経導管の内側と表面の両方に血管新生が観察され、iMSCの皮下移植では血管新生を促進する機能が認められました。
以上の結果から、iMSCで作製されたバイオ3D神経導管は末梢神経再生に有効であり、将来的に臨床応用に役立つ可能性が示されました。
この研究成果は、趙 成珠特定研究員(CiRA臨床応用研究部門)と池谷 真准教授(CiRA同部門)の研究グループと、光澤 定己大学院生と池口 良輔准教授と松田 秀一教授(京都大学大学院医学研究科整形外科)の研究グループ、青山 朋樹教授(京都大学大学院医学研究科人間健康科学)、中山 功一教授(佐賀大学医学部再生医学研究センター)、秋枝 静香代表取締役(サイフューズ)との共同研究により実施され、2020年7月21日午後6時(日本時間)に英国科学誌「Scientific Reports」でオンライン公開されました。
外傷や腫瘍切除には、しばしば末梢神経の損傷が伴います。縫合可能な場合には、切断端の縫合により修復しますが、不可能な場合、最も標準的な治療法は自家神経移植です。移植された神経は軸索伸長に最適な足場となり、神経の修復を助けます。しかし一方で、自家移植には採取部位の感染、供給量の制限、神経腫形成、口径の不一致、追加の外科的切開の必要性、手術時間の増加など、いくつかの潜在的な欠点があります。他家由来神経移植はこれらの欠点のいくつかを解決しますが、周術期注5)の免疫抑制や採取神経の適切な保存などが必要となります。人工神経導管は3番目の選択肢であり、すでに臨床の場で実際に使用されています。支持細胞、スキャフォールド注6)、成長因子、血管形成能などが改善された人工神経導管が報告されていますが、人工材料を使用するため、生体適合性の低さ、異物反応、感染のリスクという課題があります。
これらの課題を克服するために、私たちはコンピューター制御によるバイオ3Dプリント技術に注目しました。私たちはすでに、バイオ3DプリンターRegenova®︎によって人工材料を含まない神経導管を作製し、末梢神経再生における有効性を確認していました。以前の研究では細胞材料として成人由来の皮膚線維芽細胞を使用していましたが、成人から採取する線維芽細胞は品質がドナーごとに異なり、品質管理が容易ではありませんでした。そこで本研究では、品質が安定かつ管理しやすい、そして理論的に無限に拡大培養が可能なiPS細胞から、免疫調節分子の分泌、エキソソーム注7)の分泌、損傷組織の修復などが期待される間葉系幹細胞(iMSC)を誘導して、神経導管を作製しました。今回使用したiMSCは、iPS細胞から神経堤細胞(NCC)を介してiMSCへと誘導されますが、各段階で拡大培養、凍結保存、品質評価が可能であり、かつ動物由来成分を排除した方法で誘導されています。これらの特徴は、将来の臨床応用を考えた場合に大きな利点になると考えられます。
1. バイオ3D神経導管の作製
iMSCを温度応答性プレート注8)で培養して細胞シートを生成し、次に細胞シートを低接着プレート注9)に移して塊状のiMSC(clump-iMSC, 以下、C-iMSC)を作製しました(図1A、B)。直径500±50 µmのC-iMSCを、バイオ3Dプリンターを使って9×9剣山注10)に配置し、さらに培養して管状の構造体(バイオ3D神経導管)を作製しました。染色により、C-iMSCおよびバイオ3D神経導管のiMSCの周囲に細胞外マトリクス注11)(I型コラーゲン)の存在が確認されました(図1C)。バイオ3D神経導管の各作製段階での網羅的遺伝子発現解析注12)を行うと、iMSC、細胞シート、C-iMSC、およびバイオ3D神経導管の遺伝子発現パターンは、骨髄由来間葉系幹細胞に類似していることが明らかになりました。
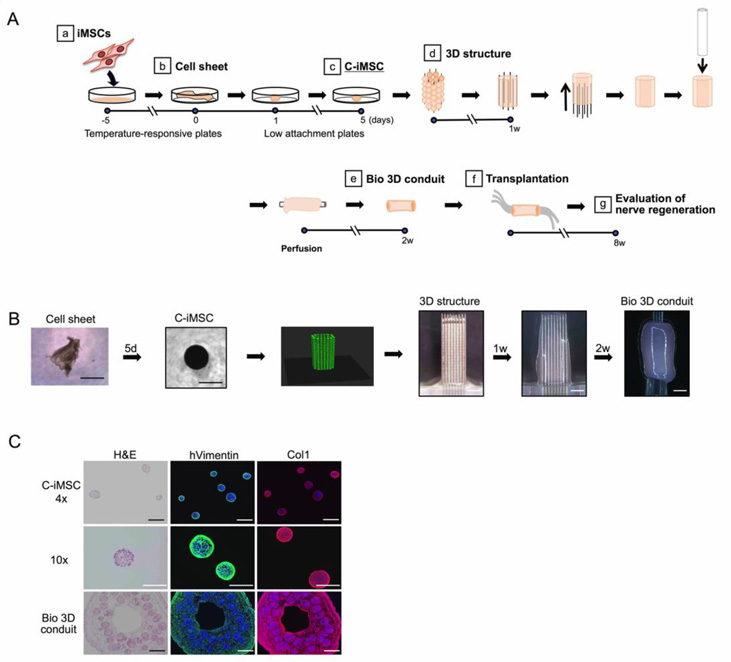
図1. 動物由来成分を含まないiMSCからのバイオ3D神経導管の作製
A. バイオ3D神経導管の作製方法
B. バイオ3D神経導管作製の各段階の画像
C. C-iMSCとBio 3D導管の断面画像
Col1, I型コラーゲン
2. バイオ3D神経導管の移植
次に、バイオ3D神経導管の治療効果を調べるために、ラットの坐骨神経切断モデルへの移植を行いました。移植手術の8週間後に肉眼的観察を行い、導管の形態と周囲組織への影響を確認しました。 バイオ3D神経導管移植群と、対照群として使用したシリコンチューブ移植群の両方で、切断神経はすべてのラットで接続が回復していました。また、バイオ3D神経導管は、8週間後も形状を維持しており、興味深いことに、表層で血管新生が顕著に観察されました。 バイオ3D神経導管の横断面と縦断面の観察から、バイオ3D神経導管の中心部分に再生神経があり、その周囲に血管新生が見られました。対照的に、シリコンチューブ移植群では、非常に細い再生神経のみが観察されました。
3. 再生神経の機能回復
バイオ3D神経導管移植群の機能回復を調べるために、下記の評価を行いました。
ピンプリックテスト注13)により、感覚神経の回復を評価しました。痛覚刺激の度合いによるグレードを1〜3の3段階で定義すると(グレード3が高反応)、手術の8週間後、バイオ3D神経導管移植群のすべてのラットがグレード3と評価されました(図2A)。シリコンチューブ移植群では、1匹のラットがグレード3、5匹のラットがグレード2と評価されました。どちらのグループも感覚神経の機能回復が観察されましたが、2つのグループ間に有意差があり、バイオ3D神経導管移植群の方が、感覚神経がより機能的に回復しているという結果になりました。
トースプレッドテスト注14)により、運動神経の回復を評価しました。指の広がり度合いによるグレードを1〜3で定義すると(グレード3が広がりが大きい)、手術の8週間後、バイオ3D神経導管移植群では、5匹のラットがグレード3、1匹のラットがグレード2と評価されました(図2B)。シリコンチューブ移植群では、1匹のラットがグレード2、3匹のラットがグレード1、2匹のラットがグレード0と評価されました。2つのグループ間に有意差があり、バイオ3D神経導管移植群の方が、運動神経がより機能的に回復しているという結果になりました。
行動機能回復を評価するために、トレッドミル注15)上での歩行時の、後肢の運動特性を測定しました。平均ドラッグトゥ(DT)注16)は、バイオ3D神経導管移植群とシリコンチューブ移植群の間に有意差はありませんでした(図2C)。バイオ3D神経導管移植群は、シリコンチューブ移植群よりも足の仰角(AoA)注17)が大きいことが分かりました(図2D)。
新しく伸長した軸索が標的筋の神経筋接合部に到達することを確認するために、足の内転筋の電気生理学的研究を行いました。 バイオ3D神経導管移植群は、シリコンチューブ移植群よりも大幅に大きな振幅を示しました(図2E)。平均運動神経伝導速度(MNCV)は、シリコンチューブ移植群よりもバイオ3D神経導管移植群の方が高いという結果になりましたが、差は有意ではありませんでした(図2F)。これらのデータは、バイオ3D神経導管移植群で標的の筋肉がより強く再び神経支配されることを示していました。
最後に、末梢神経損傷によって引き起こされる筋萎縮をチェックするために、前脛骨筋の湿筋肉重量を測定しました。筋肉の重量は、バイオ3D神経導管移植群の方がシリコンチューブ移植群よりも有意に重いということが観察されました(図2G)。これは、シリコンチューブ移植群の筋萎縮がより大きいことを示しています。バイオ3D神経導管移植群で筋萎縮が少なかったことから、回復の初期段階から標的筋が再び神経支配されたことが示唆されました。
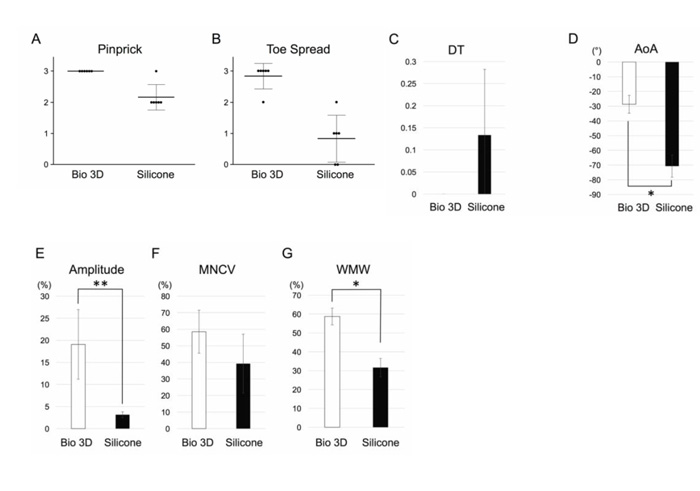
図2. 手術後8週間での機能回復
A. ピンプリックテスト(感覚神経の回復)
B. トースプレッドテスト(運動神経の回復)
C. ドラッグトゥ(DT)
D. 足の仰角(AoA)
E. F. 電気生理学的解析
振幅(Amplitude)と運動神経伝導速度(MNCV)
G. 前脛骨筋の湿潤筋重量(WMW)
4. 再生神経の組織学的解析
再生神経を評価するために、組織学的解析を行いました。
トルイジンブルー染色注18)により、バイオ3D神経導管移植群の中央部分(図3A-a、c、e)の有髄軸索注19)の数は、シリコンチューブ移植群(図3A-b、d、f)に比べて、多いということが観察されました。透過型電子顕微鏡(TEM)により、バイオ3D神経導管移植群には形態的に正常なミエリン鞘注20)を持つ有髄軸索が存在することが明らかになりました。また、バイオ3D神経導管移植群は、シリコンチューブ移植群と比較して、有髄軸索径が有為に大きく、ミエリンが厚いことが分かりました。最後に、バイオ3D神経導管移植群のG比(軸索直径÷ミエリン直径)は、シリコンチューブ移植群よりも有意に小さいことが分かりました。以上より、再生された軸索の形態は、シリコンチューブ移植群の形態よりも、現在のバイオ3D神経導管(ヒトiMSC)移植群の方が、有髄軸索の量と質の両方の点で優れていることが実証されました。
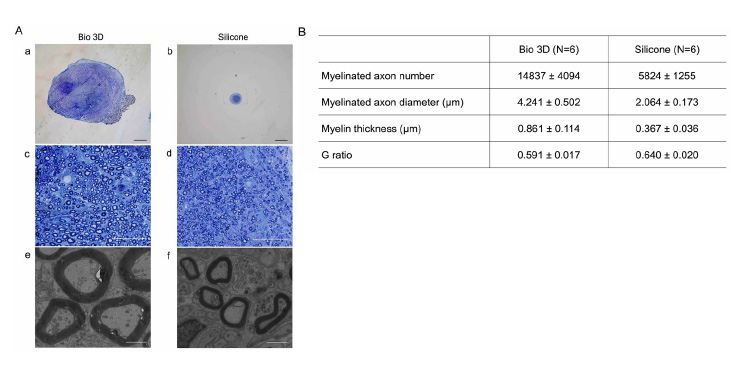
図3. 再生神経の組織学的解析
A. (a-d)光学顕微鏡下の横断面(トルイジンブルー染色)
(e、f)透過型電子顕微鏡による極薄横断面
スケールバー:(a、b) 1000 µm、(c、d) 50 µm、(e、f) 2 µm
B. バイオ3D神経導管移植群は、ミエリン化軸索数が多く、軸索径が大きく、
ミエリンが厚い(P <0.01)
5. Bio 3D導管の神経成長促進および血管成長促進の可能性
MSCは多種多様な分泌性の因子を生成することが知られています。そこで、バイオ3D神経導管が神経成長因子と血管成長因子を発現しているかどうかを評価しました。その結果、網羅的遺伝子発現解析では、各バイオ3D神経導管の各ステップで、神経発生および血管形成関連遺伝子が発現していることが明らかとなりました。また、RT-qPCR注21)では、代表的な神経成長(NGF、NRG1、TRAF6、およびHGF)と血管成長(VEGFA、VEGFB、ANGPT1、およびANGPT2)に関連する遺伝子の発現が確認されました。これらのデータは、移植前のバイオ3D神経導管が、神経成長促進機能と血管成長促進機能を通じて神経再生をサポートする可能性があることを示唆しています。
6. iMSCの血管新生の可能性
血管新生促進因子がバイオ3D神経導管で発現し、また導管周囲に豊富な血管新生が肉眼的に観察されたため、アテロコラーゲンスポンジ(Pelnac)注22)にiMSCを埋め込み、ラットの皮下に移植後2週間で観察しました(図4A)。iMSCを埋め込んだPelnac移植群(iMSC移植群、図4A左)の血管新生の総面積は、Pelnacのみの移植群(図4A中央)あるいはシリコン移植群(図4A右)よりも大きくなる傾向がありました(図4B)。iMSC移植群の血管新生の全長は、Pelnac移植群およびシリコン移植群のそれよりも有意に長いという結果が観察されました(図4C)。最後に、血管網の形成を評価するためにiMSC移植群の血管新生の閉じたネットワークの数は、Pelnac移植群およびシリコン移植群のネットワークよりも大幅に多いということが観察されました(図4D)。これらの結果により、皮下移植されたiMSCが、対照群(Pelnac群)としてのPelnac単独よりも強く形成された血管をより強く誘導することが明らかになりました。
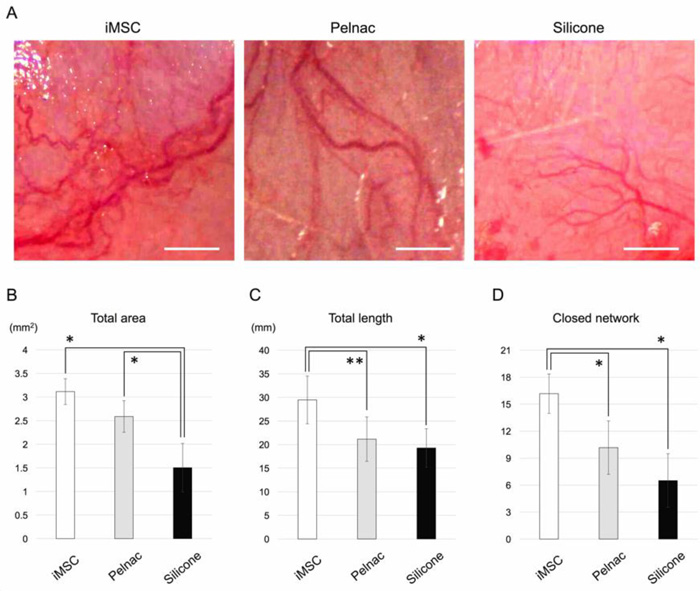
図4. 皮下移植による血管新生アッセイ
A. 3つのグループの手術用顕微鏡下の肉眼写真
iMSC移植群は多くの血管新生を示す
スケールバーは1 mm
B. iMSCグループの血管新生の総面積(* P <0.01)
C. iMSCグループの血管新生の全長(** P <0.05、* P <0.01)
D. iMSCグループの血管新生の閉じたネットワークの数(* P <0.01)
本研究では、動物由来成分を含まない方法で作製されたヒトiMSCで作製されたバイオ3D神経導管の、末梢神経再生に対する有効性とメカニズムを検証しました。末梢神経再生に対するバイオ3D神経導管の有効性は、線維芽細胞および歯肉由来のMSCで確認されていましたが、本研究ではiPS細胞から作製したMSC(iMSC)を使用したという点で新規性があります。
また、これまでの研究から、切断神経の周囲で新たに形成された血管は、シュワン細胞が切断部位を横切る足場となり、軸索再生のより良い環境を与えることが知られていました。本研究では、バイオ3D神経導管の内側と外側の両方に新たな血管形成が確認されており、またラットへの皮下移植によりiMSCに血管新生を誘導する能力が確認されました(図4)。以上から、iMSCから作製されたバイオ3D神経導管は、血管新生を介して末梢神経再生に寄与している可能性が示されました。
今後、臨床応用のためには、安全性、有効性、コストに関するさらなる研究が必要と考えられますが、iMSC由来のバイオ3D神経導管は神経欠損の治療において神経自家移植片に代わる有用なものになる可能性があります。
- 論文名
Pro‑angiogenic scaffold‑free Bio three‑dimensional conduit developed from human induced pluripotent stem cell‑derived mesenchymal stem cells promotes peripheral nerve regeneration - ジャーナル名
Scientific Reports - 著者
Sadaki Mitsuzawa1,*, Chengzhu Zhao2,*, Ryosuke Ikeguchi1,**, Tomoki Aoyama1, Daisuke Kamiya2,3, Maki Ando1, Hisataka Takeuchi1, Shizuka Akieda4, Koichi Nakayama5, Shuichi Matsuda1,
Makoto Ikeya2,3,** - 著者の所属機関
- 京都大学大学院医学研究科
- 京都大学iPS細胞研究所(CiRA)
- T-CiRAプログラム
- 株式会社サイフューズ
-
佐賀大学医学部附属再生医学研究センター
* 筆頭著者 **責任著者
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興機構 科学研究費補助金
-
AMED再生医療実現拠点ネットワークプログラム
「iPS細胞研究中核拠点」
「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」
「技術開発個別課題」 - 武田薬品工業株式会社「T-CiRA共同研究プログラム」
- 株式会社サイフューズ
- iPS細胞研究基金
注1) 動物由来成分
ウシ血清など、動物に由来する成分のこと。動物由来成分が含まれた条件で培養した細胞には未知、未検査のウイルスなどの感染リスクが伴うため、再生医療製品を作製する際には培養条件に動物由来成分が含まれないことが望ましい。
注2) 間葉系幹細胞(Mesenchymal Stem Cells; MSC)
成体の骨髄や脂肪組織に存在し、骨細胞、軟骨細胞、脂肪細胞などといった間葉系の細胞に分化する能力を持った間質(結合組織)の細胞。今回、iPS細胞から誘導したMSCを、iMSCと称している。
注3) バイオ3Dプリンター、またはバイオ3Dプリント技術
細胞を立体的に構築することができるプリンター、またはその技術。インクジェットプリンターのように噴出口から細胞を吹き出すタイプや、細胞を塊状にして、くし状の針(剣山注10))に挿すタイプなどがある。今回は剣山に刺す方法のプリンターRegenova®︎を使用した。
注4) 神経導管
神経細胞は、軸索と呼ばれる長い突起を伸ばし(軸索伸長)、別の神経細胞と結合することで情報ネットワークを形成している。神経細胞の中で軸索伸長を促す管腔構造体のことを神経導管と言う。
注5) 周術期
手術の前後の期間(術前、術中、術後)を含めた一定の期間のこと。
注6)スキャフォールド
細胞培養基材のこと。細胞の増殖や分化を制御する。
注7) エキソソーム
細胞から分泌される小胞。タンパク質、核酸、糖、脂質などの生理活性分子を含み、細胞間を輸送される。
注8) 温度応答性プレート
ディッシュの底面に温度応答性ポリマーが固定化されたプレート。37度では細胞が接着するが、室温にするとポリマーが親水性に変化し、細胞が遊離する。酵素を使わないため細胞へのダメージが少なく、また細胞外マトリクスを含んだまま細胞をシート状に剥がすことができる。
注9) 低接着プレート
ディッシュの底面にタンパク質低吸着処理がなされており、細胞が接着しない。このため、細胞を浮遊状態で培養できる。
注10)9 x 9剣山
バイオ3DプリンターRegenova®︎で使用する、くし状の針の山のこと。今回使用した剣山は、1辺に9本の針が配置されている。
注11)細胞外マトリックス
細胞間の隙間を埋める生体高分子(コラーゲンやプロテオグリカンなど)の集合体。骨・軟骨、歯、皮膚などに多く含まれ、組織を支えてメカニカル(クッション・伸び縮みなど)な機能を果たしている。
注12)網羅的遺伝子発現解析
細胞が発現している全てのmRNAの発現量を解析すること。特定の細胞には特徴的な遺伝子が発現していることが分かっているため、網羅的遺伝子発現解析を行うことで、その細胞の特徴を捉えることが可能である。
注13)ピンプリックテスト
針など尖ったものを軽く皮膚にあて、痛覚刺激を調べる方法。
注14)トースプレッドテスト
指の広がりを見ることで、運動神経機能を調べる方法。
注15)トレッドミル
ルームランナーのように、ベルトが動くことで走行を測る装置。
注16)ドラッグトゥ
足の引きずりを評価する方法。運動機能の回復を評価する。
注17) 足の仰角
足の甲が足に対してどの程度上を向くかを調べる方法。仰角が大きい方が機能を回復していると言える。
注18)トルイジンブルー染色
トルイジンブルーは塩基性の色素であり、核酸を青に、多糖類を紫に染色するため、組織染色に使用される。
注19)有髄軸索
髄鞘(ミエリン鞘)注20)を有する軸索のこと。
注20) ミエリン鞘
軸索にシュワン細胞が巻きつくことで形成される絶縁体。主にミエリンとよばれる脂質から形成されている。
注21) RT-PCR
逆転写酵素によりRNAを相補的なDNA(cDNA)に変換し、cDNAを用いてPCR(ポリメラーゼ連鎖反応)を行う実験手法で、遺伝子発現の有無やその量を調べることができる。また、実験や遺伝子の同定と単離を行う時にも用いられる。RTはReverse Transcriptase、PCRはPolymerase chain reactionの略。
注22)アテロコラーゲンスポンジ
コラーゲンの両端に存在するテロペプチドが分解されたものをアテロコラーゲンと呼ぶ。これをスポンジ状に加工したものがアテロコラーゲンスポンジである。






















