
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2022年5月16日
筋萎縮性側索硬化症(ALS)病因タンパク質TDP-43はコレステロール合成を制御する 〜ALSにおける脂質代謝異常と栄養療法の分子メカニズム探索〜
ポイント
- ALS病因タンパク質TDP-43注1)が増加すると、コレステロール注2)合成が低下することを見出した。
- TDP-43が増加すると、コレステロール合成を制御する転写因子注3) SREBP2注4)の活性を低下させる。
- リバーストランスレーショナルリサーチ注5)としての本研究結果は、ALSにおける脂質代謝異常と栄養療法の有効性の分子メカニズムに関連している可能性があると考えられた。
江川斉宏 元特定研究員(CiRA増殖分化機構研究部門、現 京都大学医学部附属病院脳神経内科(髙橋良輔教授)院内講師、理化学研究所(理研)バイオリソース研究センター(BRC) iPS創薬基盤開発チーム客員研究員)、井上治久教授(CiRA同部門教授、理研BRC同チームチームリーダー)、和泉唯信教授(徳島大学大学院医歯薬学研究部)らの研究チームは、筋萎縮性側索硬化症(ALS)病因タンパク質であるTAR DNA-binding protein of 43 kDa (TDP-43)を過剰発現する細胞培養系を用いて、TDP-43が脂質代謝のコレステロール生成を制御する転写因子Sterol regulatory element-binding protein 2 (SREBP2)の転写活性を抑制し、その下流遺伝子群の発現を抑制していることを明らかにしました。さらに、生体レベルでも ALSを生じるTDP-43遺伝子改変マウス脊髄組織でSREBP2の活性が低下し、同組織とALS患者さんの髄液中において、実際にコレステロール量が減少していることを見出しました(図1)。過去の臨床研究・報告では、脂質代謝異常は、ALSの進行を予測するための因子の一つとして考えられています。また、高カロリー・高脂質食による栄養療法は進行が速いALSの生命予後を改善することが報告されていますが、そのメカニズムはわかっていませんでした。本研究結果は、リバーストランスレーショナルリサーチにより、ALSにおける脂質代謝異常と栄養療法の有効性の分子メカニズムの一端を明らかにしたと考えられました。
この研究成果は2022年5月14日にScientific Reports誌でオンライン公開されました。
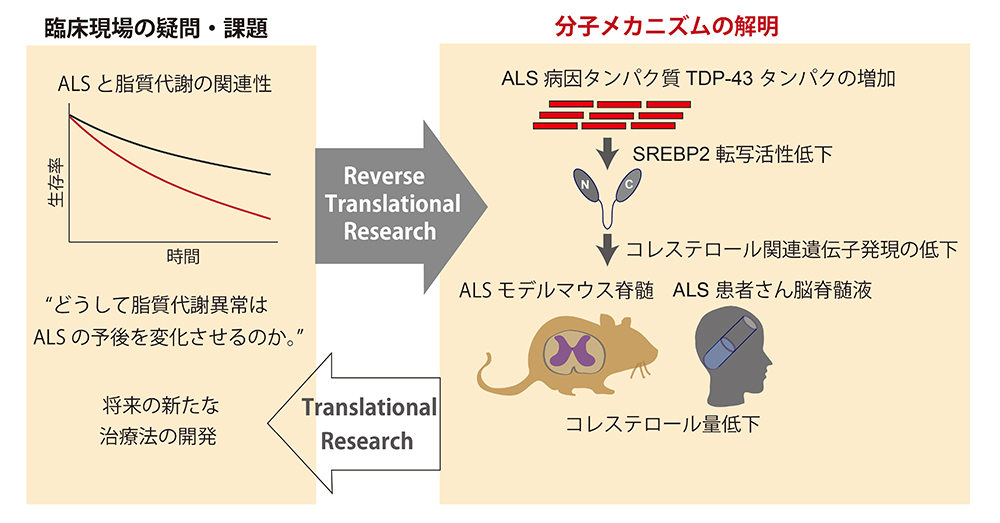
図1:研究概要図
ALSと脂質代謝の関連性を明らかにすべく、リバーストランスレーショナルリサーチを実施した。ALS病因タンパク質TDP-43を過剰発現した細胞株、ALSモデルマウス、ALS患者サンプルを用いてTDP-43がコレステロール合成を制御する転写因子SREBP2の活性を低下させることが分かり、TDP-43がコレステロール合成を制御する分子メカニズムの一端を解明した。
これまで、我々は、家族性のALSを生じるTDP-43変異を有する患者さんのiPS細胞を用いて、患者さんの運動神経細胞では、脂質代謝関連の遺伝子発現が低下していることを見出していました(CiRAニュース:2012年8月1日 「患者さん由来iPS細胞でALS病態解明・治療薬シーズを発見 Science Translational Medicineに掲載」)。 さらに、近年、脂質代謝異常や発症前の体脂肪がALSの予後に影響を及ぼし、高コレステロール血症が、ALSの予後に保護的に働くこと、高カロリー・高脂質食による栄養療法は進行速度が速いALSの生命予後を改善することが報告されています。しかし、その分子メカニズムはわかっていませんでした。そこで、この臨床的な疑問に対して、ALSの主要病因タンパク質であるTDP-43に着目したリバーストランスレーショナルリサーチを進めました。
まず初めに、TDP-43を過剰発現する細胞株を用いて、遺伝子発現解析を行った結果、コレステロール生成を制御する転写因子SREBP2とその下流遺伝子群の発現が抑制されていることを見出しました。
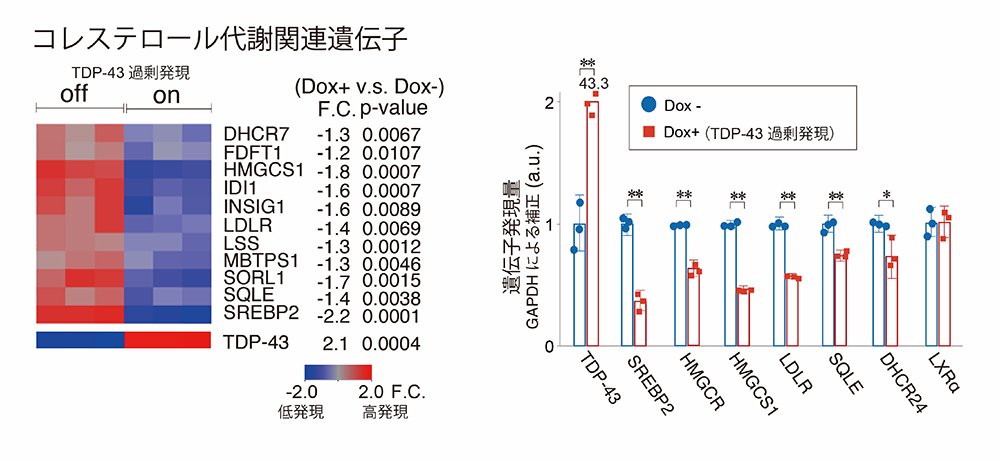
図2:TDP-43過剰発現細胞を用いた遺伝子発現解析
TDP-43を過剰発現させた細胞からmRNAを抽出してマイクロアレイ(左)と定量的PCR(右)の解析した結果、コレステロール代謝に関連する遺伝子の発現低下を認めた。
SREBP2タンパク質(T-SREBP2)は、N末端側の一部(N-SREBP2)が切り出されて、コレステロール関連遺伝子の転写活性部位であるsterol-regulatory elements (SREs)に結合してその発現を調節することが知られています。TDP-43を過剰発現させる(Dox+)とN-SREBP2の発現量が低下することがわかりました(図3左)。SREBP2の転写因子としての活性を測定すると、TDP-43タンパク質の量が増えるとともに、SREBP2の転写活性が低下し(図3中)、細胞内コレステロール量が低下しました(図3右)。これらから、TDP-43がSREBP2の転写活性を低下させ、コレステロール合成を抑制していることがわかりました。
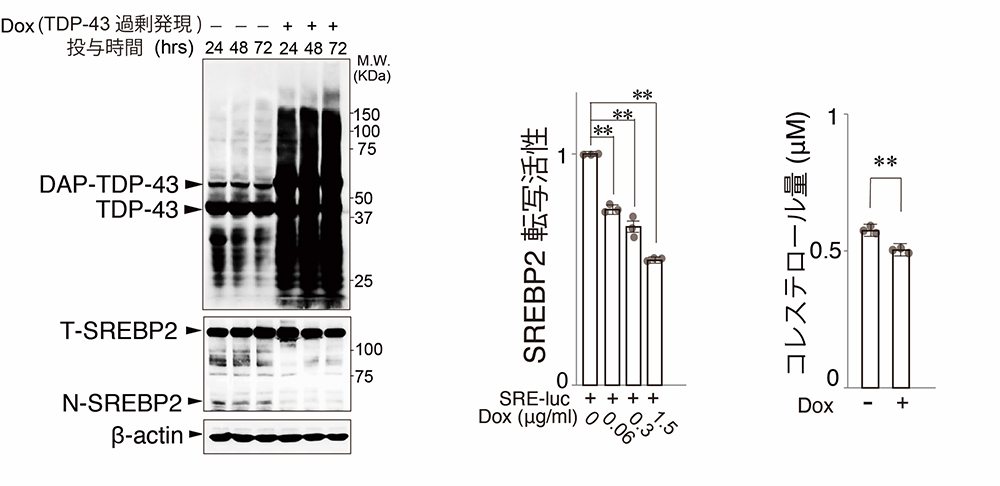
図3:TDP-43はSREBP2の転写活性を抑制して、コレステロール合成を低下させる。
TDP-43を過剰発現させると、転写活性を有するN末端SREBP2の発現量が低下し(図3左)、SREBP2の転写活性が抑制され(図3中)、コレステロール量の低下を認めた(図3右)。
最後に、生体レベルでTDP-43がコレステロール合成を低下させているかを検証するために、ALSを呈するメスのTDP-43遺伝子改変マウスの脊髄とALS患者さんの髄液におけるコレステロールを測定しました。結果として、ALSの症状を再現するメスのTDP-43遺伝子改変マウス脊髄のN-SREBP2の量は有意に低下し(図4上段)、ALSの運動症状の発症前、発症後のいずれのステージにおいても脊髄中コレステロール量が低下していました(図5下段)。さらに、ALS患者さんの髄液中においても、コレステロール量が低下していることを見出しました(図5)。
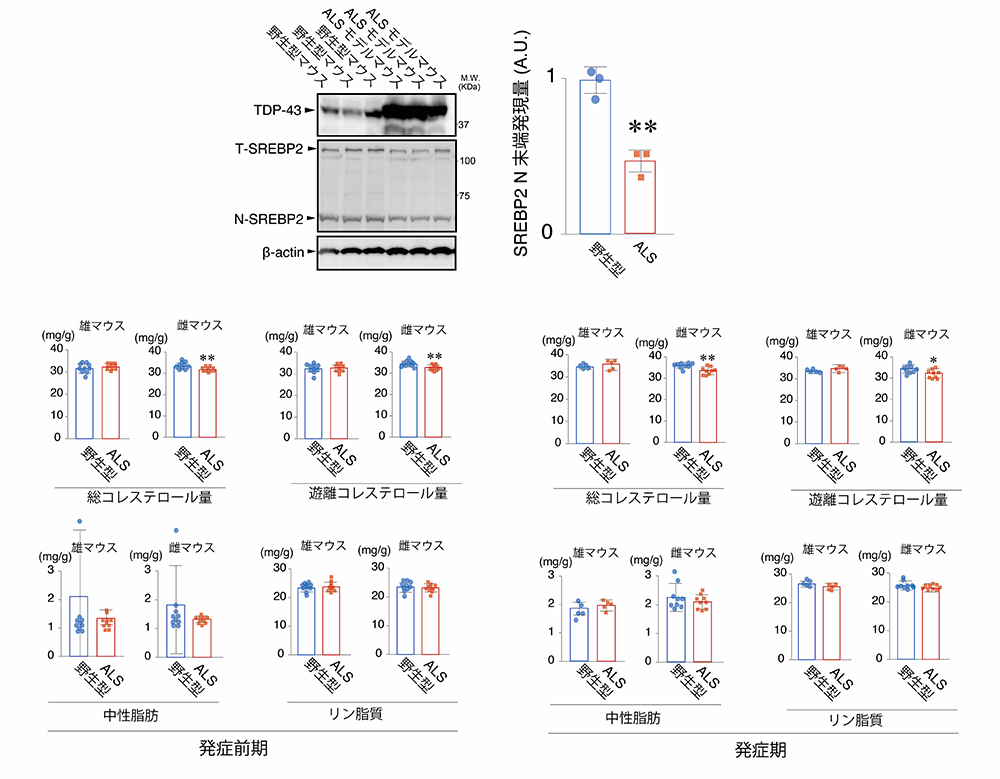
図4:ALSマウスの脊髄におけるSREBP2の活性低下とコレステロール量の低下
ALSマウスの脊髄では、N末端SREBP2タンパク質の量が減少していた(上段)。さらに、ALS運動症状発症前期と発症期の脊髄では、総コレステロール量と遊離コレステロール量が低下していた。
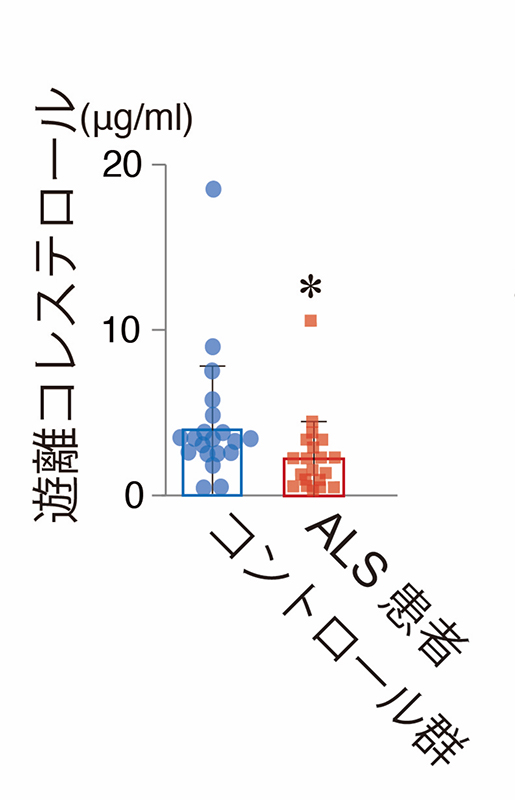
図5:ALS患者髄液サンプルにおける遊離コレステロール量の減少
コレステロールは細胞の増殖や生存に必須な成分です。一般的、脳・脊髄においては、グリア細胞がコレステロールの主たる産生源として神経細胞へ供給しているとされています。本研究から、TDP-43はSREBP2制御を通して、神経細胞・グリア細胞の脂質代謝が低下し、細胞死に影響を及ぼしている可能性を示しています。TDP-43は前頭側頭葉変性症や他の脳神経疾患にも関与しており、TDP-43タンパク質量やSREBP2の転写活性を調節することがALSを含むTDP-43関連疾患の治療につながる可能性が考えられます。
本研究により、ALS病因タンパク質TDP-43が、コレステロール合成を制御する転写因子であるSREBP2の転写活性を通して、コレステロール合成を制御することを明らかにしました。
ALSにおける脂質代謝異常と栄養療法の有効性の分子メカニズムの一端を明らかにしたと考えられ、今後ALS治療に向けた新たな治療ターゲットになると期待されます。
- 論文名
TDP-43 regulates cholesterol biosynthesis by inhibiting sterol regulatory element-binding protein 2 - ジャーナル名
Scientific Reports - 著者
Naohiro Egawa1,2,3, Yuishin Izumi4, Hidefumi Suzuki1,2,3, Itaru Tsuge1,5, Koji Fujita4, Hitoshi Shimano6, Keiichi Izumikawa7, Nobuhiro Takahashi7, Kayoko Tsukita1,3, Takako Enami1,8, Masahiro Nakamura1, Akira Watanabe1,9, Motoko Naitoh5, Shigehiko Suzuki5, Tsuneyoshi Seki10, Kazuhiro Kobayashi10, Tatsushi Toda10,11, Ryuji Kaji4, Ryosuke Takahashi2, Haruhisa Inoue1,3,8*
* 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所
- 京都大学大学院医学研究科臨床神経学(京都大学医学部附属病院脳神経内科)
- 理化学研究所バイオリソース研究センター(BRC)
- 徳島大学大学院医歯薬学研究部
- 京都大学大学院医学研究科形成外科学
- 筑波大学医学医療系内分泌代謝・糖尿病内科
- 東京農工大学大学院農学研究院
- 理化学研究所革新知能統合研究センター(AIP)
- 京都大学大学院医学研究科メディカルイノベーションセンター(MIC)
- 神戸大学大学院医学研究科分子脳科学分野
- 東京大学大学院医学研究科神経内科学
本研究は、下記機関より支援を受けて実施されました。
- JST戦略的創造研究推進事業 チーム型研究(CREST)
- 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
- 「生命の彩」ALS研究助成基金
- iPS細胞研究基金
注1)TDP-43 (TAR DNA Binding Protein 43)
ALSの脳・脊髄に蓄積する主要なタンパク質である。遺伝子変異により家族性のALSを生じる。前頭側頭葉変性症や辺縁系優位型加齢性TDP-43脳症(Limbic-predominant age-related TDP-43 encephalopathy: LATE)などの脳神経疾患の病態にも関わっている。
注2)コレステロール
細胞膜や髄鞘に多く含まれる脂質成分の主要成分であり、中枢神経の発達のみならず、形態維持・生存や神経活動の伝達などの機能に必須である。
注3)転写因子
ゲノムDNA上の特定の塩基配列に結合して、遺伝子の発現を制御するタンパク質。
注4)SREBP2 (sterol regulatory element-binding protein 2)
コレステロールを合成する主要な酵素の発現を制御しているマスター転写因子。N末端(N-SREBP2)がコレステロール関連遺伝子の転写活性部位であるsterol-regulatory elements (SREs)に結合してその発現を調節する。
注5)リバーストランスレーショナルリサーチ
臨床現場での疑問点や問題点を解明・解決するために行う基礎研究のこと。トランスレーショナルリサーチの逆方向の研究。






















