
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2012年8月1日
患者さん由来iPS細胞でALS病態解明・治療薬シーズを発見 Science Translational Medicineに掲載
江川斉宏研究員(京都大学CiRA/JST CREST)、北岡志保研究員(元京都大学CiRA/JST CREST)、井上治久准教授(京都大学CiRA/JST CREST/JST山中iPS細胞特別プロジェクト)の研究グループは、 山中伸弥教授(京都大学CiRA/同物質-細胞統合システム拠点/JST山中iPS細胞特別プロジェクト)や高橋良輔教授(京都大学大学院医学研究科)らの研究グループと協力し、ALS患者さんから樹立したiPS細胞を用いて、ALSのこれまで知られていなかった病態を解明し、ALSに対する新規治療薬シーズを発見しました。この研究成果は米国科学誌「Science Translational Medicine」に発表されました。
ポイント
- ALS(筋萎縮性側索硬化症)注1は病態に未解明の部分が多いために、治療薬開発が進んでいなかった。
- ALS患者さんの細胞から樹立したヒトiPS細胞注2を用いて、ALS患者さんの病態を細胞レベルで再現するモデルを構築し、これまで知られていなかったALSの病態の一端を明らかにした。
- ALS患者さんのiPS細胞を用いた世界で初めてのALS治療薬シーズ注3の発見である。
- ALSの新薬開発や発症メカニズムの解明にとって大きな一歩である。
1.要旨
ALSは運動ニューロン注4が変性することで次第に全身が動かなくなり死に至る疾患です。これまではALS患者さんから運動ニューロンを取り出すことができなかったために、患者さんの病態をそのまま反映するモデル注5を作ることが難しく、ALS治療に有効な治療薬開発は進んでいませんでした。
本研究では、TDP-43というタンパク質をコードする遺伝子に変異を持つ家族性のALS患者さんから樹立したiPS細胞を用いて、運動ニューロンを分化誘導しました(ALS運動ニューロン)。このALS運動ニューロンには、ALS病理組織の運動ニューロン内で見られるものと類似の、タンパク質の凝集体が観察されました。さらに、ALSに罹患していない運動ニューロンと比較して、突起が短く、ストレスに対して脆弱になっていました。TDP-43というタンパク質は、健常な状態ではRNA注6に結合して、RNAの合成・運搬等、RNA代謝注7に関与するとともに、TDP-43自身の発現量を自己調節していることが知られています。ALS運動ニューロンの遺伝子解析から、ALSではTDP-43の自己調節が異常をきたして、運動ニューロン内でTDP-43の発現量が増加し、神経細胞骨格の遺伝子発現や、RNA代謝に関連する分子の遺伝子発現に異常が生じていることを見いだしました。そこで、RNA代謝を調節することが知られている化合物をALS運動ニューロンに作用させたところ、それらの化合物の中でアナカルジン酸と呼ばれる化合物によって、TDP-43の発現量が低下し、ALS運動ニューロンのストレスに対する脆弱性が改善され、神経突起の長さが回復することを発見しました。
以上の結果から、ALS患者さん由来のiPS細胞から分化誘導した運動ニューロンは、ALSの治療薬シーズを探索する病態モデル系として有効であることが示され、今後の新薬開発を大きく加速することが期待されます。
2.研究の背景
ALSは50〜60歳ごろから発症し、運動ニューロンが変性することで次第に全身が動かなくなる病気です。ALSの病理組織を観察すると、運動ニューロンの細胞質に凝集体が観察されます。この凝集体はTDP-43というRNA結合タンパク質が集まったものであることが明らかにされていました。これまでALS病態を示す動物モデルが報告され、その中でもALSモデルマウスを用いた研究では病状を改善する治療薬候補がいくつか同定されました。しかし、その治療薬候補の中で、ALS患者さんに投与され治療の有効性が示されたものは未だありません。そのため、動物モデルより、さらに患者さんに近いヒトの細胞系でのモデル構築が求められていました。これまでにALS患者さんからiPS細胞を樹立し、運動ニューロンへと分化誘導することは行われてきました。しかし、ALSの病態に関して不明な点が多く、どのように培養皿の中でALSの病態を再現して、治療薬候補の探索を行うべきかがわかりませんでした。
3.研究結果
1) ALS患者さん由来のiPS細胞を用いて病態モデルを構築
ALSに罹患していないコントロールの方5名から樹立したiPS細胞とTDP-43に変異のあるALS患者さん3名から樹立したiPS細胞を用いて、それぞれ運動ニューロンへと分化誘導させたところ、ALS患者さん由来の細胞では、コントロールの方由来の細胞と比較して、神経細胞骨格を作る遺伝子のmRNA量が低下し、神経突起が短くなっていることを明らかにしました(Fig. 1)。さらに、TDP-43のmRNA量が増加し、ALS患者さんで見られるのと同じようなTDP-43タンパク質の凝集体形成が生じていること、ストレスに対して脆弱になっていることを見いだしました。このように、ALS患者さん由来のiPS細胞を用いて、ALS病態モデルを構築することができました。
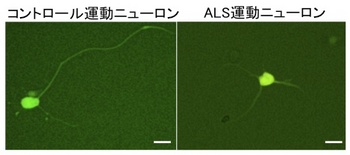
Fig. 1 運動ニューロンの突起長の比較
(図中のバーは10μmを示す)
2) 病態モデルを用いてALSに対する新規治療薬シーズ(アナカルジン酸)を発見
遺伝子発現の解析から、ALS患者さん由来のiPS細胞から作製した運動ニューロンでは、RNAの合成や運搬(RNA代謝)に異常があると考えられました。そこで、RNA代謝に作用することが知られている4つの化合物をそれぞれ作用させたところ、アナカルジン酸には、TDP-43の発現量を低下させ、ALS運動ニューロンのストレスに対する脆弱性と神経突起の長さを改善する効果があることがわかりました。
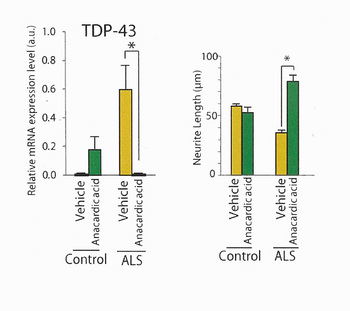
Fig. 2 アナカルジン酸の効果
左:TDP-43 mRNA量
右:神経突起の長さ
アナカルジン酸添加により、ALS運動ニューロンでTDP-43のmRNA量が減少し、神経突起の長さが長くなっています。
4.まとめ
本研究では、TDP-43遺伝子変異があるALS患者さん由来のiPS細胞を用いて運動ニューロンを分化誘導し、ALSの新たな病態を明らかにしました。TDP-43タンパク質は健常な状態ではTDP-43自身の発現量を自己調節していますが、ALSではその自己調節機構に異常をきたして、運動ニューロン内でTDP-43の発現量が増加し、TDP-43が制御しているRNA合成やRNA運搬に関する遺伝子や神経細胞骨格に関する遺伝子発現の異常が生じていることがわかりました。RNA代謝に効果があるとされる化合物をALS運動ニューロンに作用させたところ、これらの異常はアナカルジン酸により抑制され、回復することを明らかにしました。
多くの孤発性注8のALS患者さんの病理組織の運動ニューロンにTDP-43タンパク質の凝集体がみられることから、TDP-43の異常を制御する本研究の治療薬シーズは、患者さんの大半を占める孤発性のALSにも効果があることが期待されます。今後は、患者さんのiPS細胞を用いて、病態の更なる解明を進めるとともに、治療薬シーズ探索基盤を進化させて、多くの治療薬候補を得る必要があります。
5.論文名と著者
○ 論文名
"Drug Screening for ALS Using Patient-Specific Induced Pluripotent Stem Cells"
○ ジャーナル名
Science Translational Medicine
○ 著者
Naohiro Egawa1,2,*, Shiho Kitaoka1,2,*, Kayoko Tsukita1,2, Motoko Naitoh3, Kazutoshi Takahashi1, Takuya Yamamoto1,5, Fumihiko Adachi1, Takayuki Kondo1, 4, Keisuke Okita1, Isao Asaka1, Takashi Aoi1, Akira Watanabe1,5, Yasuhiro Yamada1,5, Asuka Morizane1,6, Jun Takahashi1,6, Takashi Ayaki4, Hidefumi Ito4, Katsuhiro Yoshikawa3, Satoko Yamawaki3, Shigehiko Suzuki3, Dai Watanabe7, Hiroyuki Hioki8, Takeshi Kaneko8, Kouki Makioka9, Koichi Okamoto9, Hiroshi Takuma10, Akira Tamaoka10, Kazuko Hasegawa11, Takashi Nonaka12, Masato Hasegawa12, Akihiro Kawata13, Minoru Yoshida14, Tatsutoshi Nakahata1, Ryosuke Takahashi4, Maria C. N. Marchetto15, Fred H. Gage15, Shinya Yamanaka1,5,16, Haruhisa Inoue1,2,16,**
*) これらの研究者はこの論文に同程度寄与しました。
**) 責任著者
○ 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 科学技術振興機構(JST) CREST
- 京都大学大学院医学研究科形成外科
- 京都大学大学院医学研究科神経内科
- 京都大学 物質-細胞統合システム拠点(iCeMS)
- 京都大学 再生医科学研究所
- 京都大学大学院医学研究科生体情報科学・京都大学大学院生命科学研究科認知情報学
- 京都大学大学院医学研究科高次脳形態学
- 群馬大学大学院医学系研究科神経内科
- 筑波大学臨床医学系神経内科
- 相模原病院神経内科
- 東京都医学総合研究所認知症・高次脳機能研究分野
- 東京都立神経病院神経内科
- 理化学研究所基幹研究所分子リガンド探索研究チーム
- ソーク研究所
- JST 山中iPS細胞特別プロジェクト
6.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
・ JST CREST注9
・ JST山中iPS細胞特別プロジェクト
・ 内閣府「最先端研究開発支援プログラム(FIRST)」
・ 文部科学省科学研究費補助金 新学術領域研究「シナプス病態」
・ 厚生労働科学研究費補助金(障害者対策総合研究事業(神経・筋疾患分野))
・ ノバルティス老化および老年医学研究基金
7.用語説明
注1) ALS(筋萎縮性側索硬化症)
筋肉が次第に萎縮し、全身の筋肉が動かなくなる病で、呼吸筋麻痺により亡くなる方が多い。運動ニューロン(神経細胞)に異常が生じることが原因であることがわかっているが、これまで有効な治療法は確立されておらず、日本では特定疾患に認定されている。
注2) iPS細胞
人工多能性幹細胞(iPS細胞:induced pluripotent stem cell)のこと。体細胞に特定因子を導入することにより樹立される、ES細胞に類似した多能性幹細胞。2006年に山中教授の研究により世界で初めてマウス体細胞を用いて樹立に成功したと報告された。
注3) 治療薬シーズ
治療薬を開発する際にヒントとなる物質やアプローチ方法のこと。今回発見した治療薬シーズとは、アナカルジン酸がもつ分子構造と、アナカルジン酸によるストレスへの脆弱性の改善、神経突起長の改善、TDP-43発現量の改善という、ALSを抑制する効果のことである。アナカルジン酸と似た構造を持つ他の物質の方が、より効果が高い可能性もあり、また安全性や薬物動態なども確認する必要もあり、今回見つかった物質がそのまま薬剤になるとは限らない。
注4) 運動ニューロン
脳からの司令を骨格筋に伝える神経細胞のこと。突起を長いものでは数十センチにも伸ばして信号を伝えている。ALSの患者さんではこの神経細胞が変性・死滅することで骨格筋が動かせなくなる。ALS患者さんの運動ニューロンにはTDP-43というタンパク質が凝集していることが知られていたが、ALSの病態や発症メカニズムにどう関わるのか不明であった。
注5) 病態モデル
その病気に特徴的な症状や性質を再現したもの。研究を行う際には、病態モデルを用いて病気の原因究明や治療薬の開発を行う。これまでも病態を再現した実験動物が、病態モデルとして多くの基礎研究に利用されていた。ヒトの疾患特異的iPS細胞から病態が再現できれば、ヒト細胞を用いた基礎研究が容易になることが期待されている。
注6) RNA (Ribo nucleic acid: リボ核酸)
大きく分けて3種(mRNA, tRNA, rRNA)がある。mRNA(メッセンジャーRNA)は遺伝子の情報を写しとったもの、つまり設計図のコピーのようなもの、RNAの情報をもとにタンパク質がつくられるので、mRNAの数と種類を調べることで、細胞がどのようなタンパク質をどのくらい作ろうとしているのか、知ることが出来る。
注7) RNA代謝
DNAの情報を写しとった核内でRNA鎖が合成され、細胞質へと運搬され、タンパク質の合成に用いられるなどの役目を終えたRNAが分解される一連の流れをのこと。
注8) 孤発性
ALSなどの疾患は家族性と孤発性の2種類にわけられる。家族性とはその疾患を発症する人が家系に集中することをいい、遺伝的要因が発症に大きく影響を与える。一方孤発性とは、発症する人が散発的に現れ、遺伝子以外の要因があることが推測されている。
注9) JST戦略的創造研究推進事業 チーム型研究(CREST)
研究領域 「人工多能性幹細胞(iPS細胞)作製・制御等の医療基盤技術」
(研究総括:須田 年生 慶應義塾大学 医学部 教授)
研究課題名 「iPS細胞を駆使した神経変性疾患病因機構の解明と個別化予防医療開発」
研究代表者 井上 治久(京都大学iPS細胞研究所 准教授)
研究期間 平成21年10月〜平成27年3月
JSTはこの領域で、iPS細胞を基軸とした細胞リプログラミング技術の開発に基づき、その技術の高度化・簡便化をはじめとした研究によって、革新的医療に資する基盤技術の構築を目指している。上記研究課題では、基礎および臨床の研究者を結集して、患者由来iPS細胞を用いて神経変性疾患の病因メカニズムの解明及び個別化予防医療開発を目的としている。






















