
研究活動
Research Activities
研究活動
Research Activities
研究成果
Publications
2022年10月26日
筋萎縮性側索硬化症(ALS)患者さんを対象とした ボスチニブ第1相試験; iDReAM試験の成果報告 (論文発表)
京都大学iPS細胞研究所(CiRA)の井上治久教授、徳島大学病院脳神経内科 和泉唯信教授、京都大学医学部附属病院脳神経内科 髙橋良輔教授、北里大学病院脳神経内科 永井真貴子診療准教授、鳥取大学医学部附属病院脳神経内科 渡辺保裕准教授らの研究チームは、医師主導治験「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1相試験注1」(iDReAM試験:iPSC-based Drug Repurposing for ALS Medicine Study)を行い、ボスチニブの安全性と忍容性注2を評価し、探索的に有効性評価を行いました。本成果は、世界神経学会、国際ALS/MNDシンポジウムの発表を経て、10月26日(日本時間)に、英国の科学雑誌 THE LANCET Discovery Science, eClinicalMedicineにオンライン掲載されました。
筋萎縮性側索硬化症(ALS)は、運動神経細胞が変性して筋萎縮と筋力低下を来す進行性の疾患で、経過に個人差はあるものの、人工呼吸器を使用しなければ、発症から数年で落命する疾患です。ALSの進行を緩和する既存薬はありますが、いまだALS の進行を停止する根本的治療は確立されていません。
これまで、研究チームは、ALS患者さん由来のiPS細胞から作製した運動神経細胞を用いて、ALSの病態を再現、薬効評価できることを見出し(参照:CiRAプレスリリース 2012年8月1日)、さらに、ALSの病態の中核である運動神経細胞の細胞死と異常タンパク質の蓄積を抑えることができる化合物のスクリーニングを行うiMNシステム注3を開発しました(参照:CiRAプレスリリース 2017年5月25日)。このシステムを用いて、既に他の疾患で治療薬として用いられている物質を含むさまざまな種類の化合物をスクリーニングした結果、Src/c-Abl経路注4がALSの潜在的治療標的分子となることを見出し、Src/c-Abl阻害剤として、強い抗ALS病態効果を有するボスチニブを同定し、発表しました。ボスチニブ(販売名:ボシュリフ®錠)は、慢性骨髄性白血病の治療薬として用いられている既存薬です。
慢性骨髄性白血病においてボスチニブは1日量として、前治療歴に応じて通常500mgまたは400mgが投与されます。また、患者さんの状態により適宜増減され、最大1日量として600mgまで投与可能です。一方、ボスチニブはALSを適応症として日本および世界各国で承認されておらず、ALSに対する有効性、安全性ならびに適切な用量は確立していません。そのため、ボスチニブは現時点でALSの治療薬として使用できる状況にありません。
研究チームは、2019年から、「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1相試験」(iDReAM試験)を行い(参照:CiRAプレスリリース 2019年4月23日)、ALS患者さんにおけるボスチニブの安全性と忍容性を評価し、探索的に有効性を評価しました(参照:CiRAプレスリリース 2021年10月1日)。
| 2008年7月 | ALS患者さんのiPS細胞作製開始。 |
|---|---|
| 2012年8月 | ALS患者さん由来のiPS細胞から作製した運動神経細胞を用いたALSの病態再現、薬効評価を発表。 |
| 2017年5月 | ALS患者さんのiPS細胞を用いたiMNシステムにより化合物スクリーニングを実施し、ALS治療標的分子経路Src/c-Ablと治療薬候補ボスチニブを同定したことを発表。 |
| 2017年9月 |
独立行政法人医薬品医療機器総合機構(PMDA)事前面談実施。 以後、事前面談を合計4回実施。 |
| 2018年7月 | PMDA 対面助言実施。 |
| 2019年2月 |
京都大学 治験審査委員会(IRB)承認。 以後、各治験実施機関のIRB承認。 |
| 2019年3月 | 治験届を提出し、治験を開始。 |
| 2021年9月 | 治験終了。 |
|
2021年10月 12月 |
治験結果についてWCN 2021 第25回世界神経学会議 XXV World Congress of Neurologyおよび第32回ALS/MND国際シンポジウム 32th International Symposium on ALS/MNDにて発表。 |
| 2022年10月 | THE LANCET Discovery Science, eClinicalMedicineに成果公表。 |
本試験において、12名の患者さんについてALS特有の有害事象注5が生じる可能性がないか調べるために、はじめに3名のALS患者さんに1日量100mgを投与し、その結果について安全性評価委員会注6で評価を行った後、別のALS患者さん3名に1日量200mg、次に別のALS患者さん3名に1日量300mg、同様にさらに別のALS患者さん3名に1日量400mgを投与する試験を実施しました。
結果として、ボスチニブ1日量100mg~300mgを投与されたALS患者さん9名が12週間の試験を完了しました。1日量400mgを投与されたALS患者さん3名は、有害事象により試験を完了しませんでした。全体を通じての有害事象としては、下痢、肝機能障害などが見られました。治験実施計画書に規定した基準に基づき、適切なボスチニブの投与調整や支持療法による管理が必要な場合がありました。
ALS患者さんにおけるボスチニブの有効性を探索するために、ALSの症状の進行を示す指標であるALSFRS-R注7の変化を調べました。ALSの症状が進行するとALSFRS-Rのスコアが低下します。参加された患者さんの人数に限りはあるものの、ボスチニブを12 週間内服された9名の方のうち5名の方では、ボスチニブ内服後、ALSFRS-Rスコアの低下が抑制されました。ALSFRS-Rの低下が抑制された方では、ボスチニブ投与前の血液中のニューロフィラメントL(NFL)注8という物質の量が少ないことがわかりました。
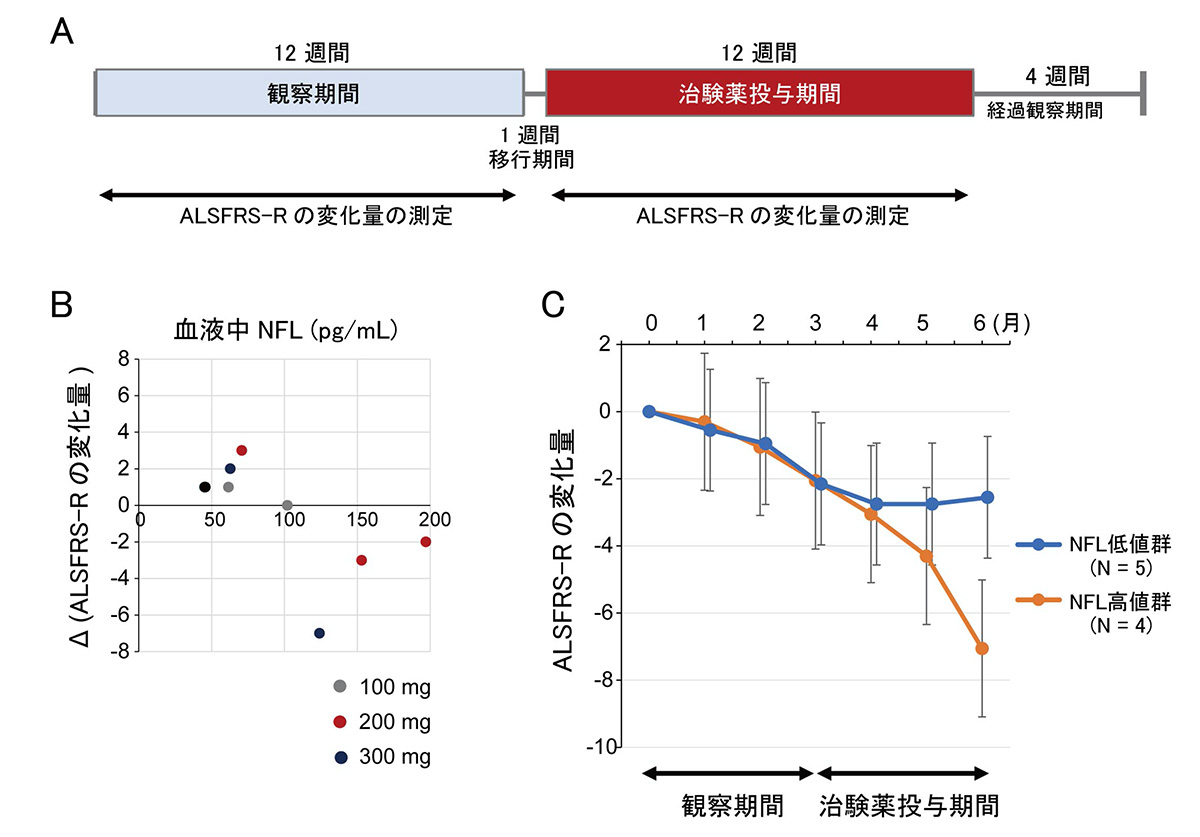
A:治験スケジュール。
B:血液中NFLの値とALSFRS-Rスコアの変化の関係。
Δ(ALSFRS-Rの変化量)は、治験薬投与期間のALSFRS-R変化量と観察期間のALSFRS-R変化量の差を示す。ALSFRS-Rの低下が観察期間よりも治験薬投与期間で抑えられた患者さんは、血液中NFL値が低い傾向を示した。
C:ALSFRS-Rの変化量。血液中NFL低値の患者さん群では、治験薬投与期間中のALSFRS-R低下抑制が認められた(エラーバーは 95%信頼区間を示す)。
ALS患者さんで認められた有害事象の種類は慢性骨髄性白血病と同様であり(ボシュリフ錠 100 mg添付文書、2020年6月改訂)、ボスチニブの100mg~300mgの用量レベルでの忍容性は良好であることがわかりました。また、治験実施計画書に規定した基準に基づき、適切なボスチニブの投与調整や支持療法による管理が必要な場合がありました。探索的有効性解析注9では、ボスチニブの投与期間において、血液中NFL値が低い患者さんではALSFRS-Rの低下が抑制され、一部の患者さんでALSの進行の停止がみられました。ただし、本臨床試験に参加された患者さんの人数に限りがあるため、更なる検討が必要であると考えます。
現在、さらなるボスチニブの安全性と有効性を調べるために、ALS患者さんを対象とした第2相試験を進めています(参照:CiRAプレスリリース2022年4月15日)。
iDReAM試験結果の論文:
Keiko Imamura, Yuishin Izumi, Makiko Nagai, Kazutoshi Nishiyama, Yasuhiro Watanabe, Ritsuko Hanajima, Naohiro Egawa, Takashi Ayaki, Ryosuke Oki, Koji Fujita, Ryuji Uozumi, Akiko Morinaga, Tomoko Hirohashi, Yosuke Fujii, Takuya Yamamoto, Harutsugu Tatebe, Takahiko Tokuda, Naoto Takahashi, Satoshi Morita, Ryosuke Takahashi, Haruhisa Inoue
Safety and tolerability of bosutinib in patients with amyotrophic lateral sclerosis (iDReAM study): a multicentre, open-label, dose-escalation phase 1 trial
eClinicalMedicine 2022 Oct 25 doi: 10.1016/j.eclinm.2022.101707
治験プロトコール論文:
Keiko Imamura, Yuishin Izumi, Haruhiko Banno, Ryuji Uozumi, Satoshi Morita, Naohiro Egawa, Takashi Ayaki, MD, Makiko Nagai, Kazutoshi Nishiyama, Yasuhiro Watanabe, Ritsuko Hanajima, Ryosuke Oki, Koji Fujita, Naoto Takahashi, Takafumi Ikeda, Akira Shimizu, Akiko Morinaga, Tomoko Hirohashi, Yosuke Fujii, Ryosuke Takahashi, Haruhisa Inoue
Induced pluripotent stem cell-based Drug Repurposing for Amyotrophic lateral sclerosis Medicine (iDReAM) study: Protocol for a phase 1 dose escalation study of bosutinib for amyotrophic lateral sclerosis patients
BMJ Open. 2019 Dec 2;9(12):e033131. doi: 10.1136/bmjopen-2019-033131.
-
研究代表者
京都大学iPS細胞研究所(CiRA) 井上治久教授 -
治験調整医師
徳島大学病院 和泉唯信教授、京都大学iPS細胞研究所(CiRA) 井上治久教授 -
治験責任医師
京都大学脳神経内科 髙橋良輔教授
徳島大学脳神経内科 藤田浩司講師
北里大学脳神経内科 永井真貴子診療准教授
鳥取大学脳神経内科 渡辺保裕准教授 -
治験調整事務局
京都大学iPS細胞研究所(CiRA) 今村恵子特定拠点講師
イーピーエス株式会社
本研究は、下記機関より支援を受けて実施されました。
-
日本医療研究開発機構(AMED)創薬事業部(規制科学推進課)
臨床研究・治験推進研究事業患者のニーズに応える医薬品開発に資する臨床研究・治験の推進 疾患登録システム(患者レジストリ)を活用した医薬品開発を目指す臨床研究・医師主導治験の推進 の研究課題「患者レジストリを活用した筋萎縮性側索硬化症治療薬開発のための医師主導治験」 - iPS細胞研究基金
- 幹細胞医学分野に対する研究助成
その他の支援として、本第1相試験は、ファイザー株式会社と京都大学の共同研究契約に基づき、ファイザー株式会社から治験薬の提供、安全性情報提供、治験デザインおよび治験実施管理等の助言・サポートを受けて実施しました。
本治験開始前までのiPS細胞の基礎研究に、以下の公的研究費の支援を受けて研究を進めました。
-
科学技術振興機構戦略的創造研究推進事業 CREST「人工多能性幹細胞(iPS細胞)作製・制御等の医療基盤技術」研究領域「iPS細胞を駆使した神経変性疾患病因機構の解明と個別化予防医療開発」
(2009年度-2014年度) - 日本学術振興会 「新学術領域研究」シナプス・ニューロサーキットパソロジーの創成「人工多能性幹細胞作製技術を応用した神経変性疾患細胞機能・回路異常病理の解明」(2010年度-2014年度)
-
厚生労働省 厚生労働科学研究費補助金(こころの健康科学研究事業・障害者対策総合研究事業)
(2009年度-2011年度) - 厚生労働省 厚生労働科学研究費補助金(難治性疾患克服研究事業)疾患特異的iPS細胞を用いた難治性疾患の画期的診断・治療法の開発に関する研究(2009年度-2011年度)
-
国立研究開発法人日本医療研究開発機構(AMED)
再生医療実現拠点ネットワークプログラム「疾患特異的iPS 細胞を活用した難病研究高品質な分化細胞・組織を用いた神経系および視覚系難病のin vitroモデル化と治療法の開発 」(2012年度-2016年度) - 厚生労働省 医療施設運営費等補助金(臨床研究拠点等整備事業)iPS細胞を利用した創薬研究支援事業(2012年度)
- 厚生労働省 厚生労働科学研究費補助金(難病・がん等の疾患分野の医療の実用化研究事業(再生医療関係研究分野)「難治性疾患創薬シーズの探索と薬剤安全性評価法開発」(2013年度-2016年度)
- GAPファンドプログラム(2017年度-2018年度)
-
AMED再生医療実現拠点ネットワークプログラム再生医療用iPS細胞ストック開発拠点(中核拠点)
(2018年度) - AMED再生医療実用化研究事業(2018年度)
本治験開始前までのiPS細胞の基礎研究に、以下の寄附金の支援を受けました。
- 公益財団法人武田科学振興財団医学系研究奨励(2006年度)
- 公益財団法人武田科学振興財団医学系研究奨励継続助成(2008年度)
- 公益財団法人かなえ医薬振興財団研究助成金(2008年度)
- 一般社団法人日本老年医学会ノバルティス老化および老年医学研究基金研究助成金(2009年度)
- 公益財団法人臨床薬理研究振興財団研究助成(2012年度)
- 公益財団法人 持田記念医学薬学振興財団 財団設立30周年記念助成(2013年度-2015年度)
- 公益財団法人第一三共生命科学研究振興財団研究助成(2015年度-2016年度)
- 一般社団法人日本ALS協会IBC(アイス・バケツ・チャレンジ)グラント(2017年度-2018年度)
- 井上研究室における研究活動助成
注1)筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1相試験
筋萎縮性側索硬化症患者さんを対象としたボスチニブの医師主導治験。
注2)忍容性
薬の副作用が患者さんにとってどれだけ耐えられるものであるかの程度。
注3)iMNシステム
iPS細胞に3つの転写因子Lhx3, Ngn2, Isl1を導入し、迅速に運動神経細胞を作製する方法。iPS細胞から、短期間に再現性良く大量の運動神経細胞を作製でき、化合物のスクリーニング研究に適している。
注4)Src/c-Abl経路
細胞増殖、浸潤、接着などに関与し、がん細胞で活性化していることが知られている。慢性骨髄性白血病の治療標的。
注5)有害事象
薬を投与された患者さんに生じたあらゆる好ましくない徴候、症状、または病気。
注6)安全性評価委員会
治験依頼者、治験責任医師及び治験調整医師から独立した立場で治験の安全性データを評価し、治験の継続、変更又は中止を提言する委員会。
注7)ALSFRS-R
ALS機能評価スケール改訂版(ALS functional rating scale-revised)。
ALS患者さんの日常生活を把握するために作られた評価尺度。言語、嚥下、身の回りの動作、歩行などの12項目について、それぞれ0~4の5段階で評価し、その合計点(0~48)で評価する。
注8)ニューロフィラメントL
ニューロフィラメント軽鎖(Neurofilament Light chain)。神経細胞の軸索突起に豊富に含まれる細胞骨格の成分である。
注9)探索的有効性解析
臨床試験の主要な目的に沿った解析以外に、結果を裏付けるために行う解析や、素材の新たな可能性を発見するための解析。
徳島大学病院 脳神経内科 和泉唯信 教授
「本治験は、ALSの方に対する初の分子標的薬の治験でしたが、少数例ながら、臨床的にALS特有の有害事象は観察されませんでした。治験にご参加いただいた患者さんおよび関係者の皆さんに心よりお礼申し上げます。今後も引き続き、患者さんおよび関係者の皆さんと力を合わせて、ALSの治療法開発を進めてまいります。」
京都大学iPS細胞研究所 増殖分化機構研究部門 井上治久 教授
「iPS細胞を作製いただいた全てのALS患者さんと関係の皆様に感謝申し上げます。本治験は、2005年のALS患者さん皮膚幹細胞の研究に始まり、2008年のALS患者さんiPS細胞作製、iPS細胞モデルで同定した治療標的分子と既存薬の研究を実際の臨床へとつなぐ第一歩目でした。これからも、ALS克服を目指してチーム一丸となり、研究を進めさせていただければと存じます。」






















