
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2017年2月2日
センダイウイルスベクターを用いてES細胞/iPS細胞から脊髄運動ニューロンを簡便に作製する技術開発
ポイント
- LIM/homeobox protein 3 (Lhx3)、Neurogenin 2 (Ngn2) 、Islet-1(Isl1)という3つの転写因子注1を搭載したセンダイウイルス(SeV)ベクター注2を用いて、ES細胞/iPS細胞から脊髄運動ニューロンへ分化させる手法を確立しました。
- この手法を用いると、iPS細胞では分化開始から2日で脊髄運動ニューロンのマーカーが発現してくることが分かりました。
- この技術で作製した家族性筋萎縮性側索硬化症(ALS)注3患者さんから作ったiPS細胞由来の脊髄運動ニューロンを用いて、ALS脊髄運動ニューロンの特徴の一部を観察しました。
後藤和也大学院生(京都大学大学院医学研究科臨床神経学)、今村恵子助教(京都大学CiRA増殖分化機構研究部門)、小松研一医師(北野病院、元・京都大学大学院医学研究科臨床神経学)、
井上治久教授(京都大学CiRA増殖分化機構研究部門)らの研究チームは、センダイウイルス(SeV)ベクターを用いてES細胞/iPS細胞から脊髄運動ニューロンへと分化させる技術を確立しました。
これまでES細胞/iPS細胞から脊髄運動ニューロンへと分化させる方法は数多く報告されてきましたが、多くの培養ステップを踏む必要がありました。研究チームが確立した技術は、この課題を改善し、脊髄運動ニューロンをきわめて簡便に作製することを可能にしました。今後、ALSなどの脊髄運動ニューロンの病変を有する疾患の研究の有用な手段となることが期待されます。
この研究成果は、2017年2月2日に米国科学誌「Molecular Therapy - Methods & Clinical Development」でオンライン公開されました。
ALSは脊髄運動ニューロンの異常が原因の代表的な疾患の一つで、次第に筋肉が動かなくなり、呼吸筋も障害されるため、発症後数年で人工呼吸器使用が必要になる疾患です。
これまでALSについての多くの研究が発表されましたが、病気の鍵となるメカニズムはまだ解明されておらず、満足のいく治療法は確立されていません。近年、ES細胞/iPS細胞を用いた、ALSなどの脊髄運動ニューロン疾患の研究の新たなアプローチが始まっています。
これまでES細胞やiPS細胞から脊髄運動ニューロンを分化させる方法はいくつか報告されてきました。しかし、化合物を用いる既存の方法では多くの培養ステップを経る必要がありました。
そこで研究チームは、転写因子を搭載したSeVベクターを用いて、ES細胞やiPS細胞を脊髄運動ニューロンへワンステップで簡便に分化させる技術を確立しました。
更に、この技術を用いて作製したALS患者さんから作ったiPS細胞由来の脊髄運動ニューロンは、病気の特徴の一部を再現しました。
この技術は、脊髄運動ニューロン作製を簡便にし、疾患モデル研究の有用な手段となると考えられます。
1. SeVベクターに転写因子Lhx3、Ngn2、Isl1を搭載して、ES細胞/iPS細胞から脊髄運動ニューロンへ分化させる手法を確立しました。
SeVベクターを用いてES細胞/iPS細胞にLhx3、Ngn2、Isl1を導入し、脊髄運動ニューロンを作製しました。SeVベクターが導入された細胞の中で、脊髄運動ニューロンの割合は90%以上でした。
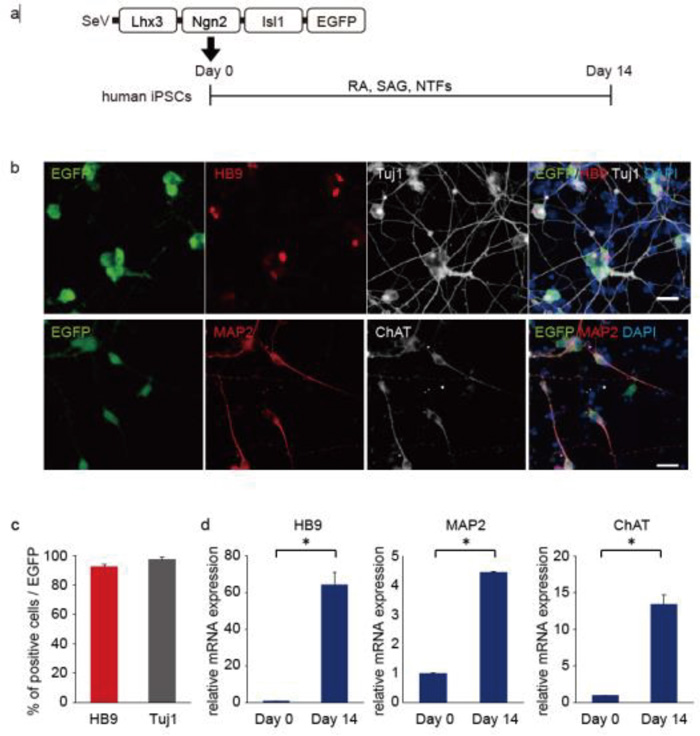
Fig. 1 SeVベクターを用いた転写因子導入による脊髄運動ニューロン作製
(a) 実験の概要図。
(b) 免疫染色した脊髄運動ニューロンマーカー(HB9、ChAT)とニューロンマーカー(Tuj1、MAP2)。スケールバーは20μm。
(c) SeVベクターが導入された細胞における脊髄運動ニューロン、ニューロンの分化効率。
(d) 分化開始後、Day 0とDay 14における脊髄運動ニューロンマーカー(HB9、ChAT)とニューロンマーカー(MAP2)のmRNA発現解析。
2. 分化開始2日で脊髄運動ニューロンのマーカーが発現してくることが分かりました。
脊髄運動ニューロンのマーカーであるHB9が発現すると緑色に光るiPS細胞に、SeVで転写因子を導入し、ライブイメージングを行い、
どのくらいの速さで脊髄運動ニューロンができるかを調べました。すると、約48時間で細胞が緑色に発光し、これまで評価された方法の中で最も早く脊髄運動ニューロンマーカーが発現することを観察できました。
3. 家族性ALS患者さんから作ったiPS細胞由来の脊髄運動ニューロンは、異常タンパク質の蓄積を認めました。
この手法が脊髄運動ニューロンの研究に応用可能かどうか確かめるため、家族性ALS患者さんの線維芽細胞からiPS細胞を樹立し、SeVベクターで転写因子を導入してiPS細胞を脊髄運動ニューロンに分化させました。
家族性ALS患者さんの代表的な原因遺伝子としてSOD1(Superoxide Dismutase 1)遺伝子とTDP-43(TAR DNA-binding protein 43)遺伝子があります。SOD1遺伝子変異を持つALS患者さんから作ったiPS細胞由来の脊髄運動ニューロンは、タンパク質の折りたたみ異常を呈するSOD1タンパク質の蓄積を認めました。また、TDP-43遺伝子変異を持つALS患者さんから作ったiPS細胞由来の脊髄運動ニューロンは、細胞質にTDP-43の凝集を認めました。
SeVベクターを用いて3つの転写因子を導入することにより、簡便にES細胞/iPS細胞から脊髄運動ニューロンへ分化させる技術を確立しました。 3つの転写因子を1つのベクターに搭載することにより各細胞間での導入転写因子の割合を均一にすることができる利点があります。 またSeVベクターは細胞の染色体に外来遺伝子を組み込ませない特長があります。 この技術が他のタイプのニューロンに適用できるかは更なる研究が必要ですが、ES細胞/iPS細胞など幹細胞を用いた神経疾患研究を促進することが期待されます。
- 論文名
"Simple derivation of spinal motor neurons from ESCs/iPSCs using Sendai virus vectors" - ジャーナル名
Molecular Therapy - Methods & Clinical Development - 著者
Kazuya Goto1,2, Keiko Imamura2, Kenichi Komatsu1, Kohnosuke Mitani3, Kazuhiro Aiba1, Norio Nakatsuji4, Makoto Inoue5, Akihiro Kawata6, Hirofumi Yamashita1, Ryosuke Takahashi1, Haruhisa Inoue2 - 著者の所属機関
- 京都大学大学院医学研究科 脳病態生理学講座 臨床神経学(神経内科)
- 京都大学iPS細胞研究所(CiRA)
- 埼玉医科大学ゲノム医学研究センター
- 京都大学物質-細胞統合システム拠点(iCeMS)
- アイロムグループ・株式会社IDファーマ
- 東京都立神経病院
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞を活用した難病研究」
- AMED 再生医療実用化研究事業
- AMED 再生医療実現拠点ネットワークプログラム「iPS細胞研究中核拠点」
- 第一三共生命科学研究振興財団
注1) 転写因子
DNAに結合し、DNAからRNAへの転写に関わる因子。タンパク質合成は、DNA上の遺伝子を鋳型にmRNAが転写され、このmRNAが核外のリボソーム上で翻訳される過程で成り立っている。転写因子は、転写開始に関わる因子で、DNAに結合して働くものや因子間の相互作用によって機能するものがある。
注2) センダイウイルス(SeV)ベクター
ベクターとは遺伝子の「運び手」で、生体内外において核酸物質を細胞内へ導入し細胞の機能を改変する能力を持つ。ウイルス法は、一般的に遺伝子導入効率は高いものの、その細胞毒性や免疫原理に問題があったが、SeVベクターは、遺伝子が標的細胞の核内に侵入せず染色体に組み込まれないという特長を持ち、安全性や効率の面で優れている。
注3) 筋萎縮性側索硬化症 (Amyotrophic lateral sclerosis: ALS)
運動神経細胞に異常が生じることで、全身の筋肉が徐々に動かなくなる病気。これまでに根治的な治療法は確立されておらず、日本では特定疾患に認定されている。およそ90%程度が孤発性で、残りの10%が遺伝性である。






















