
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2014年9月16日
ダイレクトリプログラミング技術およびiPS細胞技術を用いたⅡ型コラーゲン異常症の疾患モデル系を確立
岡田稔研究員(京都大学CiRA)、妻木範行教授(京都大学CiRA、JST CREST)らの研究グループは、骨系統疾患の一つであるⅡ型コラーゲン異常症の患者さんから採取した細胞から、ダイレクトリプログラミングやiPS細胞技術を用いてⅡ型コラーゲン異常症の疾患モデル系を構築しました。この研究成果は2014年9月3日に英国科学雑誌「Human Molecular Genetics」のオンライン版で公開されました。
ポイント
- Ⅱ型コラーゲン異常症注1は患者さんから軟骨を得ることが難しいため、病態解析や創薬研究を行うことが難しい。
- 患者さんの線維芽細胞から軟骨細胞を直接誘導する方法(ダイレクトリプログラミング注2)、iPS細胞を経由する方法、そしてiPS細胞をマウスに移植する方法で疾患モデルを作製した。
- いずれの方法でも、患者さんの病態の一部(小胞体ストレス注3が生じていること)を再現していた。
軟骨の主要な構成成分の一つはⅡ型コラーゲンです。このⅡ型コラーゲン遺伝子に変異が生じると、骨系統疾患の一つであるⅡ型コラーゲン異常症になります。Ⅱ型コラーゲン異常症は、患者さんから軟骨細胞を手に入れることが難しいため、そのメカニズムを解明することが困難です。
今回の研究では、妻木教授らはⅡ型コラーゲン異常症の患者さんの線維芽細胞をダイレクトリプログラミングにより軟骨細胞へと誘導しました(iChon細胞)。Ⅱ型コラーゲン異常症のiChon細胞はⅡ型コラーゲン遺伝子の発現が低く、アポトーシス注4が顕著に起きていました。小胞体の膨張が検出され、遺伝子発現の低下やアポトーシスは小胞体ストレスによって引き起こされたものと示唆されました。軟骨形成を促進する薬剤でⅡ型コラーゲン遺伝子の発現を上昇させると、逆に軟骨形成が抑えられてしまい、病態を悪化させました。小胞体ストレスを軽減させる作用を持つシャペロン化合物注5がⅡ型コラーゲンの分泌を増加させ、Ⅱ型コラーゲン異常症由来のiChon細胞のアポトーシスを一部軽減したため、シャペロン化合物が薬剤候補となりうることが示されました。次に妻木教授らはⅡ型コラーゲン異常症の患者さんからiPS細胞を作製し、さらに軟骨細胞へと分化させました。患者さん由来の軟骨細胞はアポトーシスを起こし、小胞体ストレスマーカー遺伝子の発現が上昇していました。最後に妻木教授らはⅡ型コラーゲン異常症由来のiPS細胞を免疫不全マウスに移植することで、奇形腫注6を作りました。奇形腫内の軟骨組織ではⅡ型コラーゲンが細胞の小胞体内に蓄積し、小胞体が膨張し、細胞外マトリックス注7は少なく、患者さんの軟骨組織を再現していました。これらのⅡ型コラーゲン異常症モデルは病態生理学的な研究や創薬スクリーニングに有用であると考えられます。
Ⅱ型コラーゲンは軟骨組織の細胞外マトリックスの主要な構成タンパク質で、軟骨細胞内の小胞体で合成された後、立体構造を形成した後細胞外へと分泌され、細胞外でさらに他の分子と高次の構造を形成します。近年の研究で、変異を持つコラーゲンはうまく立体構造を形成できず、小胞体に蓄積し、小胞体ストレスの引き金となっていることがわかっていました。
これまでⅡ型コラーゲン異常症の研究にはマウスのモデルが使われてきましたが、マウスとヒトとでは体のサイズや軟骨への負荷の程度が異なるので、マウスの結果をヒトへと応用するのが困難でした。これまでに妻木教授らはダイレクトリプログラミングによって皮膚線維芽細胞を軟骨細胞へと直接変換する方法を明らかにしています(J Clin Invest, 2011; PLOS ONE, 2013)。そこで妻木教授らはダイレクトリプログラミング技術を使った方法で新たな疾患モデル系の構築を試みました。
1)患者さんの細胞からダイレクトリプログラミングで作製したiChon細胞では小胞体ストレスが生じていた
Ⅱ型コラーゲン異常症の患者さんから採取した線維芽細胞をiChon細胞へと直接誘導したところ、患者さんの細胞では正常な人の細胞と比較してうまく軟骨組織が作られないことがわかりました。さらに細胞のアポトーシスをTUNEL法注8で調べたところ、患者さん由来の細胞ではアポトーシスが過度に生じていることが明らかになりました(Fig. 1)。また細胞内の遺伝子発現や電子顕微鏡での観察から、患者さんの細胞内では小胞体ストレスが生じており、それが引き金となって細胞のアポトーシスが起きていることが明らかになりました。また、軟骨形成を促進する薬剤でⅡ型コラーゲン遺伝子の発現を上昇させると、逆に軟骨形成が抑えられてしまい、病態を悪化させることがわかりました。一方、小胞体ストレスを軽減させる効果があると知られているシャペロン化合物の一種TMAO(trimethylamine N-oxide)を患者さんから作製したiChon細胞に作用させると、アポトーシスを起こす細胞の割合が低くなりました。これはTMAOが、正しく立体構造が形成されていないⅡ型コラーゲンを安定化させ、Ⅱ型コラーゲン分子の小胞体への蓄積を防いで細胞外への分泌を促進したために、アポトーシスが軽減したと考えられます。
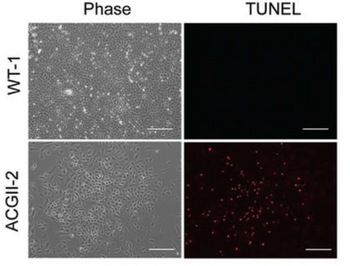
Fig. 1 患者さん由来のiChon細胞はアポトーシスを起こしていた
WT-1:健常な人由来、ACGII-2:患者さん由来
Phase:顕微鏡観察像、TUNEL:染色像
(アポトーシスを起こした細胞が赤く光る)
2)患者さんの皮膚線維芽細胞から作ったiPS細胞を分化誘導させてできた軟骨細胞でも、同様に小胞体ストレスが生じた
Ⅱ型コラーゲン異常症の患者さんの皮膚線維芽細胞からiPS細胞を作製し、さらに軟骨細胞へと分化させました。患者さん由来の軟骨細胞はアポトーシスを起こし、小胞体ストレスマーカー遺伝子の発現が上昇していました。iPS細胞を免疫不全マウスに移植すると、体の各組織を含む奇形腫ができます。患者さん由来iPS細胞からできた奇形腫に含まれる軟骨組織は、Ⅱ型コラーゲンが細胞内に蓄積し、細胞外マトリックス注7は減少していました(Fig. 2 左)。電子顕微鏡写真からは、小胞体が膨張していることが分かりました(Fig. 2 右)。
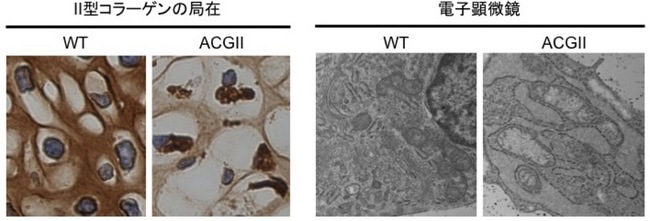
Fig. 2 患者さん由来の軟骨細胞ではⅡ型コラーゲンの局在と電子顕微鏡像
左:Ⅱ型コラーゲンの免疫染色
(Ⅱ型コラーゲンが茶色に見える)
右:電子顕微鏡観察像
WT:健常な人由来
ACGII:患者さん由来
今回、3つのアプローチでⅡ型コラーゲン異常症の疾患モデルを構築しました。1つは患者さんの線維芽細胞からiChon細胞を直接誘導する方法、2つ目は患者さんの線維芽細胞からiPS細胞を樹立し、さらに軟骨細胞へと誘導する方法、最後に患者さんから樹立したiPS細胞をマウスに移植し、軟骨を含む奇形腫を形成させる方法です。Ⅱ型コラーゲンの小胞体への蓄積やアポトーシス、細胞外マトリックスの異常など、患者さんの体内で見られるような現象が、これら疾患モデルで確認できました。これらの手法を用いることで、他の骨系統疾患についても研究が加速されると期待されます。
- 論文名
Modeling type II collagenopathy skeletal dysplasia by directed conversion and induced pluripotent stem cells - ジャーナル名
Human Molecular Genetics - 著者
Minoru Okada1, Shiro Ikegawa2, Miho Morioka1, Akihiro Yamashita1, Atsushi Saito3, Hideaki Sawai4, Jun Murotsuki5, Hirofumi Ohashi6, Toshio Okamoto7, Gen Nishimura8, Kazunori Imaizumi3 and Noriyuki Tsumaki1,9,* - 著者の所属機関
- 京都大学iPS細胞研究所
- 理化学研究所 統合生命医科学研究センター
- 広島大学大学院 医歯薬保健学研究科
- 兵庫医科大学
- 東北大学大学院 医学研究科・宮城県立こども病院
- 埼玉県立小児医療センター
- 旭川医科大学
- 東京都立小児総合医療センター
- 科学技術振興機構 CREST
本研究は、下記機関より支援を受けて実施されました。
- 科学技術振興機構 CREST
- 文部科学省 科学研究費補助金 「基盤研究B」「若手研究B」
- 科学技術振興機構 再生医療実現拠点ネットワークプログラム 疾患・組織別実用化研究拠点
注1)Ⅱ型コラーゲン異常症(Type II collagenopathy)
Ⅱ型コラーゲンの遺伝子の遺伝子変異によって、正常に軟骨が作られず、低身長になる。中でも軟骨無発生症(Achondrogenesis type Ⅱ: ACGⅡ)と軟骨低発生症(Hypochondrogenesis : HCG)は致死性の重篤な疾患。
注2)ダイレクトリプログラミング
体細胞からiPS細胞などの多能性幹細胞を経ることなく直接目的の分化細胞へと誘導する手法。
注3)小胞体ストレス
細胞内でタンパク質の工場として機能しているのが小胞体。1本のアミノ酸鎖として合成されたタンパク質は小胞体の中で立体構造をつくる(フォールディングする)が、うまくフォールディングしたものが小胞体外へと輸送され、機能するようになる。フォールディングができていないタンパク質は正しくフォールディングされるまで小胞体内に留められるか、あるいは失敗作として分解されてしまう。何らかの原因で小胞体内に留められるタンパク質が過剰になった状態を小胞体ストレスと言い、この状態を回避するために小胞体内のタンパク質量を減らす様々な応答(小胞体ストレス応答)がおきる。過度なストレスがかかったときには、最終的にはアポトーシスを起こし、細胞そのものを除去する。
注4)アポトーシス(プログラム細胞死)
細胞が自ら積極的に起こす細胞死。身体の形を作るときや個体を維持するためなど、様々な場面で生じている。
注5)シャペロン化合物
フォールディングが完了していないタンパク質に作用して、正しくフォールディングするのを助けるタンパク質のことをシャペロンという。また、同様の働きをする化合物のことをシャペロン化合物と呼ぶ。シャペロンは小胞体ストレスを軽減する効果がある。
注6)奇形腫(テラトーマ)
ES細胞やiPS細胞を免疫不全マウスの皮下などに注射すると、腫瘍を形成する。この腫瘍は奇形腫と呼ばれ、様々な種類の組織が混在している。奇形腫を観察し、様々な組織に分化していることを確認することは、細胞の分化多能性を調べる一般的な方法の一つである。
注7)細胞外マトリックス
細胞の外に存在する生体高分子>(コラーゲンやプロテオグリカンなど)の集合体。骨・軟骨、歯、皮膚などに多く含まれ、組織を支えてメカニカル(クッション・伸び縮みなど)な機能を果たしている。Ⅱ型コラーゲンは小胞体でフォールディング(折りたたみ)を受けた後、小胞体外からさらには細胞外へ分泌され、細胞外で他のマトリックス分子とともに高次構造を作り、組織を支えている。体重を支えるために、軟骨細胞は大量のⅡ型コラーゲンを作って細胞外へと分泌している。Ⅱ型コラーゲン遺伝子に変異があると、Ⅱ型コラーゲンがうまく折りたたまれず、小胞体の内部に蓄積してしまい、過剰な小胞体ストレスを引き起こすことになる。
注8)TUNEL(TdT-mediated dUTP nick end labeling)法
細胞のアポトーシスを検出するために使われる一般的な方法。アポトーシス細胞ではDNAに切れ目が入り、ヒドロキシル基が遊離しているDNAが多く見られる。そのヒドロキシル基を目印に標識を付けてアポトーシスを起こした細胞を染色する方法。この実験ではアポトーシスを起こした細胞が赤く光る。






















