
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2015年12月1日
FOP変異型受容体を介して、アクチビンAがBMPシグナルを活性化する〜FOPの異所性骨形成における新たなメカニズムを発見〜
日野 恭介 共同研究員(京都大学CiRA/大日本住友製薬株式会社 先端創薬研究所)、池谷 真 准教授(京都大学CiRA)、戸口田 淳也 教授(京都大学CiRA/再生医科学研究所/医学研究科)らの研究グループは、FOP患者さんから作製したiPS細胞(FOP-iPS細胞)を分化させて作製したFOP患者さん由来細胞(FOP細胞)を用いて、本来別のシグナルを伝える分子であるアクチビンAが、FOP細胞ではBMPシグナルを異常に伝達し、骨軟骨形成を促進することを示しました。
この研究成果は2015年11月30日 (米国東部時間)に「Proceedings of the National Academy of Sciences(米国科学アカデミー紀要)」で公開されました。
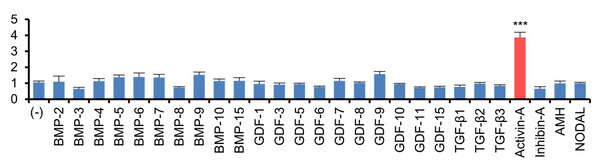
BMPに類似の構造をもつTGF-βスーパーファミリーのうち、アクチビンAで処理すると、FOP細胞のみでBMPシグナルが活性化することが分かりました。(mean±S.E., N=3-4, *** P<0.01)
2. アクチビンAにより、FOP細胞の軟骨形成が促進された
軟骨への分化におけるアクチビンAの影響を調べました。FOP-iMSCとresFOP--iMSCから2次元のマイクロマス培養法注8により軟骨を誘導し7日目に比較したところ、FOP細胞ではアクチビンA添加で、より大きな軟骨様組織が形成されました(図2)。また、この現象はアクチビンA阻害剤で抑えられ(図3)、アクチビンAの阻害がFOPにおける異所性骨化を抑える新たな治療ターゲットとなる可能性を示しました。
次に、軟骨の成熟度を確認するために、FOP-iMSCとresFOP-iMSCを3次元で塊(ペレット)にして培養し、軟骨を誘導しました。アクチビンAを添加した条件での誘導21日後には、FOP細胞でより成熟した軟骨細胞が見られました(図4)。また、FOP-iMSC由来軟骨組織では後期の軟骨マーカー(COL10A1、VEGFA、MMP13)の発現が高いことも確認しており、アクチビンAは軟骨成熟を促進することが分かりました。
さらに、これらの軟骨ペレットを免疫不全マウスの背に移植すると、4週間後、res-FOP細胞由来軟骨ペレットでは骨化がほぼ生じなかった(1/10匹)のに対して、FOP細胞由来軟骨ペレットでは高頻度に骨が形成されました(9/10匹)。これにより、これらの軟骨ペレットは生体内ではアクチビンA刺激なしでも骨化することが分かりました。
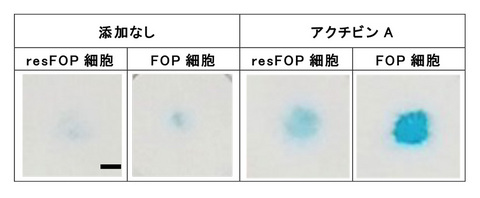 図2.FOP細胞およびresFOP細胞から分化誘導した軟骨様組織
図2.FOP細胞およびresFOP細胞から分化誘導した軟骨様組織FOP-iMSCとresFOP-iMSCから分化誘導7日後の軟骨様組織の様子を示しています。軟骨様組織のうち軟骨基質がアルシアン・ブルー染色にて青く染まっています。アクチビンAの添加により、resFOP-iMSCと比較してFOP-iMSCはよりも大きな軟骨様組織を形成しました。(スケールバー:200 µm)

アクチビンAによるFOP細胞の軟骨様組織形成は、アクチビンA阻害剤により抑制されました。(アルシアン・ブルー染色、スケールバー:200 µm)
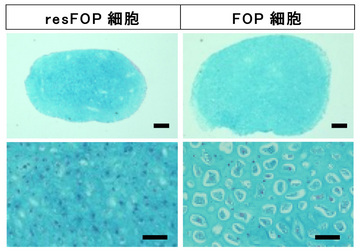
FOP-iMSCとresFOP-iMSCからアクチビンAを添加した条件下での分化誘導21日後の軟骨様組織の様子を示しています(アルシアン・ブルー染色)。FOP細胞では、細胞質が大きく成熟した軟骨細胞が観察されました。(スケールバー:上段200 µm、下段50 µm)
3. FOP-iPS細胞から作製した間葉系間質細胞を用いて、異所性骨形成モデルが作製できた
さらに、FOP-iMSCまたはresFOP-iMSCと、ドキシサイクリン誘導によりアクチビンAを発現する細胞を混合して、免疫不全マウスに移植しました。移植6週間後の観察で、ドキシサイクリンを用いてアクチビンAを誘導した場合にのみ、FOP細胞を移植した箇所に異所性骨の形成が認められました(図5)。
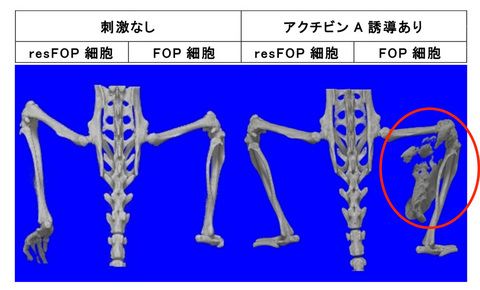
FOP細胞を移植しアクチビンAを誘導した場合のみ、異所性骨が形成されました。
4.まとめ
本研究では、FOP-iPS細胞を用いて、本来TGF-βシグナルを伝える分子であるアクチビンAがFOP細胞ではBMPシグナルを伝え、骨軟骨形成を促進することを明らかにし、このメカニズムがFOPにおける異所性骨化形成に大きく寄与している可能性を示しました。またこの結果は、アクチビンA阻害剤がFOP治療薬の候補となる可能性を示唆します。
さらにFOP-iPS細胞から作製した間葉系間質細胞を、アクチビンA発現細胞と共に免疫不全マウスに移植することで、FOP患者由来細胞を用いた異所性骨形成モデルの作製に世界で初めて成功しました。このモデルを用いることで、FOPに対する薬剤の効果を生体で検証することが可能となり、治療薬のスクリーニングに役立つことが期待されます。
5. 論文名、著者およびその所属
"Neofunction of ACVR1 in fibrodysplasia ossificans progressiva"
Proceedings of the National Academy of Sciences
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
・日本学術振興会 科学研究費補助金
・文部科学省「再生医療の実現化プロジェクト」
・JST 再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞を活用した難病研究」
・AMED 再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞を活用した難病研究」
・JST 研究成果展開事業 研究成果最適展開支援プログラム「A-STEP」
・iPS細胞研究基金
7. 用語説明
注1) アクチビンA
TGF-β(Transforming Growth Factor β; トランスフォーミング増殖因子β)ファミリーに属するタンパク質で、細胞増殖や分化など多くの生理機能を調節する作用を持つ。
注2) BMP(Bone Morphogenetic Protein; 骨形成因子)
骨組織や軟骨の分化を誘導、促進するタンパク質。TGF-βスーパーファミリー注7に属する。
注3) 間葉系間質細胞(Mesenchymal Stromal Cells)
骨・軟骨・脂肪細胞などといった間葉系の細胞に分化する能力を持った間質(結合組織)の細胞。本報では、iPS細胞から作製したものをiMSC(induced Mesenchymal Stromal Cell)としている。
注4) ACVR1(Activin receptor type-1)
BMP受容体の一部を構成するタンパク質で、BMPと結合することにより骨形成のシグナルを伝達する。アクチビンAとは、結合はするがシグナルは伝えないことが知られていた。FOPではACVR1遺伝子の変異により、ACVR1タンパク質の206番目のアルギニンがヒスチジンに変化し、アクチビンAとの結合で本来伝えないはずのBMPシグナルを伝えていた。
注5) resFOP-iPS細胞
FOP患者さんから作製した疾患iPS細胞のゲノム中の原因変異を修復した細胞。このresFOP‐iPS細胞は、修復した変異以外は、もとの患者さん由来iPS細胞と、同じ遺伝情報を持っているため、FOP変異やそれに関連する病気のメカニズムを調べる上で、より厳密な対照細胞となる。
注6) リガンド
特定の受容体に特異的に結合する物質。
注7) TGF-βスーパーファミリー
TGF-β、BMP、アクチビンなど構造上類似した因子で構成される集合体の総称。スーパーファミリーには他に、免疫グロブリンスーパーファミリー、核ホルモン受容体スーパーファミリーなどが存在する。
注8) マイクロマス培養法
細胞を高濃度で調製し、培養皿上に滴状に播種することで作製される高密度の細胞塊をマイクロマスと呼び、その状態で培養する方法をマイクロマス培養法と呼ぶ。軟骨分化の際に用いられる。






















