
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2016年3月18日
iPS細胞を用いた新たな腫瘍モデルにより、 肉腫形成メカニズムの一端を解明
・がん遺伝子EWS-FLI1の発現により増殖する細胞を用いて肉腫モデルマウスを作製した
・肉腫モデルマウスの腫瘍細胞からiPS細胞を作製した
・肉腫形成には、EWS-FLI1の発現に加え、骨分化の阻害が重要な役割を果たしていることが分かった
河村 真吾 大学院生(京都大学CiRA/岐阜大学 大学院医学系研究科)、山田 泰広 教授(京都大学CiRA/iCeMS)らの研究グループは、ドキシサイクリン(Dox)注1誘導型EWS-FLI1注2発現システムを用いて、EWS-FLI1の遺伝子発現が調節可能な肉腫モデルマウスを作製しました。さらにマウスの肉腫から作製したiPS細胞を用いることにより、EWS-FLI1遺伝子の発現に加え、成熟した骨への分化の阻害が肉腫形成に重要な役割を果たしていることを見出しました。今後、このようながん化モデルを用いて、抗がん剤の開発に貢献することが期待されます。
この研究成果は2016年3月17日正午(米国東部時間)に米国科学誌「Stem Cell Reports」で公開されました。
肉腫は骨や筋肉に発生するがんで、患者さんが少ないために発生メカニズムの研究や治療法の開発が遅れています。中でも、ユーイング肉腫ファミリー腫瘍(ESFT)注3は、小児~青年期に発症し、難治性の症例が多く見られます。ESFTの原因はEWS-FLI1融合遺伝子であることが知られていますが、この遺伝子をマウスやヒトの細胞に導入しても、肉腫は再現できないことから、腫瘍形成には他の要素が必要であることが示唆されていました。これまでに、EWS-FLI1の他、いくつかの遺伝子変異がESFTに関与していると報告されていますが、これらの変異が腫瘍の直接の原因になるのかを含め、どのように肉腫形成に寄与しているかは分かっていませんでした。
そこで、山田教授らの研究グループは、ドキシサイクリン(Dox)によりEWS-FLI1遺伝子の発現を調節できる肉腫モデルをマウス骨髄間質細胞注4から作製し、EWS-FLI1の発現と抑制を切り替えることで、EWS-FLI1以外に肉腫形成に必要な異常を見出すことを検討しました。また、通常困難とされる、がん細胞からのiPS細胞作製を試み、これらのiPS細胞をがんが生じる細胞(骨)に分化させることで、腫瘍形成のメカニズムを調べました。
1. EWS-FLI1の発現により増殖する細胞は、生体内で肉腫を形成した
DoxによりEWS-FLI1遺伝子の発現を誘導できるモデルマウスを作製したところ、EWS-FLI1を全身で発現させても腫瘍は見られませんでした。これは、EWS-FLI1の発現のみでは肉腫が形成しないことを示します。
次に、研究グループはEWS-FLI1による肉腫の発生には、他の遺伝子変異が必要だと考え、レンチウイルスを用いて、ゲノムにランダムに傷をつけて、EWS-FLI1を発現する細胞モデルの作製を試みました。Dox誘導システムを持つマウスから、肉腫の発生起源細胞と考えられている骨髄間質細胞を取り出し、EWS-FLI1遺伝子を導入し、Dox条件下で2か月培養したところ、EWS-FLI1を持つ細胞株のほとんどは死滅しましたが、生き残る細胞株が得られました(図1、EWS-FLI1依存性細胞)。その細胞ではDox誘導によりEWS-FLI1の発現が見られ、細胞は増殖しましたが、Doxを除去すると形が扁平になり、細胞の増殖も阻害されました(図2)。
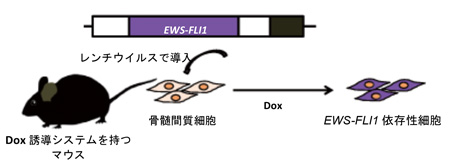
図1. Dox誘導によりEWS-FLI1を発現して増殖する細胞の作製
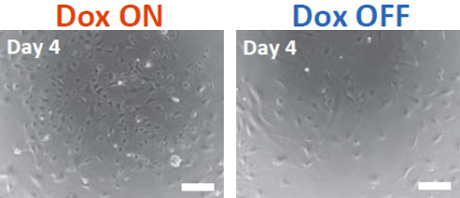
図2. EWS-FLI1依存性細胞のDox誘導
Dox ON: DoxによりEWS-FLI1が発現している細胞
Dox OFF: Doxが無く、EWS-FLI1の発現を止めた細胞 (Dox除去後4日目)
(スケールバー: 200 µm)
EWS-FLI1の発現により増殖する細胞(EWS-FLI1依存性細胞)が、生体内で腫瘍原性があるのかを確認するため、免疫不全マウスの皮下に移植しました。Doxを投与したマウスでは、腫瘍形成が見られましたが、Doxを投与しないマウスでは腫瘍形成は見られませんでした(図3)。腫瘍は、ユーイング肉腫に似た小細胞型骨肉腫注5で、骨形成が見られました。腫瘍細胞はEWS-FLI1を発現し、増殖マーカーも見られました。
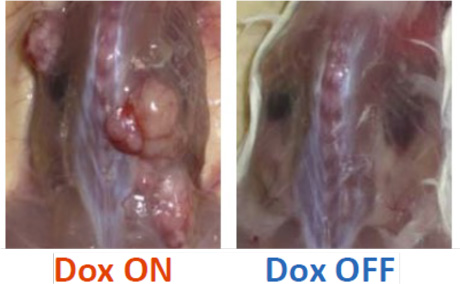
図3. EWS-FLI1依存性細胞の腫瘍原性(移植後10週間)
Dox ON: Doxを投与したマウス
Dox OFF: Doxを投与していないマウス
2. EWS-FLI1の発現が肉腫細胞の骨分化を阻害した
EWS-FLI1の発現により発生する肉腫の特性をさらに調べるため、上記のマウスに形成された腫瘍から肉腫細胞を取り出して、EWS-FLI1依存性肉腫細胞株を作製しました。この肉腫細胞株の遺伝子発現パターンを解析すると、ユーイング肉腫、および骨肉腫に部分的に類似しており、どちらの特徴も併せ持つユーイング肉腫ファミリー腫瘍(ESFT)であることが示唆されました。
元のEWS-FLI1依存性細胞と同様に、作製された肉腫細胞株もDox濃度依存的にEWS-FLI1を発現し、Dox存在下では増殖しました。Doxを除去し、EWS-FLI1の発現を停止させると細胞形態が変わって骨分化が促進され(図4)、細胞増殖は停止しましたが、再びDoxを与えると増殖が戻りました。次に、EWS-FLI1を発現している肉腫細胞(Dox ON)と、発現していない肉腫細胞(Dox OFF)の遺伝子発現を比較しました。すると、Dox OFF(EWS-FLI1発現なし)の条件下の肉腫細胞では骨・軟骨形成に関与する遺伝子の発現が有意に高いことが分かりました。
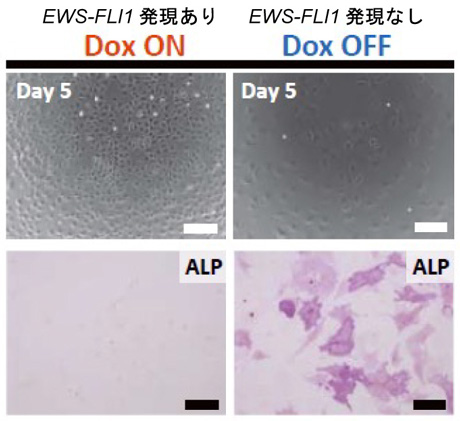
図4. アルカリフォスファターゼ染色による骨形成活性の確認
EWS-FLI1の発現を抑制すると、肉腫細胞の骨分化が促進された。(Dox除去後5日目)
(スケールバー:上段 50 µm, 下段 200 µm)
次に、EWS-FLI1依存性肉腫細胞を免疫不全マウスに移植すると、Dox存在下で小細胞型骨肉腫を形成しました。DoxによるEWS-FLI1の誘導を止める(Dox OFF)にすると腫瘍の増殖は停止または低下しましたが、腫瘍は骨のように固くなりました(図5)。よって、EWS-FLI1の発現が生体外/生体内において肉腫細胞の骨分化を阻害しており、EWS-FLI1発現を抑えると、肉腫細胞の骨分化が促進され、成熟した骨が形成されることが分かりました。
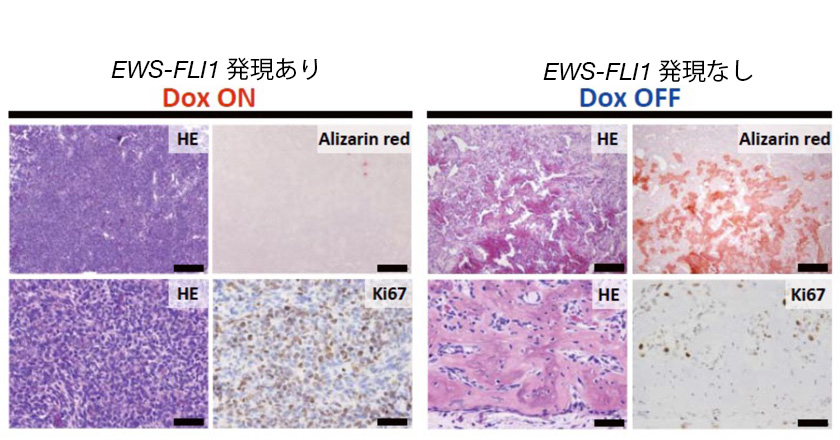
図5. EWS-FLI1依存性肉腫細胞の骨分化
HE:腫瘍細胞が青色に染まる。Alizarin red:骨形成を赤色で示す。Ki67:増殖細胞が赤色に染まる。
Doxの誘導を止めると、青色の腫瘍細胞が減り、骨の形成が見られた。
腫瘍細胞に見られていた増殖マーカーも減少した。
(スケールバー:上段 50 µm, 下段 200 µm)
3. EWS-FLI1誘導型肉腫細胞からiPS細胞を作製し、腫瘍の発生を再現できた
iPS細胞はゲノムの変異を保ったまま、細胞の変化を観察できることから、EWS-FLI1発現以外の遺伝子異常が腫瘍形成に及ぼす影響を調べるため、肉腫細胞からiPS細胞の作製を試みました。EWS-FLI1依存性肉腫細胞にOCT3/4, SOX2, KLF4, cMYC遺伝子を導入し、EWS-FLI1発現が無い条件下(Dox OFF)で、iPS細胞の作製に成功しました。
次に、肉腫の起源細胞と推定される骨前駆細胞を、EWS-FLI1発現なし(Dox OFF)でiPS細胞から誘導したところ、コントロールiPS細胞/ES細胞は、Runx2, Sp7, Colla1, Pth1r, Dmplなど初期から後期に渡る骨分化関連遺伝子の発現が誘導17日目で見られました。一方、EWS-FLI1依存性肉腫iPS細胞でも、初期の骨分化関連遺伝子であるRunx2の発現が誘導されましたが、後期の骨分化に関連する遺伝子の発現は阻害されていました。さらに、骨分化を28日目まで延長すると、骨の成熟を示す石灰化した領域が全てのサンプルで見られましたが、その面積は肉腫iPS細胞に対してコントロールES細胞/iPS細胞で大きいことが分かりました(図6)。この結果から、肉腫iPS細胞では、EWS-FLI1発現とは関係なく、骨分化が阻害されており、EWS-FLI1とは別の変異が骨分化を阻害し、増殖する前駆細胞の状態を維持していることが分かりました。
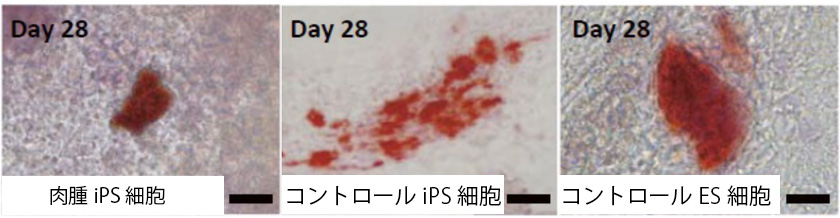
図6. EWS-FLI1発現がない条件下での肉腫iPS細胞からの骨誘導(骨誘導28日後)
アリザリン・レッド染色(赤色)により骨の石灰化を示す。
肉腫iPS細胞では骨分化が阻害された。
(スケールバー:20 µm)
さらに、EWS-FLI1の発現と、他の遺伝子異常に帰する骨分化の異常がどのように影響しあっているのかを解析しました。肉腫iPS細胞は、未分化な状態では、EWS-FLI1を発現させても増殖がより活性化されることはありませんでしたが、骨前駆細胞に分化してからDox添加によりEWS-FLI1発現をさせた(図7)ところ、増殖活性を示しました。この増殖が活性化された細胞をマウスに移植し、マウスにDoxを投与してEWS-FLI1を誘導すると、腫瘍が発生しました(図8)。これらの結果により、遺伝子変異により骨分化に異常が見られる状態で、EWS-FLI1が発現すると腫瘍が形成されることが示唆されました。
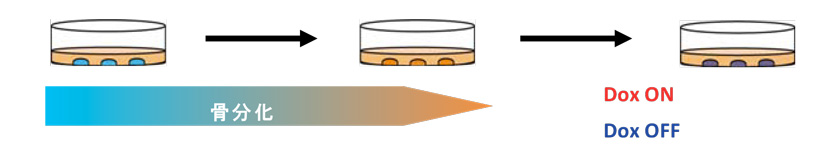
図7. 骨分化とEWS-FLI1の誘導
骨分化17日後にDoxによるEWS-FLI1発現のあり/無しで、2週間培養した。
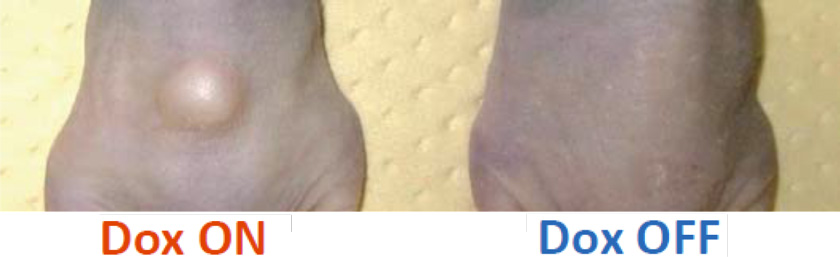
図8. EWS-FLI1依存性肉腫iPS細胞由来増殖細胞の腫瘍原性(移植後3~7週間)
肉腫iPS細胞由来増殖細胞を免疫不全マウスに移植すると、Dox投与したときのみ腫瘍を形成した。
本研究では、肉腫モデルマウスのがん細胞からiPS細胞を作製し、起始細胞(骨)に分化させることで、がん化を再現することに成功しました。また、がん化の過程を調べることで、成熟した骨への分化の阻害ががん化に重要な役割を果たしていることを見出しました。今後、このようなiPS細胞を用いたがん化モデルは、細胞分化の異常を標的とした抗がん剤の開発に貢献することが期待されます。
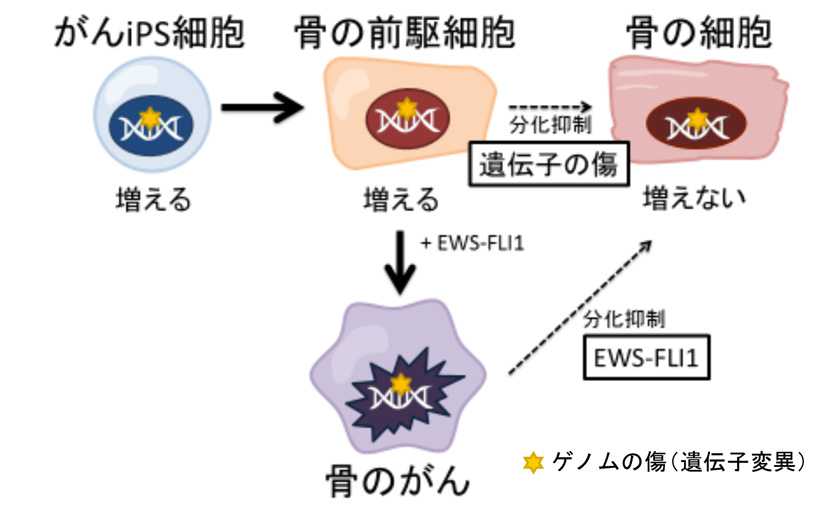
図9. 本研究のまとめ
通常のゲノム(正常な遺伝子背景)をもつ骨前駆細胞にEWS-FLI1を発現させても、肉腫(骨のがん)にはならない。ゲノムに傷がついた状態でEWS-FLI1を発現させると肉腫になる。肉腫の出現には、EWS-FLI1の発現に加えて、 ゲノムの傷が影響していることを示している。
ガンのゲノムでは、①EWS-FLI1により骨分化が阻害される、②ゲノムの異常により骨に分化し難い、の2つの異常により、未分化状態が維持され、腫瘍が形成される。
通常のゲノム(正常な遺伝子背景)をもつ骨前駆細胞にEWS-FLI1を発現させても、肉腫(骨のがん)にはならない。ゲノムに傷がついた状態でEWS-FLI1を発現させると肉腫になる。肉腫の出現には、EWS-FLI1の発現に加えて、 ゲノムの傷が影響していることを示している。
ガンのゲノムでは、①EWS-FLI1により骨分化が阻害される、②ゲノムの異常により骨に分化し難い、の2つの異常により、未分化状態が維持され、腫瘍が形成される。
"EWS-FLI1-induced osteosarcoma model unveiled a crucial role of impaired osteogenic differentiation on osteosarcoma development"
Stem Cell Reports
(*責任著者)
著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 岐阜大学 大学院医学系研究科
- 京都大学 物質‐細胞統合システム拠点(iCeMS)
- 京都大学 白眉センター
- AMED-CREST
本研究は、下記機関より資金的支援を受けて実施されました。
- ・AMED 次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)
- ・厚生労働省 厚生労働科学研究費補助金
- ・武田科学振興財団
- ・内藤記念科学振興財団
注1) ドキシサイクリン(Doxycycline:Dox)
抗生物質の一種。遺伝子工学ではこの物質に反応して遺伝子のオン/オフを制御する仕組みがよく用いられている。本研究では、ドキシサイクリンが取り込まれると、がん遺伝子EWS-FLI1が作られるように遺伝子を操作した細胞を作製し利用している。
注2) EWS-FLI1融合遺伝子
EWS遺伝子のN末端トランスアクチベータードメインとFLI1遺伝子のC末端ETS DNA結合領域からなる。この融合遺伝子からできるEWS-FLI1融合タンパク質は、転写因子として働き、翻訳の活性/抑制、クロマチン調節、スプライシング調節など、様々な機能をもつ。
注3) ユーイング肉腫ファミリー腫瘍(Ewing's sarcoma of family tumors:ESFT)
小児に発症する骨の腫瘍の中で2番目に多いユーイング肉腫を含む類似の腫瘍。EWSとFLI1という2つのタンパクの一部が結合した、融合タンパク質であるEWS-FLI1が、ユーイング肉腫の80~90%で見つかっており、EWS-FLI1が原因遺伝子と考えられている。
注4) 骨髄間質細胞
骨髄は、赤血球や白血球などになる造血系の細胞と、それを取り囲む骨髄間質細胞から成っている。骨髄間質細胞には、間葉系組織(血管,筋肉,脂肪,骨,軟骨など)に分化する細胞が含まれる。
注5) 小細胞型骨肉腫
骨肉腫は骨の悪性腫瘍のなかでも最も多く見られるが、小細胞型骨肉腫は、まれな骨肉腫のタイプでる。小細胞型骨肉腫の一部にはEWS融合遺伝子が検出される。






















