ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2016年4月18日
iPS細胞を用いた腸の元となる細胞への誘導方法を発見
ポイント
- 胚体内胚葉注1には3つのサブタイプが存在する。
- 前方の胚体内胚葉はさらに前方と後方の領域に分けることができる。
- iPS細胞より後期の前方原始線条注2の作製に初めて成功し、そこから後方の胚体内胚葉の誘導法を確立した。
- 3つのタイプの胚体内胚葉はそれぞれ前方前腸注3、後方前腸注4、中後腸注5に分化する能力を有する。
iPS細胞から胚体内胚葉を誘導する方法は複数報告されていますが、異なる誘導因子処理で誘導した胚体内胚葉細胞の性質、分化指向性の差異についてはよく分かっていませんでした。松野 邦彦 大学院生(CiRA/日本医科大学消化器外科・移植外科)、長船 健二 教授(CiRA)らの研究グループは、異なる誘導法で作製される胚体内胚葉は異なる性質を持つことを明らかにしました。早期の前方原始線条より2種類の前方の胚体内胚葉が誘導できることを示し、それぞれ誘導因子なしに前方前腸と後方前腸に分化する能力を持つことも明らかにしました。また、後期の前方原始線条の誘導法を新規に確立し、そこから誘導因子なしに中後腸への分化能力を持つ後方の胚体内胚葉を誘導しました。
この誘導法を利用することにより肺、肝臓、膵臓、腸など各種内胚葉系細胞の作製においてより安定した分化誘導系の開発が期待されます。
この研究成果は、2016年4月14日に英科学誌「Differentiation」で公開されました。
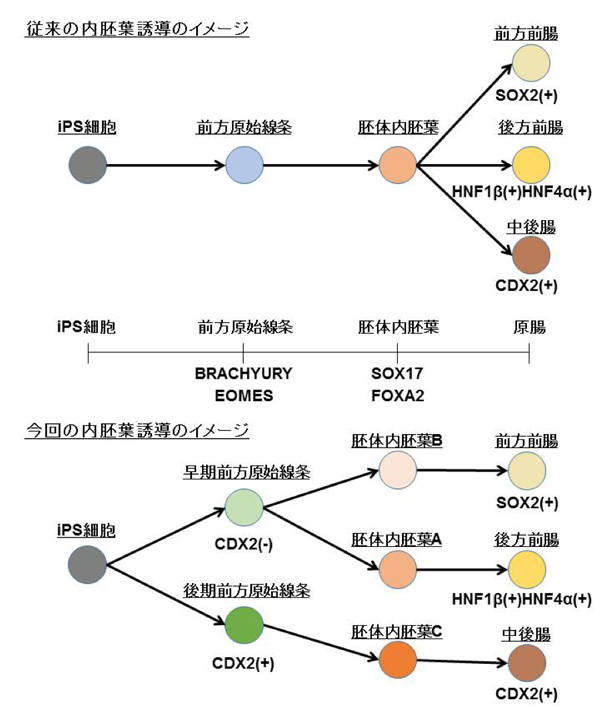
胚体内胚葉は、ヒトiPS細胞から内胚葉系細胞を誘導するための最初のステップとされています。そして、胚体内胚葉より様々な誘導因子を用いて各種内胚葉系細胞(肺、肝臓、膵臓、胃や腸を含む消化管など)へ分化誘導されています。胚体内胚葉を誘導する方法は複数報告されています。しかし、それぞれの方法での胚体内胚葉マーカーであるSOX17, FOXA2を指標とした胚体内胚葉誘導効率については論じられていますが、異なる誘導因子処理で作製される胚体内胚葉細胞の性質、分化指向性の差異についてはよく分かっていませんでした。そこで、長船教授らの研究グループは、異なる方法で誘導した胚体内胚葉の分化能力を検証し、胚体内胚葉にサブタイプが存在し細分類可能かどうかを調べました。
3.1 ) 異なる分化誘導法で作製される胚体内胚葉は異なるタイプの内胚葉細胞である
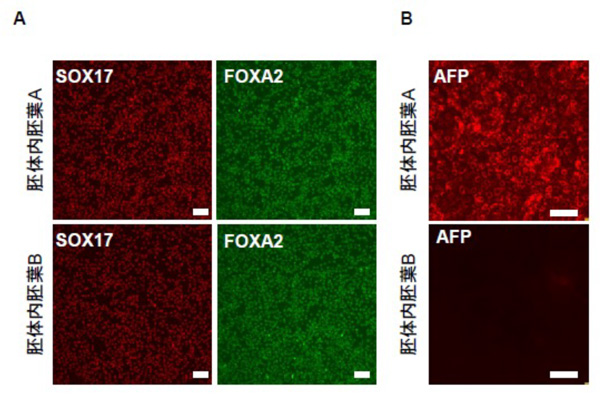
胚体内胚葉はヒトiPS細胞より前方原始線条を経て誘導されます。研究グループは、同一の方法で誘導した前方原始線条よりActivin A(細胞成長因子の一つ)のみで誘導した胚体内胚葉AとActivin AとBMP(bone morphogenetic protein; 骨形成因子)阻害剤の両者で誘導した胚体内胚葉Bは、いずれも胚体内胚葉マーカーである SOX17、FOXA2 が共陽性であることを確認しました (Fig.1A)。この2つの内胚葉より既報の肝臓への誘導法を付加したところ、胚体内胚葉Aでは肝芽細胞マーカーであるAFPの発現を認めましたが、胚体内胚葉BではAFPの発現を認めませんでした (Fig.1B)。 この結果は、異なる分化誘導法で作製される胚体内胚葉AとBは分化能力が異なることを示しています。
(Figure. 1A, B)
3.2 ) 胚体内胚葉Aは後方前腸、胚体内胚葉Bは前方前腸へ分化する能力がある
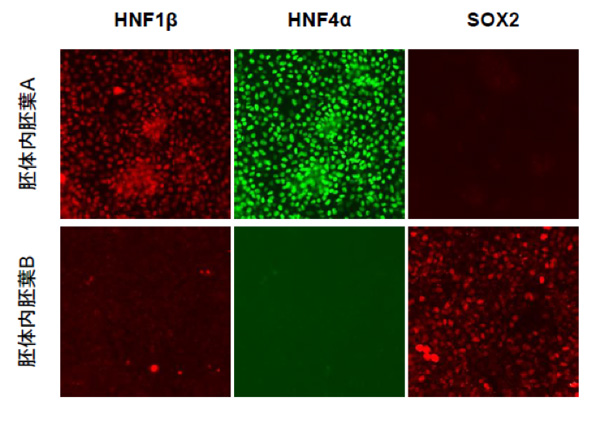
次に胚体内胚葉A, B の分化能力の違いを検証するために、胚体内胚葉A, Bを誘導因子なしで培養しました。その結果、胚体内胚葉Aは後方前腸マーカーであるHNF4α, HNF1βの発現を認め、胚体内胚葉Bは前方前腸マーカーであるSOX2の発現を認めました (Fig. 2) 。胚体内胚葉A, B は誘導因子なしでも自発的に後方前腸と前方前腸に分化する能力を有することが確認されました。
(Figure. 2)
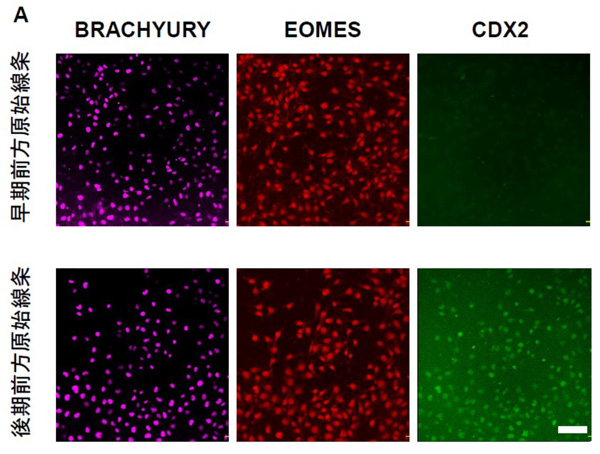
3.3 ) 中後腸となる後方の胚体内胚葉は後期の前方原始線条より誘導される
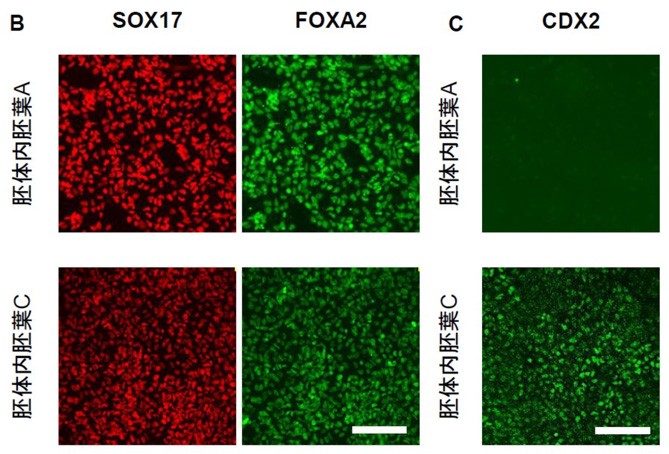
中胚葉領域では、後方の中胚葉は後期の原始線条から発生するとの報告があり、中後腸となる胚体内胚葉も後期の前方原始線条より発生することが考えられました。そして、Activin Aと高濃度のCHIR99021の両者による新規の分化誘導法を開発し原始線条を作製したところ、原始線条マーカーであるBRACHYURY 、前方原始線条マーカーであるEOMES、後期の原始線条マーカーであるCDX2の発現を認め、後期の前方原始線条を誘導できることを見出しました (Fig.3A)。 さらに、後期の前方原始線条よりActivin A 処理のみで胚体内胚葉 C を誘導したところ、SOX17、FOXA2 が共に陽性であることを確認しました (Fig.3B)。胚体内胚葉C の分化能力を調べるために3.2) と同様に誘導因子なしで培養したところ中後腸マーカーであるCDX2の発現を認めました (Fig.3C)。この結果は、胚体内胚葉C は自発的に中後腸へ分化する能力を有することを示しています。
(Figure. 3A)
(Figure. 3B, C)
本研究では、現在SOX17とFOXA2 の2つのマーカーで定義されている胚体内胚葉の細胞集団の中に3つのサブタイプがあることを示し、それらを作り分ける方法を初めて開発しました。また、今回誘導された胚体内胚葉A, B, C は、それぞれ自発的に後方前腸、前方前腸、中後腸へ分化する能力を有することがわかりました。今回の方法で胚体内胚葉を作り分け、その後に従来の誘導方法を組み合わせれば、より質の高い内胚葉系の臓器構成細胞の作製に貢献することが期待されます。
Redefining definitive endoderm subtypes by robust induction of human induced pluripotent stem cells
Differentiation
注1) 胚体内胚葉
発生の一時期に現れる細胞集団。肺、膵臓、肝臓、胃や腸を含む消化管などの内胚葉系の細胞に分化する。
注2) 原始線条
原条。哺乳類の発生過程で初期に現れる溝の様な構造。マウスの場合、発生開始から6〜7日目に見られ、この部分で細胞の形態が変化し、中胚葉や内胚葉の細胞のもとになる。
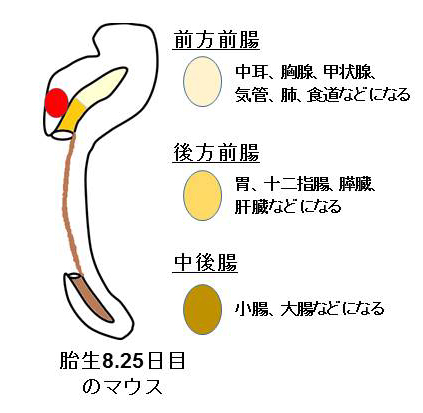
注3) 前方前腸
発生期の内胚葉由来の組織の1つ。将来、中耳、胸腺、甲状腺、気管、肺、食道などになる。
(マウス発生期の腸管の図参照)
注4) 後方前腸
発生期の内胚葉由来の組織の1つ。将来、胃、十二指腸、膵臓、肝臓などになる。
(マウス発生期の腸管の図参照)
注5) 中後腸
発生期の内胚葉由来の組織の1つ。将来、小腸、大腸などになる。(マウス発生期の腸管の図参照)
(マウス発生期の腸管の図)