
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2016年9月9日
iPS細胞を選択的に識別・分離・除去できるしくみを合成RNAを用いて構築
ポイント
- 生きたiPS細胞内でマイクロRNA注1活性を感知するメッセンジャーRNA注2を合成した。
- iPS細胞とそれ以外の細胞が混合した細胞集団の中から、iPS細胞を選択的に識別・分離でき、
生体内での奇形腫注3の形成を抑制できた。 - 薬剤応答を利用し、iPS細胞を特異的に除去することに成功した。
カラム・パー研究員、片山翔太元CiRA大学院生、齊藤博英教授(京都大学CiRA未来生命科学開拓部門)らの研究グループは、
iPS細胞を含む多能性幹細胞内で活性の高いマイクロRNA(miRNA)を感知するメッセンジャーRNA(mRNA)を合成し、細胞内に導入することで、
iPS細胞や部分的に分化したiPS細胞を特異的に識別・除去できるしくみを構築することに成功しました。
この研究成果は2016年9月9日(英国時間)に英国科学誌「Scientific Reports」でオンライン公開されました。
iPS細胞を含む多能性幹細胞は、体のほぼあらゆる細胞に変化(分化)することができ、その特性を利用して、再生医療や創薬研究が盛んに行われています。 しかし、多能性幹細胞が他の細胞へ分化する効率にはばらつきがあるため、分化細胞集団の中にiPS細胞が残ってしまっていたり、 完全に分化しきれていない細胞が混ざってしまったりすることがあります。例えば、iPS細胞から分化させた細胞を生体内に移植する場合、未分化なiPS細胞が混ざっていれば、 奇形腫の形成につながります。それを防ぐため、未分化なiPS細胞を識別した上で適切に除去し、完全に分化した細胞集団を得ることが重要です。 従来より、残存iPS細胞や部分的に分化したiPS細胞を識別・除去するために、iPS細胞の表面上にあるタンパク質(TRA-1-60など)に対する抗体がよく利用されていますが、 部分的に分化したiPS細胞を見分ける感度や、フローサイトメトリー注4で細胞を分離する際に、細胞を物理的に傷つけてしまうといった課題がありました。 そこで、齊藤教授らのグループは、試験管で合成したメッセンジャーRNA(mRNA)をiPS細胞に導入することにより、 iPS細胞に特異的に発現するmiRNAの活性を検知することでiPS細胞を精密に見分け、また、部分的に分化したiPS細胞をも識別・除去できる方法を開発しました。
1) iPS細胞を感度高く、選択的に識別・分離するmRNAを合成した
まず、グループはヒトiPS細胞を含む多能性幹細胞の目印(マーカー分子)として、多能性幹細胞特異的に活性の高いmiRNAである、miRNA-302に着目しました。
miRNA-302は、多能性の制御に関与していることが知られています。そして、細胞内のmiRNA-302の活性に応じて異なる反応を示すmRNAを合成しました。
具体的には、miRNA-302と相補的な配列と、その下流に蛍光タンパク質をコードする配列を含むmRNA(miR-302スイッチ)を合成しました。
このmRNAをiPS細胞内に導入すると、細胞内のmiRNA-302に応答して、蛍光タンパク質の発現が抑制され、蛍光は発しません。
一方で、miRNA-302の活性が低い他の細胞では、蛍光タンパク質が発現し、蛍光を発します。
両者の蛍光の有無により、iPS細胞とそれ以外の細胞を識別・分離することができます。
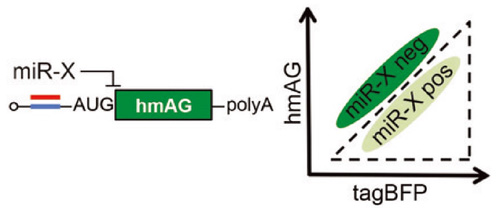
Fig. 1
合成したmRNA(左)と、miRNA活性の違いに基づく細胞分離のイメージ図(右)。
mRNAは、miRNA-X(赤)と相補的な配列(青)及び蛍光タンパク質をコードする配列(緑、hmAG)を含む。
このmRNAと別の蛍光タンパク質 (tagBFP)をコードする配列を含むmRNAを細胞に導入すると、miRNA活性が強い細胞集団(miR-X pos)と弱い細胞集団(miR-X neg)を生きたまま識別、
分離できる。右図はフローサイトメーターでこれら細胞を分離した例を示す。
グループは、iPS細胞にmiR-302aスイッチを導入し、ドパミン産生神経細胞へと分化させていく過程での細胞集団の性質を調べました。すると徐々に分化が進み、細胞集団の中でのiPS細胞の数が減っていく経時的な変化を観察することができました。従来の、TRA-1-60抗体により識別する手法と比較すると、感度が高く、分化の度合いが混在する集団の中でiPS細胞や分化が不完全な細胞を識別することができました。
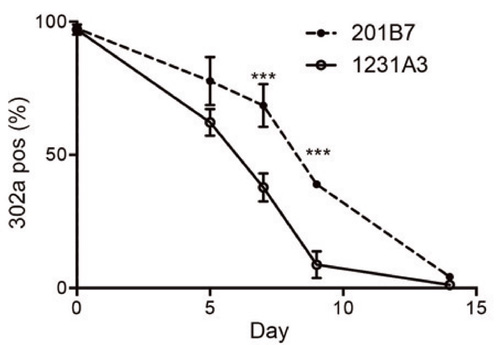
Fig. 2
ドパミン産生神経細胞への分化過程における残存iPS細胞の割合の経時的変化。
miRNA-302活性の高い細胞集団を定量することで、未分化iPS細胞及び部分的に分化した細胞を感度よく識別できる。201B7および1231A3はそれぞれiPS細胞株の名称。
2) 混合細胞集団からiPS細胞を選択的に除去し、奇形腫の形成を抑制できた
iPS細胞から分化させたドパミン産生神経細胞が80%、iPS細胞が20%混合している細胞集団を用意しました。
この細胞集団にmiR-302スイッチを導入し、強い蛍光を発しなかった細胞集団(iPS細胞と考えられる細胞集団)を分離・除去した上で、免疫不全マウス4匹の精巣に移植しました。
すると、3か月経っても奇形腫はいずれも形成されませんでした。一方、miR-302に応答しないmRNAを導入したコントロールでは、4匹全てにおいて、三胚葉をもつ奇形腫が形成されました。
この実験により、miRNAスイッチによりiPS細胞を分離・除去できたことで、奇形腫の形成を妨げられたことが示されました。
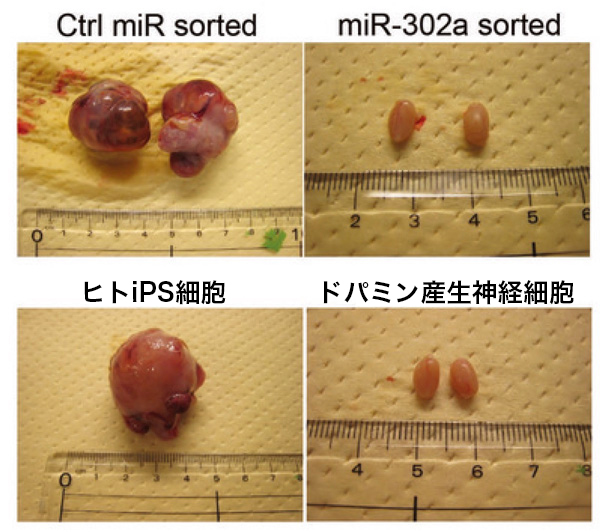
Fig. 3
miR-302スイッチによる奇形腫形成の抑制。miR-302に応答しないコントロールmRNAを導入し、
iPS細胞を除去できなかった細胞集団の移植では奇形腫が形成される(左上)のに対し、
miR-302スイッチを導入し、iPS細胞集団を除去した場合には、奇形腫が形成されない(右上)。
3) iPS細胞を自動かつ選択的に除去することに成功した
これまでは、miR-302スイッチを導入し、iPS細胞で活性の高いmiRNAを感知すると、蛍光を発せず、それ以外では蛍光を発するという違いを利用し、
フローサイトメトリーで両者を識別していました。ここでは、蛍光タンパクをコードする遺伝子の代わりに、ピューロマイシン(薬剤)耐性遺伝子の発現をmiR-302で制御することで、
iPS細胞でのみ薬剤耐性遺伝子の発現が抑えられるしくみをつくりました。すなわち、薬剤存在下ではiPS細胞が死滅するのに対し、
iPS細胞以外の細胞では、薬剤耐性遺伝子が発現し、薬剤存在下でも生存するというしくみを構築しました。
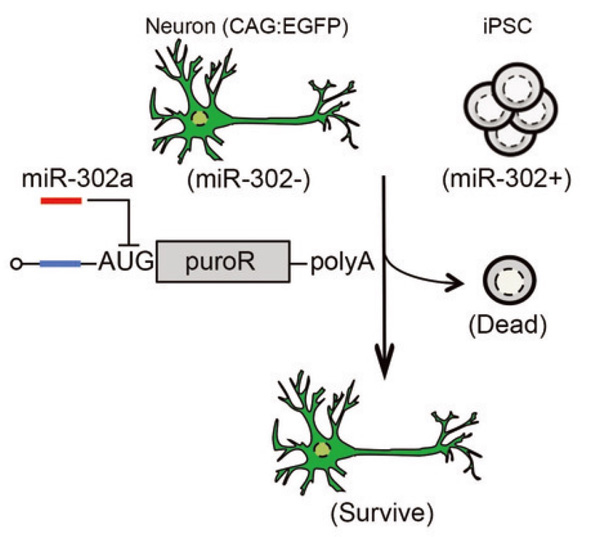
Fig. 4
ピューロマイシン耐性遺伝子を組み込んだRNAスイッチによるiPS細胞除去システム。
神経細胞とiPS細胞を混合し、ピューロマイシン耐性遺伝子を組み込んだmiR-302 スイッチを作用させることで、ピューロマイシン存在下でiPS細胞を選択的に死滅できる。
神経細胞は緑に光る(EGFP陽性)細胞を用いている。
そこで、iPS細胞から分化したドパミン神経細胞とiPS細胞が混在した細胞集団において、miR-302スイッチを導入したところ、薬剤存在下で、 iPS細胞を示すTRA-1-60陽性細胞が死滅し、有意に減少していることが観察されました。これにより、フローサイトメトリーを用いずとも、 miR-302スイッチを用いることでiPS細胞を除去できる可能性が示されました。すなわち、iPS細胞が混在する細胞集団にこのmiRNAスイッチを投与すれば、 薬剤存在下でiPS細胞のみを自動的に除去できる仕組みを構築しました。本手法は高価な機器や試薬を必要とせず、大量の細胞調整にも適応できると考えられます。
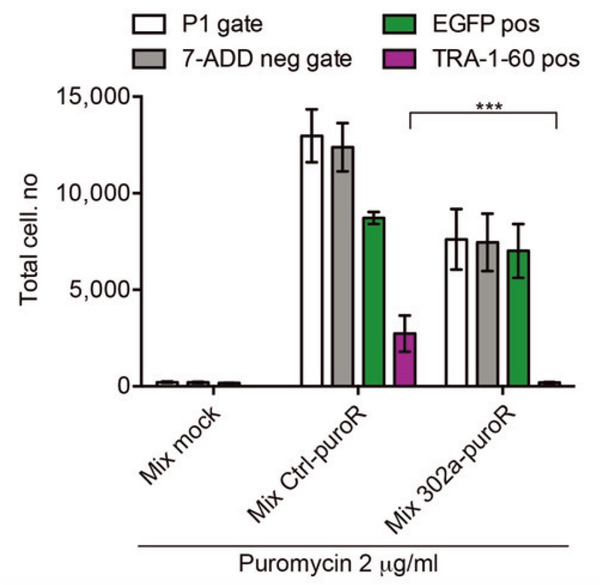
Fig. 5
miRNAスイッチを用いたiPS細胞の自動かつ選択的な除去。
ピューロマイシン耐性遺伝子を組み込んだmiR-302スイッチを作用させることで、
EGFPを発現する神経細胞(緑)が選別され、iPS細胞 (TRA-1-60陽性細胞)は除去される。
本研究によって、iPS細胞を含む多能性幹細胞で特異的に活性の高いmiRNAを感知することで、多能性幹細胞を選択的に識別・分離・除去することが可能になりました。 iPS細胞は株によって、他の細胞への分化のしやすさが異なることがあり、分化細胞集団の中に未分化なiPS細胞が残存する場合があります。 そのようなiPS細胞を選択的に除去することが再生医療を見据えた安全性や、研究において重要です。RNAスイッチはゲノムを傷つける心配がなく細胞内での寿命も短いため、 安全性の高い手法です。そのような点において、本手法によりiPS細胞を生きたまま、安全性高く選択的に分離・除去することができるようになったことは大きなメリットとなります。 また、今後、臨床への応用に加え、生細胞の分化や初期化のさらなる理解をめざした基礎研究にも貢献することが期待されます。
- 論文名
"MicroRNA-302 switch to identify and eliminate undifferentiated human pluripotent stem cells" - ジャーナル名
Scientific Reports - 著者
Callum J.C Parr*, Shota Katayama*, Kenji Miki, Yi Kuang, Yoshinori Yoshida, Asuka Morizane, Jun Takahashi, Shinya Yamanaka, and Hirohide Saito**
筆頭著者*
責任著者** - 著者の所属機関
京都大学iPS細胞研究所(CiRA)
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会・文部科学省 科学研究費補助金 「基盤研究A」 「基盤研究S」「新学術領域研究 分子ロボティクス」
- AMED:再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点
- 山中-バルザン基金
- キヤノン財団
- 公益財団法人 上原記念生命科学財団
- 公益財団法人 中谷医工計測技術振興財団
- iPS細胞研究基金
注1) マイクロRNA(miRNA)
20~30塩基程度の長さの短いノンコーディング(タンパク質をコードしていない)RNA。相補的な配列を持つmRNAと結合して翻訳を抑制したり、mRNAを分解したりすることで、そのmRNAからのタンパク質の合成を抑制する働きをもつと考えられている。
注2) メッセンジャーRNA(mRNA)
DNAの持っている遺伝情報(遺伝子配列)から転写され、合成されるRNA。このmRNAの配列に従って、アミノ酸が連結されてタンパク質が合成される。
注3) 奇形腫(テラトーマ)
ES細胞やiPS細胞を免疫不全マウスの皮下などに注射すると、腫瘍を形成する。この腫瘍はテラトーマと呼ばれ、様々な種類の組織が混在している。テラトーマを観察し、様々な組織に分化していることを確認することは、細胞の分化多能性を調べる一般的な方法の一つである。
注4) フローサイトメトリー
流動細胞計測法。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を解析することができる。






















