
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2017年5月19日
細胞種に応じてゲノム編集を制御する技術を開発
ポイント
- 細胞内には、細胞種によって異なる活性をもつマイクロRNA(miRNA)注1が存在する。
- 細胞内のmiRNA活性に応じて、ゲノム編集を制御するシステム「miR-Cas9 スイッチ」を開発した。
- HeLa細胞注2とiPS細胞それぞれに活性の高い細胞内miRNAを感知し、ゲノム編集を制御することができた。
- HeLa細胞とiPS細胞が混在した細胞集団において、HeLa細胞にだけ特異的にゲノム編集を行うことに成功した。
- 合成RNAを用いた手法のため、DNAを傷つける危険性を低減でき、安全性が高い。
弘澤萌大学院生(CiRA未来生命開拓部門)、齊藤博英教授(同部門)らの研究グループは、細胞種に応じてゲノム編集を制御する技術を開発しました。
CRISPR-Cas9システムは、ゲノムの狙った配列を特異的に切断し、特定の配列を削除したり、新たな配列を置換・挿入できるゲノム編集技術の一つとして注目されています。細胞内には、細胞種によって異なる活性をもつmiRNAが存在し、細胞のマーカーとしての利用が有望視されています。研究グループは、細胞内にあり、細胞種によって異なる活性をもつmiRNAを利用することで、細胞種を識別し、それに応じてCRISPR-Cas9システムの働き、つまり、ゲノム編集を制御できる新たな手法を開発しました。具体的には、HeLa細胞、iPS細胞それぞれで特異的に活性の高いmiRNAに応答するCRISPR-Cas9システム「miR-Cas9スイッチ」を構築し、
細胞内に導入しました。すると、それぞれで活性が高いmiRNAが存在する場合は、導入されたCas9遺伝子からCas9(DNAを切断する酵素)が作られず、標的の緑色蛍光タンパクを作るDNAが切断されないため、蛍光を発しました。一方、それぞれで活性が高いmiRNAが存在しない場合はCas9が作られ、緑色蛍光タンパクを作るDNAが切断され、弱い蛍光強度を示しました。これを利用し、HeLa細胞とiPS細胞が混在する細胞集団において、iPS細胞には影響を与えず、HeLa細胞にだけ特異的にゲノム編集を行うことに成功しました。
本技術により、細胞種に応じたゲノム編集の制御ができるようになりました。今後、目的の細胞を選別して再生医療研究や創薬研究などに役立てるという応用や、生体内において目的の細胞のみにゲノム編集を行うことで、遺伝病治療のための技術としての可能性が期待されます。
この研究成果は2017年5月19日に英国科学誌「Nucleic Acids Research」でオンライン公開されました。
CRISPR-Cas9システムは、Cas9というゲノムを切断する酵素を利用してゲノムの狙った特定配列を特異的に切断し、もともと細胞に備わっている修復機構を利用して特定の配列を削除したり、新たな配列を置換・挿入できるゲノム編集技術の一つとして注目されています。多様な細胞にCRISPR-Cas9システムを導入すると、細胞種に関係なくゲノム編集が行われてしまいます。そこで、特定の細胞種を認識し、細胞種に応じてゲノム編集を制御できるような技術が求められています。
これまで、ウイルスベクターやプラスミドDNAを用いてCRISPR-Cas9システムを導入する方法などが検討されてきましたが、これらのDNAが細胞内DNAにランダムに組み込まれてしまい、がん化を起こす危険性などが指摘されています。そこで、そのような心配のないRNAを用いCRISPR-Cas9システムを導入し、細胞種に応じたゲノム編集の制御を可能とする技術が求められています。
研究グループは細胞を識別するための目印として、miRNAに着目しました。miRNAは、タンパク質をコードしていないRNAの1つで、メッセンジャーRNA(mRNA)注3からタンパク質への翻訳を抑制する働きがあります。様々な種類のmiRNAが細胞内に存在しますが、その細胞種によってよく働いている(活性が高い)miRNAの種類は異なります。そのため、ある細胞内で活性の高いmiRNAは、その細胞の目印として用いることができると考えられます。
今回、グループは細胞内のmiRNAの活性に応じて、ゲノム編集のオン・オフを制御できるシステムを合成mRNAを用いて開発しました。
1. 細胞内のmiRNA活性に応じてゲノム編集の制御できる技術を開発した
まず、グループは細胞種により異なる活性を示す細胞内miRNAに着目し、特定のmiRNAを認識する配列とCRISPR-Cas9技術においてゲノムを切断する酵素Cas9を作る配列を組み込んだmRNAを合成し、miR-Cas9スイッチと名付けました。
本スイッチをmiRNAの活性が低い細胞に導入すると、Cas9タンパクが作られ、緑色蛍光色素を作るEGFP遺伝子へと誘導するガイドRNAと結合し、標的のEGFP遺伝子を切断します。
EGFP遺伝子が切断された細胞は蛍光を発しません。一方、miRNAの活性がある細胞内では、miRNAがその認識配列と結合することにより、Cas9タンパクの合成が抑制され、作られません。
そのため、EGFP遺伝子は切断されることなく、細胞は緑色蛍光を発します。つまり、あるmiRNAの活性の低い目的外の細胞ではゲノム編集機構がオンとなり、
miRNAの活性の高い目的の細胞ではゲノム編集機構がオフとなります。
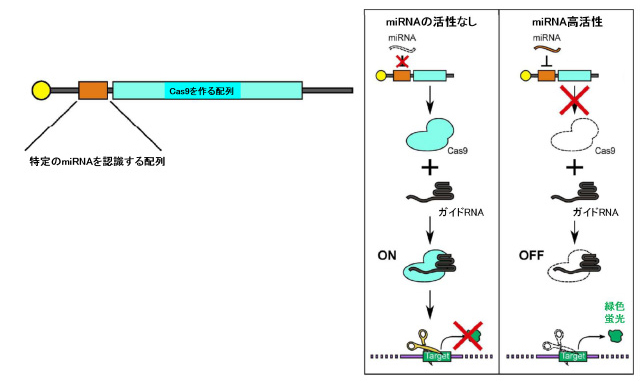
図1. miR-Cas9スイッチの構造(左)と働き(右)
2. 実際の細胞でゲノム編集を制御できることを確認した
次にグループは実際の細胞で本スイッチにてゲノム編集を制御できるか実験を行うため、
HeLa細胞で活性の高いmiRNA(miR-21)を検知するスイッチ(miR-21-Cas9スイッチ)、
iPS細胞で活性の高いmiRNA(miR-302)を検知するスイッチ(miR-302-Cas9スイッチ)、
miRNAを感知する配列を持たない対照スイッチを用意しました。
まず、実際にHeLa細胞にmiR-21-Cas9スイッチ、miR-302-Cas9スイッチ、そして対照スイッチを導入し、
miR-21-Cas9スイッチを導入した場合にCas9の産生が抑えられることを確認しました。
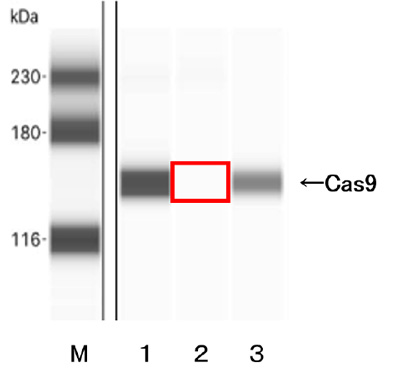
図2. HeLa細胞におけるCas9の産生HeLa細胞に下記の各スイッチを導入した。
miR-21-Cas9スイッチ(2)を導入すると、Cas9の産生が抑えられた(赤で囲まれたところ)。
(Mはマーカー。)
1:対照スイッチ、2:miR-21-Cas9スイッチ、3:miR-302-Cas9スイッチ
次に、EGFP遺伝子を組み込んだHeLa細胞に、miR-21-Cas9スイッチ、miR-302-Cas9スイッチ、そして対照スイッチのそれぞれを導入し、72時間後に細胞の蛍光強度をフローサイトメトリー注4で計測しました。すると、対照スイッチとmiR-302-Cas9スイッチを導入したHeLa細胞は蛍光強度が低く、miR-21-Cas9スイッチを導入したHeLa細胞は高い蛍光強度を示しました。なお、miR-21を阻害したところ、蛍光強度が低くなりました。
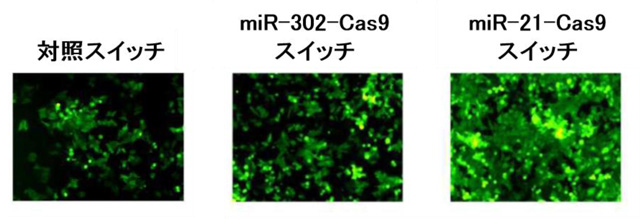
図3. HeLa細胞におけるmiR-21-Cas9スイッチの働き
HeLa細胞にmiR-21-Cas9スイッチを導入すると、Cas9が作られず、高い蛍光強度を示した。
また、iPS細胞に実験を行ったところ、対照スイッチとmiR-302-Cas9スイッチ、さらにmiR-302を阻害した上でmiR-302-Cas9スイッチを導入しました。
すると、miR-302を阻害せずにmiR-302-Cas9スイッチを導入したiPS細胞は高い蛍光強度を示しましたが、miR-302を阻害してmiR-302-Cas9スイッチを導入したiPS細胞は低い蛍光強度を示しました。
このことから、miR-302-Cas9スイッチがiPS細胞で活性のあるmiR-302により制御されていることが確認できました。
これらの結果より、本スイッチを用いることで、各細胞内で活性の高いmiRNAを感知して細胞種ごとにゲノム編集を制御できることが示されました。
3. 異種の細胞が混在した細胞集団においても、目的の細胞を識別し、ゲノム編集を制御できる
さらに研究グループは、miR-Cas9スイッチが異なる細胞種が混在している細胞集団においても目的の細胞を識別した上でゲノム編集を制御できるかを調べました。
HeLa細胞とiPS細胞を培養皿上で混在させ、iPS細胞で活性の高いmiR-302を認識するmiR-302-Cas9スイッチと対照スイッチを導入し、72時間後に細胞群の蛍光強度を調べました。この際、TRA-1-60抗体という、多能性幹細胞(iPS細胞を含む)に特異的な細胞表面マーカーを利用して、HeLa細胞とiPS細胞が見分けられるようにしました。
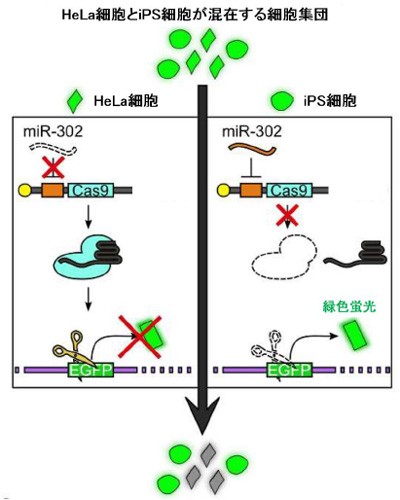
図4. 混在する細胞集団における目的の細胞の識別とゲノム編集制御のしくみ
すると、対照スイッチを導入した場合は、HeLa細胞とiPS細胞の双方に蛍光を発しない細胞が見られましたが、miR-302-Cas9スイッチを導入すると、
蛍光を発しない細胞のほぼすべてがHeLa細胞でした。この結果は、miR-302-Cas9スイッチの導入により、選択的にiPS細胞ではゲノム編集機構がオフとなり、HeLa細胞ではオンとなったことを示しており、miR-Cas9スイッチによって異種の細胞が混在した細胞集団においても細胞を識別し、ゲノム編集を制御できることを示しています。
4. miRNA活性が高い細胞でゲノム編集を引き起こすことも可能となった
最後に研究グループは、miRNA活性が高い細胞でゲノム編集を引き起こすシステム、miR-Cas9オンスイッチも開発しました。
ここでは、グループが過去に開発した、RNAからなる人工回路(参照:2015年8月4日 CiRA HP掲載「細胞の機能を精密に制御する人工回路をRNAで構築: ヒトの細胞で成功」)を活用しました。
2種類の合成mRNA (miRNAに応答してRNA結合タンパクの産生を制御するmRNAと、RNA結合タンパクに応答してCas9タンパクの産生を制御するmRNA) を導入することで、HeLa細胞で標的とするmiR-21に応答して、ゲノム編集を活性化することに成功しました。したがって、標的細胞で目印となるmiRNAに応答して、ゲノム編集をオフにすることも(オフスイッチ)、オンにすることも可能となります。
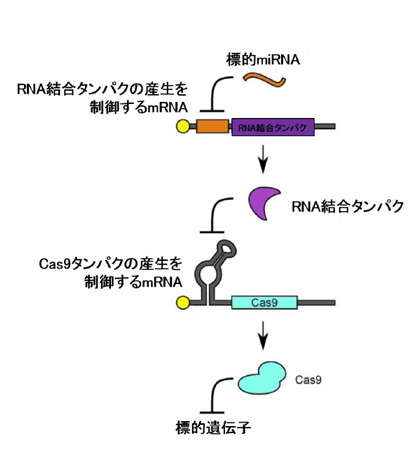
図5. miR-Cas9オンスイッチのしくみ
本研究では、細胞種により活性の違うmiRNAを応用することで、細胞種に応じたゲノム編集の制御を可能とする技術を開発しました。本技術は安全性の高いRNAを利用しているため、将来的な医療応用にも役立てられると考えられます。正常細胞に対する不用意なゲノム編集のリスクの低減できることから、今後、目的の細胞を選別して再生医療研究や創薬研究などに役立てるとともに、細胞の内部環境 (miRNAの状態)に応じたゲノム編集が実現できるため、細胞状態の記録や機能改変など、基礎研究での活用も期待できます。
- 論文名
Cell-type-specific genome editing with a microRNA-responsive CRISPR-Cas9 switch - ジャーナル名
Nucleic Acids Research - 著者
Moe Hirosawa1,2, Yoshihiko Fujita1, Callum J.C Parr1, Karin Hayashi1, Shunnichi Kashida1, Akitsu Hotta1, Knut Woltjen1,3, and Hirohide Saito1 - 著者の所属機関
- 京都大学iPS細胞研究所
- 京都大学大学院医学研究科
- 京都大学白眉センター
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会 科学研究費補助金 「基盤研究S」
- 日本学術振興会 特別研究員制度
- 公益財団法人 内藤記念科学振興財団
- キヤノン財団
- 公益財団法人 上原記念生命科学財団
注1) マイクロRNA(miRNA)
20~30塩基程度の長さの短いノンコーディング(タンパク質をコードしていない)RNA。相補的な配列を持つmRNAと結合して翻訳を抑制したり、mRNAを分解したりすることで、そのmRNAからのタンパク質の合成を抑制する働きをもつと考えられている。
注2) HeLa細胞
ヒト由来の最初の細胞株。ヒト子宮頸がんから分離され株化された細胞で、世界中で広く研究に利用されている細胞の1つ。
注3) メッセンジャーRNA(mRNA)
DNAの持っている遺伝情報(遺伝子配列)から転写され、合成されるRNA。このmRNAの配列に従って、アミノ酸が連結されてタンパク質が合成される。
注4) フローサイトメトリー
流動細胞計測法。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を解析することができる。






















