
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2017年7月27日
高品質なES細胞を高効率で作製する方法を同定
- 多能性幹細胞(ES細胞やiPS細胞)を安定的に作製する方法として、2i法注1が広く用いられている。
- 2i法で作製したマウスES細胞では、ゲノムインプリント注2が消去されている。
- 2i法で作製した雌のマウスES細胞からは、発生過程における異常のため、マウス個体が得られなかった。
- 従来の2i法に代わる、高い発生能力を有するES細胞の作製方法を見出した。
八木正樹大学院生(京都大学CiRA未来生命科学開拓部門)、山田泰広教授(京都大学CiRA同部門)、山本拓也特定拠点講師(京都大学CiRA同部門)らの研究グループは、若山照彦教授(山梨大学)らの研究グループとの共同研究により、高品質なマウスES細胞を高効率で作製する方法を同定しました。
ES細胞(胚性幹細胞)は、受精卵から発生が少し進んだ胚盤胞の中の内部細胞塊の細胞を取り出して培養することにより作製される多能性幹細胞です。代表的な作製方法である2i法を用いることで、高効率で高い多能性をもった均一なES細胞を得ることができますが、その質や安定性についてはさらなる研究が必要です。
本研究では、まず、2i法で作製したマウスES細胞(2i/L ES細胞)のDNAメチル化注3状態を調べました。すると、広範なゲノムでDNA低メチル化が見られ、とりわけ雌の2i/L ES細胞で発生に重要な役割を果たす、父親あるいは母親由来の遺伝子に対するゲノムインプリントが消去されていました。それにより、2i/L ES細胞からは多能性の指標ともなる、マウス個体の発生に異常が起き、マウスが生まれないことが分かりました。さらに、グループは2i法に含まれる阻害剤の一つの濃度を低くする、あるいは他種の阻害剤で代替することにより、これらの課題を解決できることを突き止めました。
本成果は高品質なマウス多能性幹細胞、さらにはヒト多能性幹細胞の作製・維持に応用できると考えられます。その技術を利用することで、再生医療やほ乳類の初期発生に関する基礎研究に貢献できると期待されます。
この研究成果は2017年7月26日(英国時間:日本時間7月27日)に英国科学誌「Nature」でオンライン公開されました。
ES細胞は、いくらでも増やすことができ、体のあらゆる細胞に変化(分化)する能力(多能性)をもつ多能性幹細胞です。ES細胞は受精卵から発生が数日進んだ胚盤胞の中にある内部細胞塊から採取した細胞を培養皿上で培養することで作製されます。
多能性幹細胞を作製する代表的な方法として、2i法があります。これは、MEKとGsk3というタンパク質を阻害して発生の進行に必要なシグナルを遮断することで、多能性状態を維持する方法です。2i法を用いると、血清培地を用いる作製法に比べ、高効率で、均一性が高く、受精卵の着床前段階と同等の高い多能性状態にあるナイーブ型注4 ES細胞を作製することが可能とされていますが、2i法で作製されたES細胞の質や安定性への理解にはさらなる検証が必要です。
そこで、山田教授、山本講師らのグループは、2i法で作製されたES細胞のエピジェネティクス注3特性や機能を調べるため、ES細胞のDNAメチル化やゲノムインプリンティング、多能性の指標である発生能力に着目し、検討を行いました。
1. 2i法で作製した雌のマウスES細胞では、ゲノムインプリントが消去されている
まず研究グループは、マウスの胚盤胞(雌雄)の内部細胞塊から、2i法と阻害剤の入っていない血清培地を用いた培養法の二つの方法で、マウスES細胞を作製しました(それぞれ2i/L ES細胞、S/L ES細胞)。
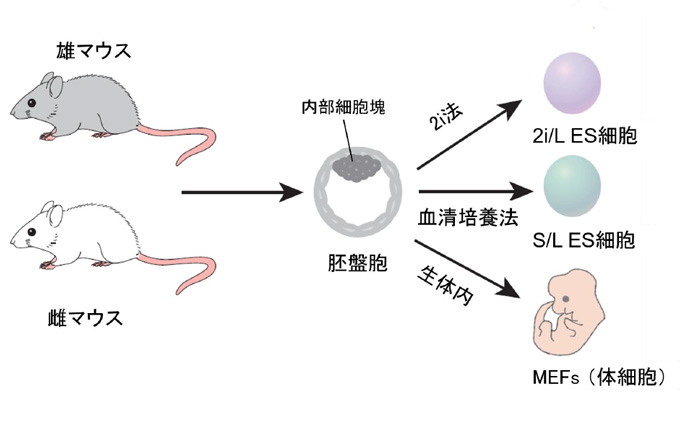
図1. 本研究でのマウスES細胞の作製方法
マウスを交配させて雌雄複数の胚盤胞を得、それぞれの内部細胞塊からES細胞を作製した。
次に、各ES細胞と体細胞におけるインプリンティング制御領域注5でのDNAメチル化状態を調べました。すると、とりわけ雌の2i/L ES細胞においてDNA低メチル化状態であることが分かりました。
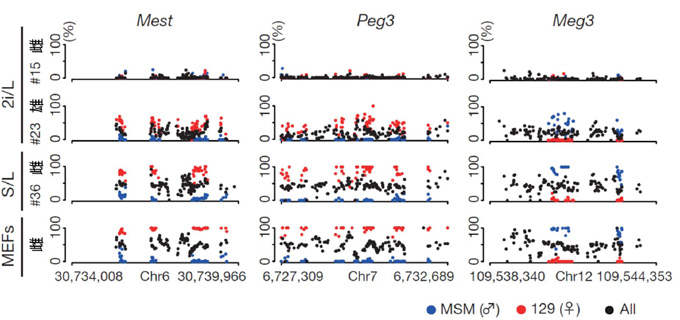
図2. インプリンティング制御領域における
DNAメチル化状態
MestとPeg3は母親由来の対立遺伝子がメチル化され、父親由来の対立遺伝子のみ発現するインプリント遺伝子注2。Meg3は、父親由来の対立遺伝子がメチル化されることで、母親由来の対立遺伝子のみが発現する対立遺伝子。グラフの縦軸は、DNAメチル化レベル(%)を示す。 インプリンティング制御領域において、雄、雌ともに2i/L ES細胞ではDNAメチル化レベルが低下しているが、とりわけ雌の2i/L ES細胞ではほぼ消失している。
さらに、DNA低メチル化状態によりゲノムインプリンティングに変化があるかを調べたところ、本来であればゲノムインプリンティングにより父親由来あるいは母親由来いずれかの対立遺伝子のみを発現するインプリント遺伝子において、双方由来の対立遺伝子がともに発現していました。この結果から、2i/L ES細胞ではゲノムインプリンティングが消去されているという異常が起きていることが分かりました。
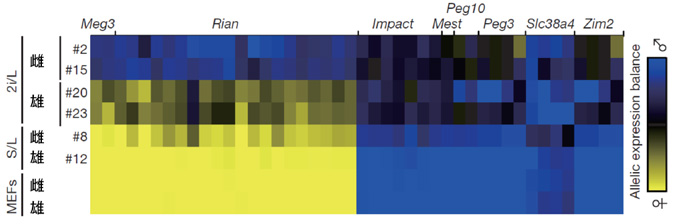
図3. 2i/L ES細胞、S/L細胞、体細胞における
インプリント遺伝子の発現のようす
黄色あるいは青色に近いほど、母親由来あるいは父親由来いずれかの対立遺伝子のみが発現しており、黒色に近いほど両対立遺伝子が発現していることを示す。2i/L ES細胞ではS/L ES細胞や体細胞と比較すると、両対立遺伝子が発現しているようすがわかる。
2. 2i法で作製した雌のマウスES細胞では発生能力が損なわれていた
ゲノムインプリンティングの異常が個体の発生異常につながることがあります。そこで、グループは2i/L ES細胞(雌)からマウスの個体が発生するかどうかを調べることで、2i/L ES細胞の多能性の評価を行いました。
まず、核を除いた卵子にES細胞の核を移植し、発生させることでクローンマウスが作製できるかを調べました。すると、S/L ES細胞からは正常な胎盤が形成されてクローンマウスが生まれた一方、2i/L ES細胞からは胎盤の発育異常が見られ、クローンマウスが生まれませんでした。
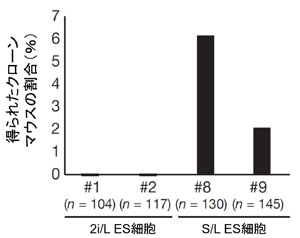
図4. 2i/L ES細胞およびS/L ES細胞から作製された
クローンマウスの割合
S/L ES細胞(右)からはクローンマウスが作製できたが、
2i/L ES細胞(左)からはクローンマウスが生まれなかった。
図4. 2i/L ES細胞およびS/L ES細胞から作製された
クローンマウスの割合
S/L ES細胞(右)からはクローンマウスが作製できたが、 2i/L ES細胞(左)からはクローンマウスが生まれなかった。
また、四倍体補完法注6にて全身がES細胞に由来するマウスの作製に試みた結果、S/L ES細胞からはマウス個体が生まれましたが、2i/L ES細胞からはマウスが生まれませんでした。これらの結果から、2i/L ES細胞ではDNAメチル化が失われインプリントが消去されたことにより、発生能力が損なわれたと考えられます。
3. 従来の2i法に代わるES細胞の作製方法を見出した
先行研究により、ES細胞の分化誘導に関わるMAPKシグナルの阻害がDNAの低メチル化に関与することが分かっています。これより、2i法の培地に含まれるMEK(MAPKシグナルを構成するタンパク質)阻害剤がインプリント消去の原因である可能性を検証するため、1)MEK阻害剤の濃度を低くする(t2i/L)、2)MEK阻害剤の代わりにSrc阻害剤を使用する(a2i/L)という二つの条件で、ES細胞を作製しました。それぞれの方法で作られたES細胞を調べてみると、インプリントが保たれていることが分かりました。
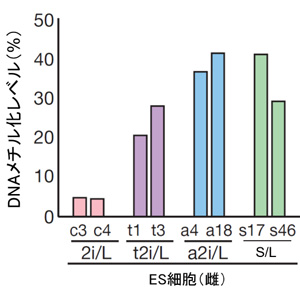
図5. 各培養法で作製したES細胞(雌)のインプリント制御領域におけるDNAメチル化レベル
t2i/L ES細胞とa2i/L ES細胞では、2i/L ES細胞よりもインプリントが消去されずに保たれている。
図5. 各培養法で作製したES細胞(雌)のインプリント
制御領域におけるDNAメチル化レベル
t2i/L ES細胞とa2i/L ES細胞では、2i/L ES細胞よりもインプリントが消去されずに保たれている。
さらに、四倍体補完法により、t2i/L ES細胞、a2i/L ES細胞からは全身がES細胞に由来する細胞でできたマウスが生まれました。このことから、とりわけa2i/L ES細胞は高い発生能力を有することが示されました。
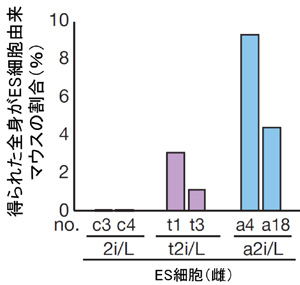
図6. 各培養法で作製したES細胞(雌)の発生能力
t2i/L ES細胞とa2i/L ES細胞からは、全身がそれらに由来する
マウスが生まれ、その効率はa2i/L ES細胞でより高かった。
図6. 各培養法で作製したES細胞(雌)の発生能力
t2i/L ES細胞とa2i/L ES細胞からは、全身がそれらに由来するマウスが生まれ、その効率はa2i/L ES細胞でより高かった。
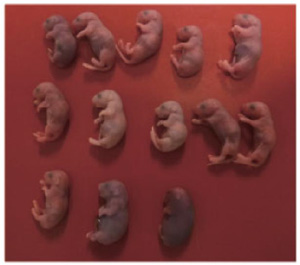
図7. 全身がa2i/L ES細胞由来の細胞で構成されるマウス
図7. 全身がa2i/L ES細胞由来の細胞で構成されるマウス
本研究より、2i法は高効率で、着床前段階と同等の高い多能性をもつES細胞を作製できる一方、ゲノムインプリンティングという発生に重要に記憶が消去されてしまい、発生能力が低下することが分かりました。しかしながら、2i法の培地に含まれるMEK阻害剤の濃度を低くする、あるいは他の阻害剤で代替することで、インプリントの記憶が維持され、高い発生能力をもつES細胞を作製することに成功しました。本手法はマウス多能性幹細胞の作製や維持に役立つだけでなく、ヒトの高品質な多能性幹細胞の作製にも応用できる可能性があります。将来は、再生医療やほ乳類の初期発生に関する基礎研究に貢献できると期待されます。
- 論文名
"Derivation of ground-state female ES cells maintaining gamete-derived DNA methylation" - ジャーナル名
Nature - 著者
Masaki Yagi1, Satoshi Kishigami2, Akito Tanaka1, Katsunori Semi1, Eiji Mizutani2, Sayaka Wakayama2, Teruhiko Wakayama2, Takuya Yamamoto1*, Yasuhiro Yamada1*
* 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所
- 山梨大学
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 国際科学技術共同研究推進事業(戦略的国際共同研究プログラム)
- AMED 次世代がん医療創生研究事業
- AMED 革新的先端研究開発支援事業
- AMED再生医療実現拠点ネットワークプログラムiPS細胞研究中核拠点
- 日本学術振興会 科学研究費補助金 「基盤研究B」「新学術領域研究」
- 高松宮妃癌研究基金
- 公益財団法人 武田科学振興財団
- 公益財団法人 内藤記念科学振興財団
- iPS細胞研究基金
注1) 2i法
多能性幹細胞(ES細胞やiPS細胞)を作製する代表的な培養方法。分化誘導に関わる経路を構成するMEKやGskタンパク質を阻害する化合物が培地に含まれている。2i法では、高い効率で均一性の高い多能性幹細胞を作製することができる。
注2) ゲノムインプリンティング
多くの遺伝子では、原則として父親由来、母親由来双方の対立遺伝子がどちらも同じように働く、あるいは働かないよう制御されている。しかし、いくつかの遺伝子(インプリント遺伝子)においては、生殖細胞(精子あるいは卵子)ができる過程で父親由来あるいは母親由来の遺伝子に「しるし」(DNAメチル化)がつけられ、遺伝子が働かなくなる(発現しない)。そして、この「しるし」は受精卵や子の体細胞に記憶(維持)される。たとえば、父親由来でのみ働くインプリント遺伝子の場合、母親由来の対立遺伝子にDNAメチル化が起こり発現されないしくみになっている。体細胞におけるインプリンティングの維持はほ乳類の発生に重要であることがわかっている。
注3) DNAメチル化
DNAの塩基配列の変化を伴わずに、遺伝子発現を制御する機構をエピジェネティクスという。DNAメチル化はエピジェネティクスのしくみの一つで、DNA中の特定の配列で炭素原子にメチル基が付加することを指す。
注4) ナイーブ型
多能性幹細胞には「ナイーブ型」と「プライム型」がある。マウスES細胞は、着床前の胚盤胞という段階の内部細胞塊から作製されるが、培養皿上で内部細胞塊と同等の未分化状態を維持でき、これを「ナイーブ型」と呼ぶ。一方、発生の少し進んだ着床後の胚と同等の未分化状態のものを「プライム型」と呼ぶ。多能性の度合いは、「ナイーブ型」が「プライム型」よりも高いと考えられている。
注5)インプリンティング制御領域
精子や卵子が作られる過程で、DNAメチル化などのエピジェネティクス修飾を受けてインプリント遺伝子の発現を制御しているゲノム上の領域。
注6) 四倍体補完法
多能性幹細胞の多能性を評価するための手法。受精卵が一度分裂した二細胞期に、二つの細胞を電気的に融合し、少し発生させることで四倍体(通常の細胞は二倍体)の胚盤胞を得る。胚盤胞にES細胞を注入して発生させると、四倍体細胞は胎盤に分布して機能するが胎仔には寄与せず、ES細胞のみからなる胎仔が形成される。これによりES細胞が多能性をもつことを証明できる。






















