
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2020年6月5日
ラパマイシンの予防的投与はFOPモデルマウスの異所性骨化に対し優れた抑制効果を示す
ポイント
- FOPマウス(注1)において自然発生する異所性骨がラパマイシン(注2)の予防的投与により抑制された。
- ラパマイシンは異所性骨化形成の初期段階である炎症期にも抑制効果を示し、筋損傷後に誘発される非損傷部位の異所性骨化に対しても抑制効果を示した。
- ラパマイシンの予防的投与により異所性骨切除後の再発を軽減することができた。
進行性骨化性線維異形成症(FOP)とはACVR1(注3)という受容体遺伝子の突然変異により、全身の結合組織に異所性骨化が生じる疾患で、いままでの研究からアクチビンA(注4)がACVR1に結合して骨化シグナルを伝達することが示されていました。異所性骨化には外傷を契機に生じる場合と、明らかな誘引なく形成される場合があります。
前川裕継 大学院生(京都大学CiRA増殖分化機構研究部門/医学研究科整形外科)、戸口田淳也 教授(京都大学CiRA 増殖分化機構研究部門/ウイルス・再生医科学研究所/医学研究科)らの研究グループは、FOPマウスを用いてmTOR阻害剤であるラパマイシンの予防的投与による異所性骨化形成の抑制効果を検証し、自然発生する異所性骨、外傷後の非損傷部位に生じる異所性骨が抑制されることを示しました。また、既に形成された異所性骨に対して、切除前よりラパマイシンの投与を行うことで、異所性骨切除後の再発が軽減されることを確認しました。これらの結果から、臨床面においてもラパマイシンの予防的投与による有効性が期待されます。
この研究成果は2020年5月24日に「Orphanet Journal of Rare Disease」で公開されました。
FOPは靭帯や腱など全身の結合組織に進行性の異所性骨化を呈する疾患です。頻度は200万人に1人と極めて稀で、骨の形成に関わるBMPの受容体であるACVR1の点突然変異が原因であることが知られています。異所性骨化には外傷を契機に生じる場合と、明らかな誘引なく形成される場合が知られています。異所性骨化の形成にはまず炎症細胞の浸潤が生じ、間葉系間質細胞(注5)の集積/軟骨分化が生じ、骨形成が起きると考えられていますが、まだ異所性骨化を抑制するのに有効な治療法は確立されておりません。また、すでに形成された異所性骨化に対しては手術が検討されますが、侵襲を伴うため再発を来すために禁忌とされています。
これまでに、研究グループではFOP患者さん由来のiPS細胞(FOP-iPS細胞)を用いた実験で、アクチビンAが変異したACVR1に結合して異常なシグナルを伝えることで、間葉系間質細胞の軟骨分化を促進することを同定しました。さらにFOP-iPS細胞を用いた薬剤スクリーニングにてmTOR阻害剤であるラパマイシンがアクチビンAによる軟骨分化を抑制することを発見し、FOPマウスモデルにおいても外傷後の異所性骨形成が抑制されることを確認しました。
今回はFOPマウスモデルにおいて、自然に形成される異所性骨、外傷後に形成される異所性骨、異所性骨切除後の再発に対するラパマイシンの効果の確認・投与時期の検証を行いました。
1. 自然発生する異所性骨に対するラパマイシンの予防的投与
変異ACVR1を発現させたFOPマウスを単独で飼育し、Vehicle(コントロール)またはラパマイシンの投与を行い、異所性骨の形成をCTで評価しました。Vehicle投与群では外傷を加えなくても全例に顎、股関節、肋骨周囲などに異所性骨化が観察されましたが、ラパマイシン投与群では異所性骨の発生率・体積ともに低下が認められました。
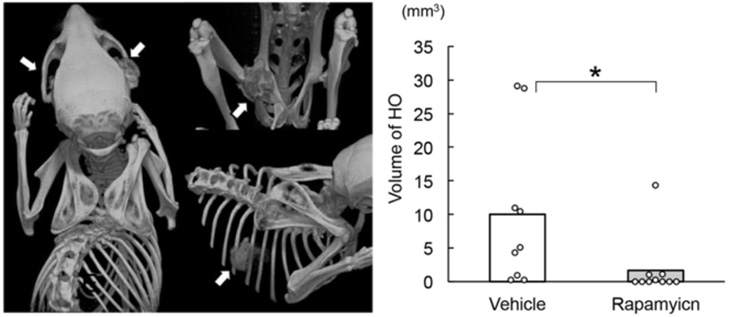
図1:FOPマウスにおける自然発生する異所性骨に対するラパマイシンの効果
左から
- 3D μCT画像:FOPマウスで自然発生した異所性骨(矢印)
- 異所性骨の体積:Vehicleとラパマイシンの比較
2. 外傷後異所性骨化に対するラパマイシンの投与時期の検討
FOPマウスに対して骨格筋損傷を加え、ラパマイシンを損傷前・損傷時に投与開始した場合に形成される異所性骨化の体積を比較しました。筋損傷部位の異所性骨化はどちらの治療群でも抑制効果が認められましたが、FOPマウスでは筋損傷後に非損傷部位でも異所性骨の形成がみられ、ラパイシン先行投与群でのみ有意に抑制されました。
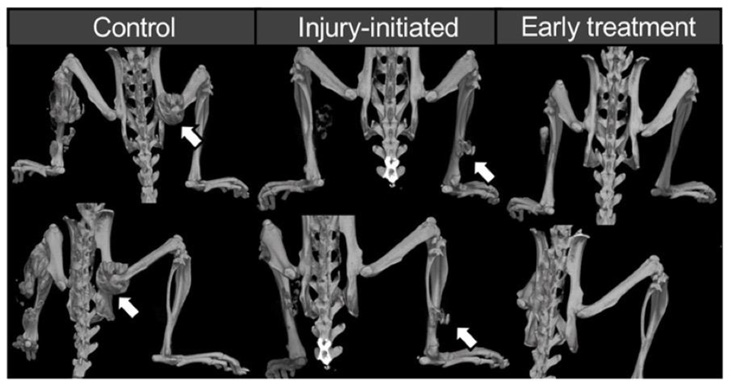
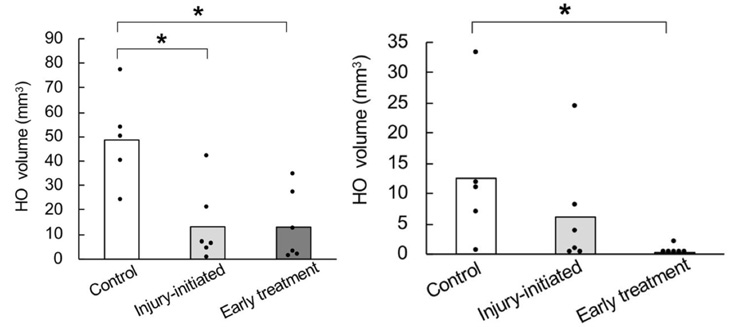
図2:骨格筋損傷に対するラパマイシンの投与時期の検討
上から
- 3D μCT画像:FOPマウスに生じた異所性骨
(損傷部位; 矢頭, 非損傷部位; 矢印) - 損傷部位における異所性骨の体積
- 非損傷部位における異所性骨の体積
3. 異所性骨化形成初期におけるラパマイシンの効果
骨格筋損傷後早期の炎症期におけるラパマイシンの効果をFOPマウスの組織切片で確認したところ、ラパマイシンにより単球/マクロファージなどの炎症細胞の浸潤が抑制され、異所性骨化形成の初期においても抑制効果がみられました。
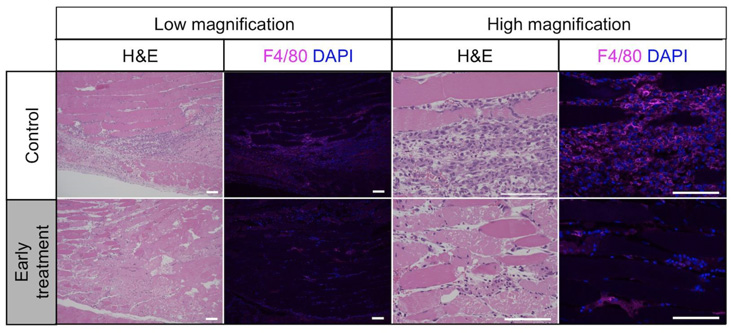
図3:骨格筋損傷後初期の組織像
上段:コントロール群、下段:ラパマイシン先行投与群
ラパマイシン先行投与群ではF4/80陽性細胞の浸潤が減少しています
H&E = ヘマトキシリン・エオジン染色
F4/80 = 単球/マクロファージのマーカーに対する染色
DAPI = 核に対する染色
4. 異所性骨切除後の再発に対するラパマイシンの効果
FOPマウスをコントロール群、ラパマイシン切除時投与開始群、先行投与群に分け、骨格筋損傷後に形成された異所性骨の切除を行い、異所性骨の再発を評価しました。
異所性骨の切除により、いずれの群においても異所性骨の体積は減少しましたが、コントロール群では異所性骨の再発を認めました。ラパマイシン投与を行ったどちらの群でも再発は抑制されましたが、先行投与群の方が抑制効果は顕著でした。
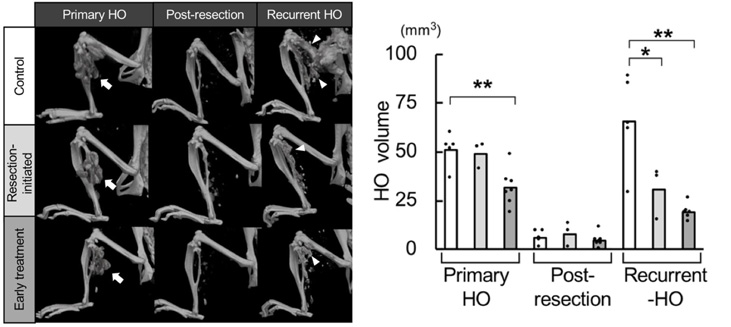
図3:異所性骨切除前・切除後・再発の推移
左から
- 3D-μCT:上段= コントロール群、中段= 切除時投与開始群、
下段= 先行投与群 - 異所性骨の体積
本研究では、FOPマウスを用いて、自然発生する異所性骨、損傷後に生じる異所性骨、異所性骨切除後の再発に対するラパマイシンの予防的投与による効果を検証し、有効性を確認しました。これらの結果から、臨床面においてもラパマイシンの予防的投与による有効性が期待されますが、異所性骨切除後の再発に対してはより強固に抑制する治療法を今後さらに探求する予定です。
- 論文名
Prophylactic treatment of rapamycin ameliorates naturally developing and episode -induced heterotopic ossification in mice expressing human mutant ACVR1 - ジャーナル名
Orphanet Journal of Rare disease - 著者
Hirotsugu Maekawa1,2*, Shunsuke Kawai1,2,3, Megumi Nishio3, Sanae Nagata1, Yonghui Jin3,4, Hiroyuki Yoshitomi2,3, Shuichi Matsuda2, Junya Toguchida1,2,3,4**
* 筆頭著者
** 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所
- 京都大学大学院医学研究科整形外科
- 京都大学ウイルス・再生医科学研究所
- 京都大学医学部附属病院 臨床研究総合センター
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会(JSPS)科学研究費助成事業
-
日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
iPS細胞研究中核拠点
疾患特異的iPS細胞の利活用促進・難病研究加速プログラム - 日本医療研究開発機構(AMED)革新的先端研究開発支援事業
(注1) FOPマウス
ドキシサイクリン投与によりFOPで報告されているヒト変異ACVR1を発現するマウス。研究グループにより作製された(Hino S, et al. PNAS 2015;112:15438-43)。
(注2)ラパマイシン
臓器移植後の拒絶反応を抑える目的などで使用されている免疫抑制薬で、タンパク質合成、細胞増殖などに関わるmTORの活性を阻害する効果を持つ。
(注3) ACVR1
BMP(骨形成タンパク質)受容体で、FOPでは点突然変異によりアミノ酸の一つが置換されることで、通常は結合しても活性を示さないアクチビンAによりBMPシグナルが伝達されることが判明している。
(注4) アクチビンA
組織修復、神経分化、造血など多くの生理機能を調節する作用を持つタンパク質で、線維芽細胞、軟骨、単球/マクロファージなどの細胞から産生される。
(注5) 間葉系間質細胞
骨・軟骨・脂肪細胞などといった間葉系の細胞に分化する能力を持った細胞で、研究グループはiPS細胞から分化・誘導する方法を確立した。






















